Waardenburg综合征人工耳蜗植入效果与螺旋神经节细胞衰退特征的相关性分析
2019-01-14罗意冀飞陈伟李佳楠洪梦迪王倩陈艾婷杨仕明
罗意 冀飞 陈伟 李佳楠 洪梦迪 王倩 陈艾婷 杨仕明
中国人民解放军总医院 解放军医学院耳鼻咽喉头颈外科(北京100853)
耳聋是严重影响人类生活质量的一类感觉性残障疾病,先天性耳聋患者的病因中约60%-80%为遗传,而综合征耳聋约占其中的30%。Waardenburg综合征(Waardenburg Syndrome,WS)是一种以听觉-色素异常为特征的常染色体遗传性疾病,多为显性遗传,也可表现为隐形遗传。发病率估计为1/42,000,22-55%的WS患者有耳聋,占先天性耳聋患者的2%-5%[1,2]。WS的致病基因目前发现的有6个:PAX3、MITF、EDN3、EDNRB、SOX10和 SNAI2。其临床表现主要为:遗传性感音神经性耳聋、虹膜异色、前额白发及内眦异位,根据不同的临床表现及基因型,可分为Ⅰ-Ⅳ型,根据有无内眦异位分为Ⅰ型及Ⅱ型,Ⅰ型合并上肢畸形为Ⅲ型,Ⅱ型合并先天性巨结肠为Ⅳ型(http∶//hereditaryhearingloss.org/)。
目前对于极重度的感音神经性耳聋,人工耳蜗植入(Cochlear Implantation,CI)是唯一有效的治疗方法,其植入效果除了高级听觉中枢的发育,还有赖于听神经的功能状态。Chen等[3]发现MITF-M(-/-)突变的小型猪具有与人类Waardenburg综合征相似的色素沉着异常及先天性耳聋的特征,同时其螺旋神经节细胞(Spiral Ganglion Cells,SGC)在出生后30天开始发生退变近30%,出生后60天退变近70%[4]。尽管目前尚未在其他基因突变的动物模型中发现这种SGC退变的现象,且大部分临床研究中WS患者CI效果与其他患者相比均无明显区别[5-9],但人类WS患者是否与MITF-M(-/-)突变的耳聋荣昌猪一样也存在SGC退变目前尚无相关报道。因此,本研究将根据人工耳蜗植入术中ECAP测试的刺激量-振幅函数(Amplitude growth function,AGF)的斜率slope值来评估WS患者SGC的数量及功能状态,并根据术后调机数据C值、T值及DR值分析耳蜗植入效果与螺旋神经节细胞衰退特征的相关性。
1 方法
1.1 临床资料
2001年至2017年于解放军总医院耳鼻咽喉头颈外科进行人工耳蜗植入手术的患者,明确诊断为Waardenburg综合征且植入耳蜗品牌为Cochlear和MED-EL的患者共32人,筛选出术中eCAP测试组及术后调机组。术中eCAP数据(Cochlear为NRT测试,MED-EL为ART测试)组共17例,年龄0.7-15.4岁,平均年龄4.7岁。根据植入时年龄分为早期植入组(<4岁)10例,平均年龄1.67i 1.02岁,晚期植入组(≧4岁)7例,平均年龄9.03i 4.10岁。男性8例,女性9例,右侧耳蜗植入16例,左侧1例,Cochlear耳蜗10例,MED-EL耳蜗7例。其中2例为同一患者双侧耳蜗植入,1例为15.4岁时二次手术行对侧耳蜗植入。术后调机患者数据共7例,均为小于4岁的早期植入患者,平均年龄1.6岁。所有患者术前影像学检查耳蜗均正常。术中电极均顺利插入且阻抗正常,ECAP反应好。Cochlear电极根据电极型号按以下公式将电刺激量单位统一换算为μA[10]:CI24M、CI24R:IuA=10 (1910/1750)175^(CU/255);CI24RE(freedom)、CI422、CI500、CI512:IuA=17.5uA 100^(CU/255)。MED-EL 电极电刺激量1cu即为1μA。
根据病例组患者相同或相近的手术时年龄、耳蜗品牌,选择非综合征耳聋患者(Non-syndromic Patients,NS)作为对照组,本组患者ECAP数据患者共17例:男性14例,女性3例,左侧植入1例,右侧植入16例。年龄分组人数同病例组,平均年龄4.58岁:早期植入组1.66岁,晚期植入组8.76岁。术后调机患者共9例,平均年龄1.79岁。术前影像学检查耳蜗及听神经均未见明显异常。
两组患者一般情况具有可比性,所有患者均为重度及极重度感音神经性耳聋,且均为自幼发病。所有患者均为解放军总医院耳鼻咽喉头颈外科副主任医师以上主刀,人工听觉植入中心听力师行术中NRT测试及术后调机。
1.2 研究方法
回顾性分析患者术中eCAP数据,筛选出波形分化良好,且不同刺激量下至少有3个良好波形的电极,根据刺激量-振幅函数用SPSS 22.0软件行线性相关、回归分析,计算出Slope值,并排除P>0.05的电极数据,再根据回归方程算出振幅为0时的刺激量——预测阈值(Threshold,T)(图1)。
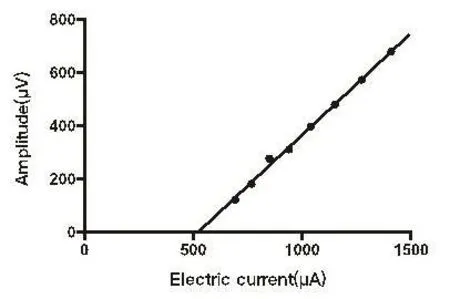
图1 电刺激量-振幅函数Fig.1 Amplitude growth function
术后调机需根据患者的反馈,调节人工耳蜗的电刺激量,使患者获得最佳的听觉补偿,其主要参数 有 T level(Threshold level)、C level(Comfortable level)和DR(Dynanmic range)。均为4岁以下的早期植入患者,植入电极均为Cochlear,共22个电极,将其平均分为低频、中低频、中频、中高频、高频5个频率,取5个电极的数据进行统计分析,通过其术后1-4年的调机数据分析两组患者术后电刺激量特征。
1.3 统计方法
统计软件采用SPSS 22.0,两组患者及不同年龄分组间的比较采用独立样本t检验,Slope值的计算采用线性相关与回归分析,术后调机不同时间及不同频率的分析采用多因素方差分析。P<0.05为差异有显著统计学差异。
2 结果
2.1 术中ECAP数据分析
WS患者Slope值为0.54i 0.28,其中早期植入组为0.62i 0.31,晚期植入组为0.47i 0.25。NS患者Slope值为0.79i 0.40,其中早期植入组为0.81i 0.38,晚期植入组为0.78i 0.42(表2)。WS患者与NS患者相比有统计学差异(P<0.01),在早期及晚期植入组中均有统计学差异,且在晚期植入组中差异更明显。WS患者中早期植入组与晚期植入组有统计学差异,而NS患者中无显著差异(图2)。且WS患者Slope值与植入年龄呈明显负相关(P<0.01,r=-0.309)。

表1 各组患者平均年龄Table 1 Average age of patients in each group
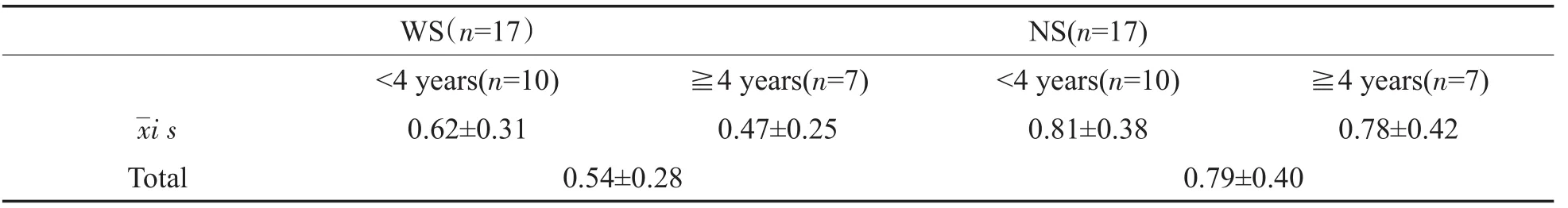
表2 术中eCAP测试Slope值Table 2 Slope value of eCAP tests during operation
WS患者的eCAP阈值T为421.97i 184.17,其中早期植入组为349.05 i 149.93,晚期植入组为477.66i 189.57。NS患者阈值T为374.23i 125.04,其中早期植入组393.51i 131.43,晚期植入组为359.55i 111.23。WS患者阈值高于NS患者,差异有统计学意义(P<0.05),在早期植入组中WS患者阈值低于NS组,但无统计学差异,但在晚期植入组中WS患者阈值明显高于NS患者,差异具有统计学意义(P<0.01)。WS患者中晚期植入组阈值也明显高于早期植入组(P<0.05)。
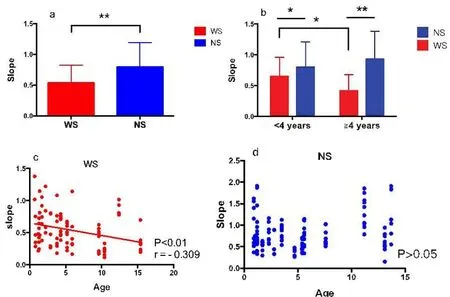
图2 术中eCAP测试Slope值Fig.2 Slope value of eCAP tests during operation Red,WS:Waardenburg Syndrome patients,Blue,NS:Non-syndromic patients.*P<0.05,**P<0.01
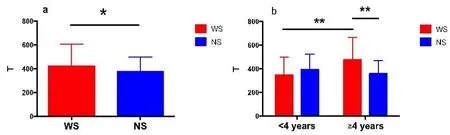
图3 术中eCAP测试Threshold值Fig.3 Threshold value of intraoperative eCAP tests Red,WS:Waardenburg Syndrome patients.Blue,NS:Non-syndromic patients.*P<0.05,**P<0.01
3.2 术后调机数据分析
术后4年的调机数据显示,两组患者阻抗并无显著差异,WS患者T值高于NS患者,DR值低于NS患者,差异具有统计学意义,但C值无显著差异(图4)。单因素方差分析结果显示,术后时间仅对DR值有影响,T值及C值均不随术后时间变化,且两组患者均为第3、4年明显高于第1、2年。
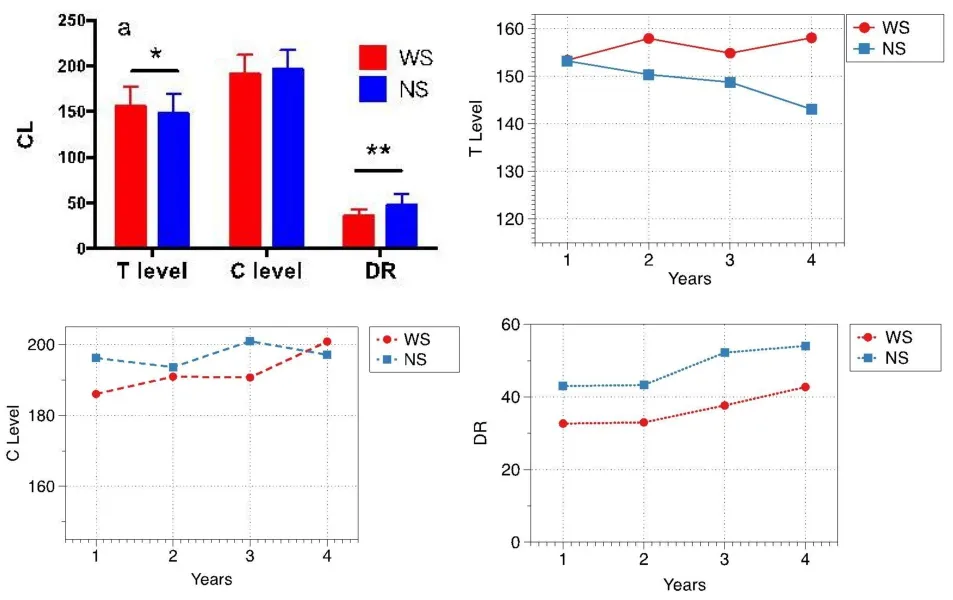
图4 术后调机数据Fig.4 Mapping data at 1-4 years postoperatively WS:Waardenburg Syndrome patients,NS:Non-syndromic patients.*P<0.05,**P<0.01
3 讨论
Waardenburg综合征是一种常染色体遗传性疾病 ,其 致 病 基 因 PAX3、MITF、EDN3、EDNRB、SOX10和SNAI2均与神经嵴细胞的迁徙及分化密切相关[11]。目前针对重度和极重度感音神经性耳聋的治疗,人工耳蜗植入(Cochlear Implant,CI)是唯一有效的手段,尽管残余螺旋神经节细胞数量对CI效果的影响目前仍有争论,一些研究发现残余SGC更多,CI效果并没有更好[12,13]。但听神经作为听觉传导通路的重要一环,其对于人工耳蜗植入效果的重要性不言而喻,而针对SGN对人工耳蜗植入效果影响的研究也是耳科学的热点之一,Seyyedi研究[14]发现在双侧人工耳蜗植入患者中双耳SGC数量与言语识别率呈明显正相关。
eCAP是通过人工耳蜗电极对听神经进行电刺激并记录到的听神经复合动作电位,已有大量研究证实eCAP的幅值增长函数slope值与SGC的数量及密度明显正相关[10,15],且其eCAP阈值越高,意味着听神经的功能也越差。Chen等[4]发现的MITF-M(-/-)耳聋荣昌猪出生后60天SGN数量显著减少,通常认为猪的性成熟年龄在6个月左右,人为12岁,则其60天对应于人的4岁,故以4岁为界将患者分为早期植入组及晚期植入组。由于Waardenburg综合征是一种较为罕见的疾病,患者数量较少,且其6个遗传基因均与神经嵴细胞的迁徙及分化相关,故本研究未对突变基因进行详细分组研究。本研究结果显示,WS患者术中eCAP测试Slope值明显低于NS患者,表明WS患者SGN数量少于NS患者,且在4岁以上以上患者中,这种差异更明显。WS患者中,4岁以上患者Slope值明显低于4岁以下患者,且Slope值与手术时年龄呈明显负相关,意味着WS患者SGC数量随着年龄的增长逐渐减少,与Chen W[4]在MITF-M(-/-)耳聋荣昌猪上发现的现象相一致。术中eCAP的阈值同样表明了SGC功能随年龄增长而衰退的现象。WS患者的阈值明显高于NS患者,且在大于4岁的患者中最为明显,4岁以上的WS患者阈值同样明显高于4岁以下患者。NS组患者在不同年龄分组中则没有显著差异。

表3 术中eCAP测试Threshold值Table 3 Threshold value of eCAP tests during operation
由于术后调机C、T、DR值仅能在人类患者中进行配合测试,T值即为患者能听到声音的最小电刺激量,C值为感觉最舒适的电刺激量,DR则为两者的差值。其与SGC数量的关系尚没有相关研究,但C、T值均与eCAP的阈值呈正相关[16],故调机C、T值一定程度上也可以反应SGC的数量或功能状态。本研究结果示,WS病例组T值高于NS对照组,DR值则明显低于NS患者,两组患者C无显著差异,意味着WS患者听到声音需要更大的刺激量。两组患者T、C值在术后不同时间段并无显著差异,仅DR值术后第3、4年显著高于第1、2年,且两组患者变化趋势一致。尽管总体上两组患者的刺激量存在差异,表明其SGC数量或功能有区别,但术后1-4年的调机数据T、C值无显著差异,DR变化趋势一致,预示植入人工耳蜗后SGC的数量或功能并无明显变化。但造成两组患者DR值在术后第3、4年显著升高的原因却不同,WS患者是由于C值的逐渐升高、T值相对稳定,而NS患者则是由于T值的逐渐下降、C值相对稳定。语前聋患儿开机后1年内T值逐渐下降,患者在适应电声刺激后,较低的电刺激量即可获得更好的听力[17],这与NS组患者术后1-4年T值的变化相一致。WS患者T值没有下降趋势,反而C值逐渐升高,意味着其获得舒适听力需更高的电刺激量,尽管其变化在统计学上无显著差异,可能和术后随访的时间不够长有关,增加随访时间也许能发现更显著的差异。
以上结果表明,WS患者的SGC数量随着年龄的增长逐渐下降,且人工耳蜗植入后4年其电刺激量逐渐增加,可能电刺激维持或减缓了SGC的进一步衰退,而这需要更多随访数据进一步证实。
影响耳蜗植入效果的因素有植入年龄、耳聋年龄、术前辅助听阈、残余听力、耳蜗使用时间、教育环境、交流方式以及智商等[18]。为了使WS患者有更好的植入效果,很多学者也在研究干细胞分化为毛细胞和螺旋神经节细胞以恢复听力,治疗感音神经性耳聋[19,20]。通过导入正常的基因或补充正常的基因表达相应的蛋白或因子治疗遗传性耳聋,可能使内耳的功能得以恢复[21,22]。电场似乎对干细胞的迁移有一定的影响[23],且通过电场可同时进行基因的转导[24],那在进行人工耳蜗植入的同时导入干细胞和治疗基因,利用人工耳蜗的电极产生的电场引导干细胞迁移和基因转染,或许能产生更好的治疗效果。这需要更多的研究来明确电子耳蜗的电场影响干细胞迁移的原理及趋向性,以及电场介导的转染安全性及有效性。但目前无论是干细胞还是基因治疗在应用到人体身上都面临着诸多亟待解决的问题。
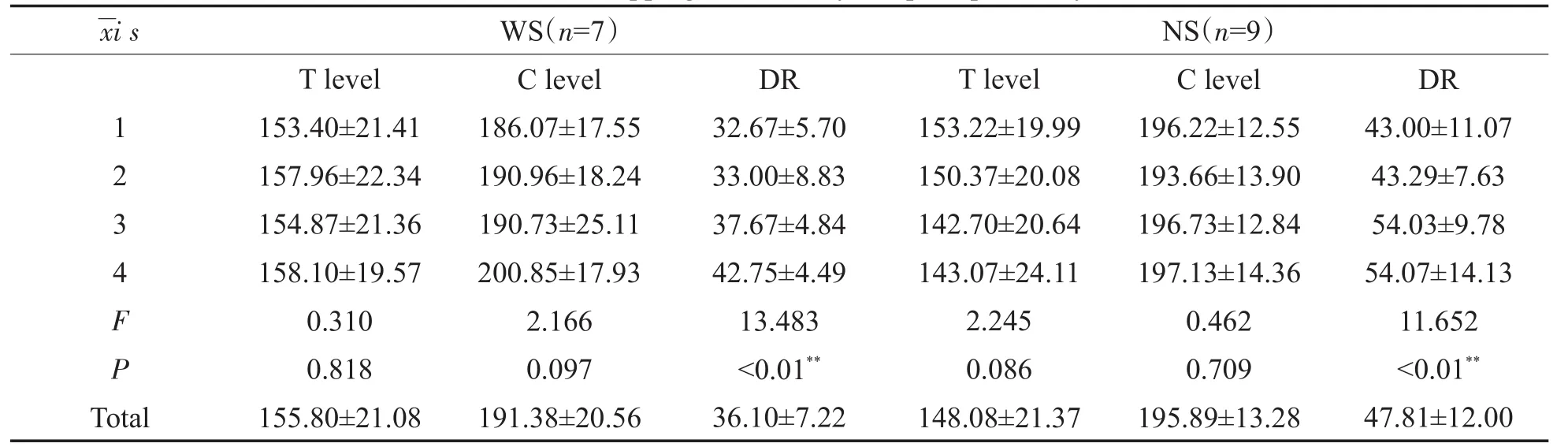
表4 术后1-4年调机数据Table 4 Mapping data at 1-4 years postoperatively
