糙皮侧耳蓝光受体基因Po.WC-1的克隆及分析
2019-01-08孙宪凯张梦珂申进文戚元成
孙宪凯 张梦珂 文 晴 申进文 戚元成
(河南农业大学生命科学学院,河南郑州450002)
光作为一种重要的环境因子,对生物的发育至关重要。除了作用于植物光合作用,还影响真菌的生长发育、昼夜节律、次级代谢的产生等过程。为了适应环境的变化,真菌形成了完整的光调节机制,可以通过光受体来感受光质、光强和光照周期,以便更好地生存。众所周知白光是由许多单色光组成的复合光,研究证实在真菌中蓝光是影响其生长发育的重要因素[1-3]。蓝光信号主要是由white collar complex(WCC)进行响应的,且 WCC 是由white collar 1(WC-1)和 white collar 2(WC-2)蛋白组成的[4-5]。WC-1包含有三个PAS(Per-Arnt-Sim)结构域,其中WC-1靠近N端的PAS结构域又叫作LOV(Light,Oxygen,Voltage)结构域,它的蛋白上有一个黄色发色团FAD(flavin adenine dinucleotide),正因为如此,WCC才能够捕捉光信号[6]。光诱导WCC的表达是瞬时的,在持续光照下,WC-1蛋白被磷酸化,导致WCC的失活和WC-1的降解。光是通过新合成的WC-1调节真菌生长发育过程[7]。粗糙脉孢菌的基因组也包含VIVID基因[8],VIVID基因是WC-1和WC-2的同源基因,并且VIVID蛋白已被证实参与到光激活基因过程中。目前已经在香菇[10]、裂褶菌[11]、灰盖鬼伞[12]、粗糙脉孢菌[13]、新型隐球菌[14]、里氏木霉[15]、蛹虫草[22]等多种真菌中均发现了蓝光受体WC-1的存在。
糙皮侧耳(Pleurotus ostreatus)是世界上栽培范围最广的食用菌之一,而对于其光受体的研究比较少。1987年,Richartz&Maclellan[9]对平菇使用的菌丝聚集光谱的方法,发现蓝光对单核和双核的菌丝生长速率都具有抑制作用,证实在370 nm和430~460 nm处存在两个极值,具有蓝光受体的特性。说明糙皮侧耳可能在蓝色光谱区域存在蓝光受体,并且发现高强度的光抑制菌丝的生长,适量的光可以促进糙皮侧耳菌丝从营养生长到原基形成、子实体发育。笔者通过同源比对的方法获得糙皮侧耳蓝光受体基因WC-1,命名为Po.WC-1,克隆得到了全长cDNA序列,并对此基因进行了初步的功能分析预测及转录水平分析,为对该基因功能的深入分析及其下游基因的研究提供参考,为糙皮侧耳光形态建成的研究提供分子水平的依据。
1 材料与方法
1.1 供试菌株与试剂
糙皮侧耳新831菌株为河南农业大学生命科学学院应用真菌研究室保藏;pEASY-blunt E1 expression kit、pEASY-blunt cloning kit、TransStart FastPfu DNA polymerase购自北京全式金生物技术有限公司;E.coliDH5α、E.coliBL21(DE3)购自北京博迈德基因技术有限公司;RNA trizol plus购自大连宝生物公司;OMEGA DNA凝胶回收试剂盒、Thermo Fisher反转录试剂盒购自河南比根生物技术有限公司;AceQ qPCR SYBR Green Master Mix购自南京挪威赞生物技术有限公司。
1.2 糙皮侧耳蓝光受体基因Po.WC-1基因的克隆
糙皮侧耳新831接种、菌丝培养及出菇管理参照戚元成等(2016a)的方法。使用TRIzol法提取菌丝期、原基期及子实体总RNA。采用CTAB法提取糙皮侧耳基因组DNA。真菌蓝光受体的PAS结构域具有高度保守性,利用裂褶菌Sc.WC-1(XM_003028928.1)的 PAS 结构域在 JGI(https:∕∕genome.jgi.doe.gov∕)糙皮侧耳PC9 V1.0、PC15 V2.0数据库菌株的转录组进行比对,得到了相似度比较高的糙皮侧耳序列PC15_2|scaffold 02 1518347-1518375。以PC15_2|scaffold 02 1518347-1518375为模板,利用Primer 5.0设计引物,试验所有引物由北京六合华大基因研究中心合成(表1)。参照RevertAid First Strand cDNA Synthesis Kit说明书合成cDNA的第一条链。分别以糙皮侧耳cDNA和gDNA为模板,反应体系为:Template 1 μL、Forward Primer 1 μL、Reverse Primer 1 μL、5×TransStart FastPfu buffer 10 μL、2.5 mmol∕L dNTPs 4 μL、TransStart FastPfu DNA polymerase 1 μL、ddH2O补足至50 μL。PCR反应条件为:98℃ 预变性 1 min,98℃ 变性 20 s,53℃ 退火20 s,72℃ 延伸 60 s,30 个循环,72℃ 终延伸 3 min(CDS)∕5 min(gDNA)。经1%琼脂糖凝胶电泳检测后,回收纯化扩增产物,将回收后的PCR产物与pEASY-blunt cloning vector进行连接,热激发转化进入E.coliDH5α感受态细胞中,经过氨苄青霉素(100 μg∕mL)抗性筛选、PCR验证后提取质粒,送往北京六合华大基因研究中心测序。

表1 试验所需引物
1.3 糙皮侧耳蓝光受体基因Po.WC-1基因的生物信息学分析
在NCBI网站使用BLAST工具(https:∕∕blast.ncbi.nlm.nih.gov∕Blast.cgi)对糙皮侧耳Po.WC-1的测序结果与JGI上公布P.ostreatusPC15菌株的基因序列进行比对分析,并通过ORF finder(https:∕∕www.ncbi.nlm.nih.gov∕orffinder∕)对其 ORF进行分析。从 NCBI数据库中下载其他真菌中已经报道过的蓝光受体的氨基酸序列,在 EMBL-EBI网站上(https:∕∕www.ebi.ac.uk∕Tools∕msa∕clustalo∕)进行多序列比对。在Gene Structure Display 网站上(http:∕∕gsds.cbi.pku.edu.cn∕index.php)对核苷酸结构进行分析。在SMART 网 站 上(http:∕∕smart.embl-heidelberg.de ∕smart∕set_mode.cgi?NORMAL=1)预测氨基酸结构。利用在线网站 ExPASy(http:∕∕web.expasy.org∕protparam∕)对目的蛋白的等电点以及分子量进行预测。利用MEGA7软件的邻位相连法构建系统发育树。
1.4 糙皮侧耳Po.WC-1原核表达
将Po.WC-1连接到pEASY-blunt E1 expression载体上,转入E.coliDH5α中,经过氨青霉素(100 μg∕mL)抗性筛选、PCR验证后提取质粒,测序验证成功后将重组质粒和E1空载质粒转入E.coliBL21,将含有重组质粒的大肠杆菌命名为E1-WC1。分别将含有重组质粒和空载质粒的E.coliBL21菌株接种至100 mL LB液体培养基,37℃ 220 r∕min振荡培养,当OD600达到0.5后,向LB液体培养基中加入IPTG至终浓度为 0.1 mmol∕L 和 0.3 mmol∕L,37℃继续培养6 h后,收集菌体进行超声破碎,分离上清和沉淀,进行SDS-PAGE分析。
1.5 糙皮侧耳Po.WC-1菌丝期不同光照时间表达量分析
首先设置了100 lx、200 lx、300 lx、400 lx、500 lx、600 lx不同的六个蓝光单色光光照强度,发现在300 lx下蓝光已经出现了明显的抑制现象(图1),所以之后选取300 lx作为光照条件。将糙皮侧耳新831打孔接种于直径9 cm的SEM(1.5%麦芽浸膏,2%琼脂)上,25℃完全黑暗条件下进行培养。然后将平板置于300 lx蓝光或白光下,进行光照刺激0 min、15 min、30 min、45 min、60 min,每板三个重复。Trizol法提取不同时间总RNA,取1 μg总RNA样品,参照RevertAid First Strand cDNA Synthesis Kit说明合成cDNA的第一条链,选取糙皮侧耳actin作为内参基因,按照AceQ qPCR SYBR Green Master Mix说明,实时荧光定量分析糙皮侧耳Po.WC-1在不同光照时间刺激下与完全黑暗条件下的差异表达。qRT-PCR反应体系为:10 μL SYBR Green Master Mix,上下游引物各 0.4 μL(10 μmol∕L),1 μL cDNA,7.2 μL ddH2O。循环参数设定为:95℃预变性3 min;95℃ 30 s,60℃ 35 s,共40个循环,3次重复。反应在applied 7500实时荧光定量PCR仪上进行,利用2-ΔΔCT的方法计算目的基因相对表达量[11]。
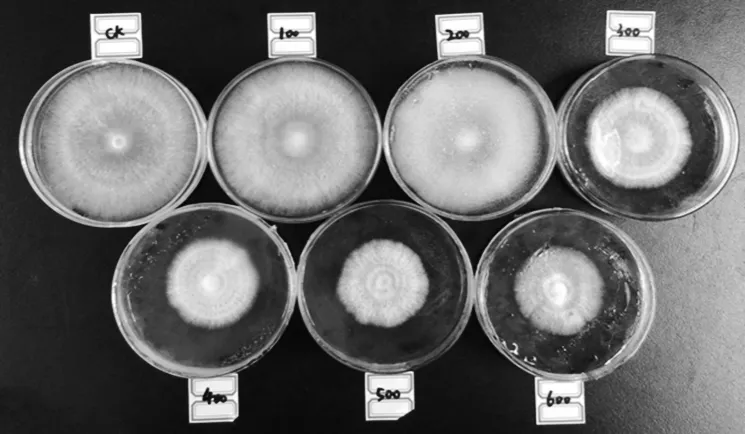
图1 不同蓝光光照强度下糙皮侧耳新831的生长情况
2 结果与分析
2.1 糙皮侧耳Po.WC-1基因的克隆及生物信息学分析
琼脂糖凝胶电泳检测以gDNA和cDNA为模板扩增的Po.WC-1序列,分别得到一条大小约为2300 bp和2000 bp(图2)的特异条带,测序结果显示片段长度分别为2356 bp和1956 bp(KY348758),与糙皮侧PleosPC15_2|1035381的gDNA序列及CDS序列一致性都是100%,对核苷酸结构进行分析表明其基因组中不含有内含子,并且具有完整的ORF。通过蛋白一级结构预测表明Po.WC-1基因编码651个氨基酸,蛋白分子量大小为71.74 kDa,等电点为6.38。通过SMAART网站对该蛋白进行结构分析表明它具有三个保守的PAS结构域和一个ZnF结构域(图4),在PAS A结构域包含9个FMN相互作用的氨基酸残基位点[20]和4个行使光功能必需的氨基酸残基[21](图3),且在C端有一个谷氨酰胺富集区域。将糙皮侧耳Po.WC-1(KY348758)与香菇Le.PHRA(AB279630.1)、裂 褶 菌 Sc.WC-1(XM_003028928.1)、灰盖鬼伞 Cc.Dst1(AB195817.1)、粗糙脉孢菌Nc.WC-1(X94300.2)、新型隐球菌Cn.WC-1(AY660969.1)、里氏木霉 Blr1(AY628431.1)等种六种真菌的蓝光受体WC-1进行比较(图3)。如图4所示,在这几种真菌中它们的蓝光受体WC-1蛋白都包含2~3个PAS域,并且PAS结构域也具有较高的同源性,其中糙皮侧耳与香菇、裂褶菌、灰盖鬼伞对应的PAS结构域相似度甚至达到了61%以上,系统发育树(图5)及相似性比对分析表明糙皮侧耳Po.WC-1(KY348758)与香菇、裂褶菌、灰盖鬼伞具有较近的亲缘关系,这也跟它们都是同属于担子菌有关。
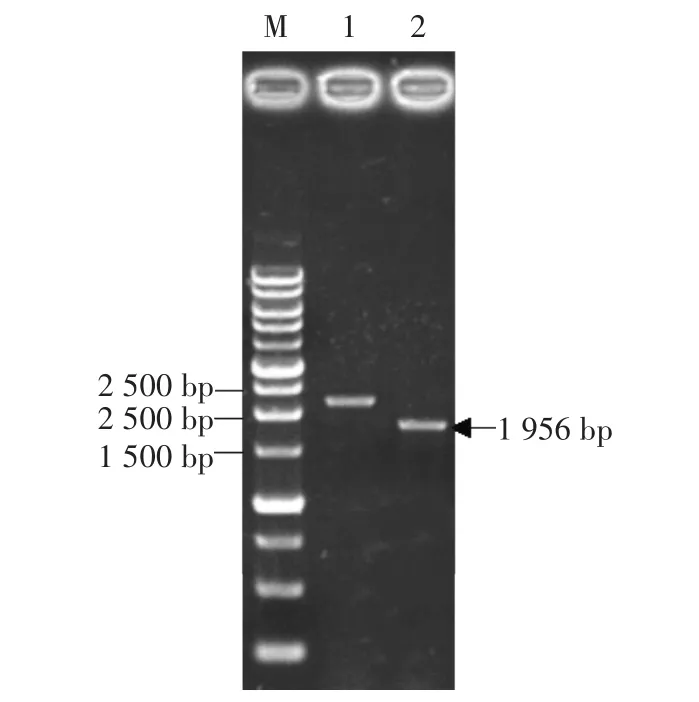
图2 Po.WC-1基因gDNA及全长cDNA的PCR扩增图谱

图3 糙皮侧耳Po.WC-1和其他真菌的蓝光受体基因在PAS A、PAS B、PAS C结构域比对结果
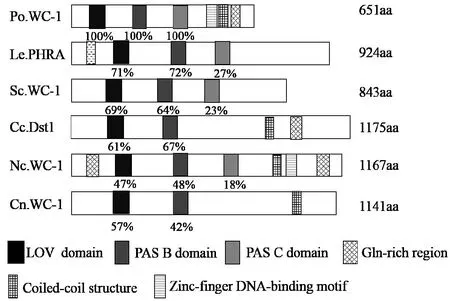
图4 Po.WC-1与有代表性的真菌光受体家族中的Le.PHRA、Sc.WC-1、Cc.Dst1、Nc.WC-1、Cn.WC-1比对的概要图
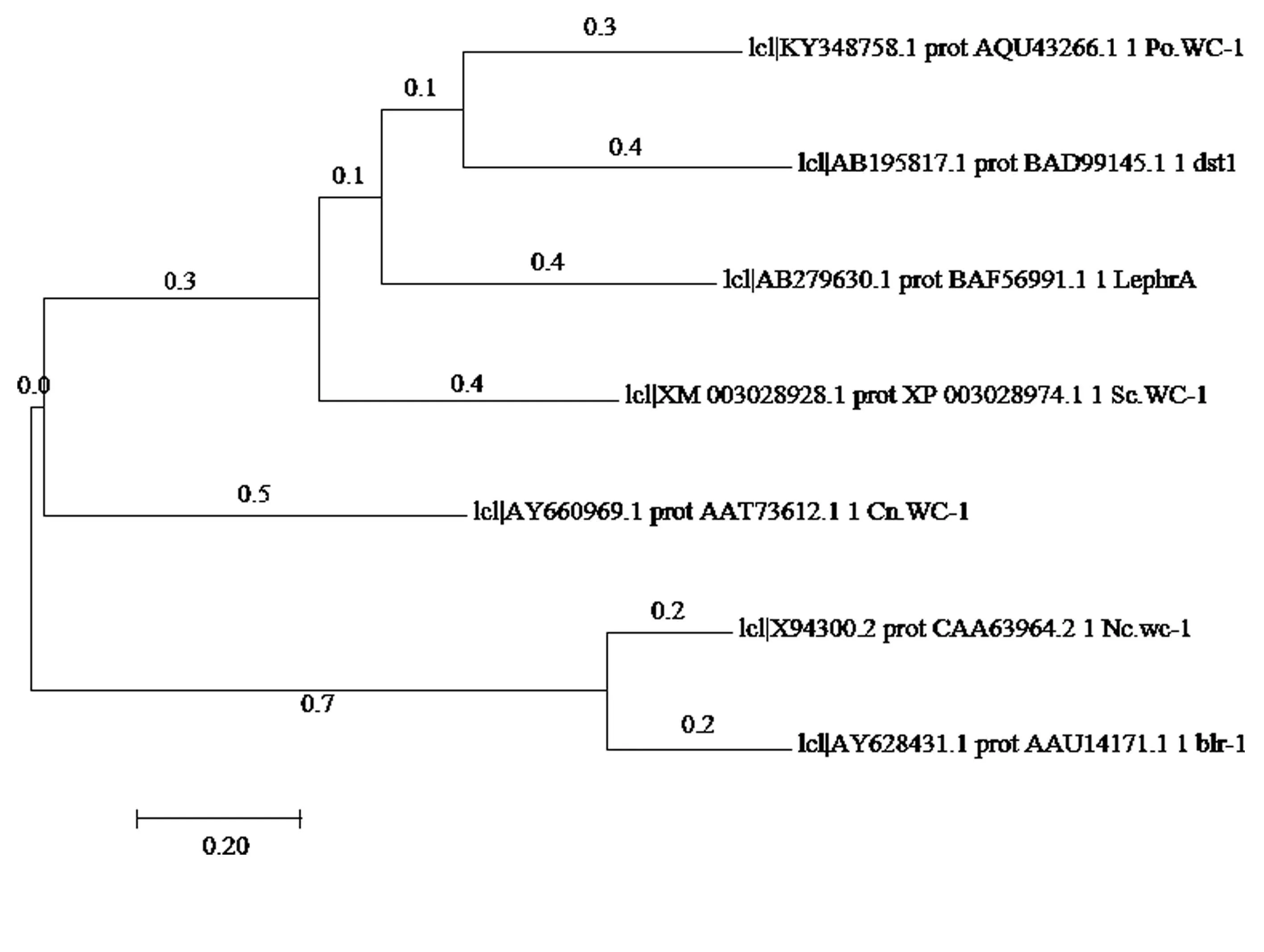
图5 根据Po.WC-1编码的氨基酸序列比较构建的系统发育树
2.2 糙皮侧耳Po.WC-1基因的原核表达分析
将纯化后的Po.WC-1片段连接至pEASY-blunt E1原核表达载体上,测序验证成功后将重组质粒转化入BL21菌株中,在37℃分别加入0 mmol∕L、0.1 mmol∕L、0.3 mmol∕L IPTG的条件下对重组质粒进行诱导,收集菌体并进行破碎,分别将上清和沉淀进行SDSPAGE分析。结果表明Po.WC-1编码的蛋白被成功诱导,主要是以包涵体的形式存在(图5),蛋白分子量是72 kDa,符合预期分子量大小。由此证实笔者成功获得了完整的Po.WC-1基因的ORF序列。
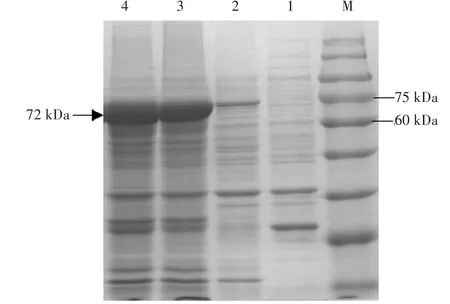
图6 大肠杆菌异源表达糙皮侧耳蓝光受体Po.WC-1 SDS-PAGE图谱(破碎后沉淀)
2.3 糙皮侧耳Po.WC-1不同光照时间的差异表达
实时荧光定量PCR结果分析表明,糙皮侧耳Po.WC-1(图7)在300 lx蓝光或300 lx白光下光照0 min、15 min、30 min、45 min、60 min表达量均明显上调,且在15 min后Po.WC-1基因在蓝光光照下表达量是白光光照下约2倍。但是,无论是在白光还是在蓝光下,经过15 min短时间的照射后Po.WC-1的表达量都到了峰值,随Po.WC-1表达量逐渐降低到达相对稳定的状态,与蛹虫草中报道的一致[22]。由此说明Po.WC-1基因可以响应光照刺激调节糙皮侧耳的生长发育。
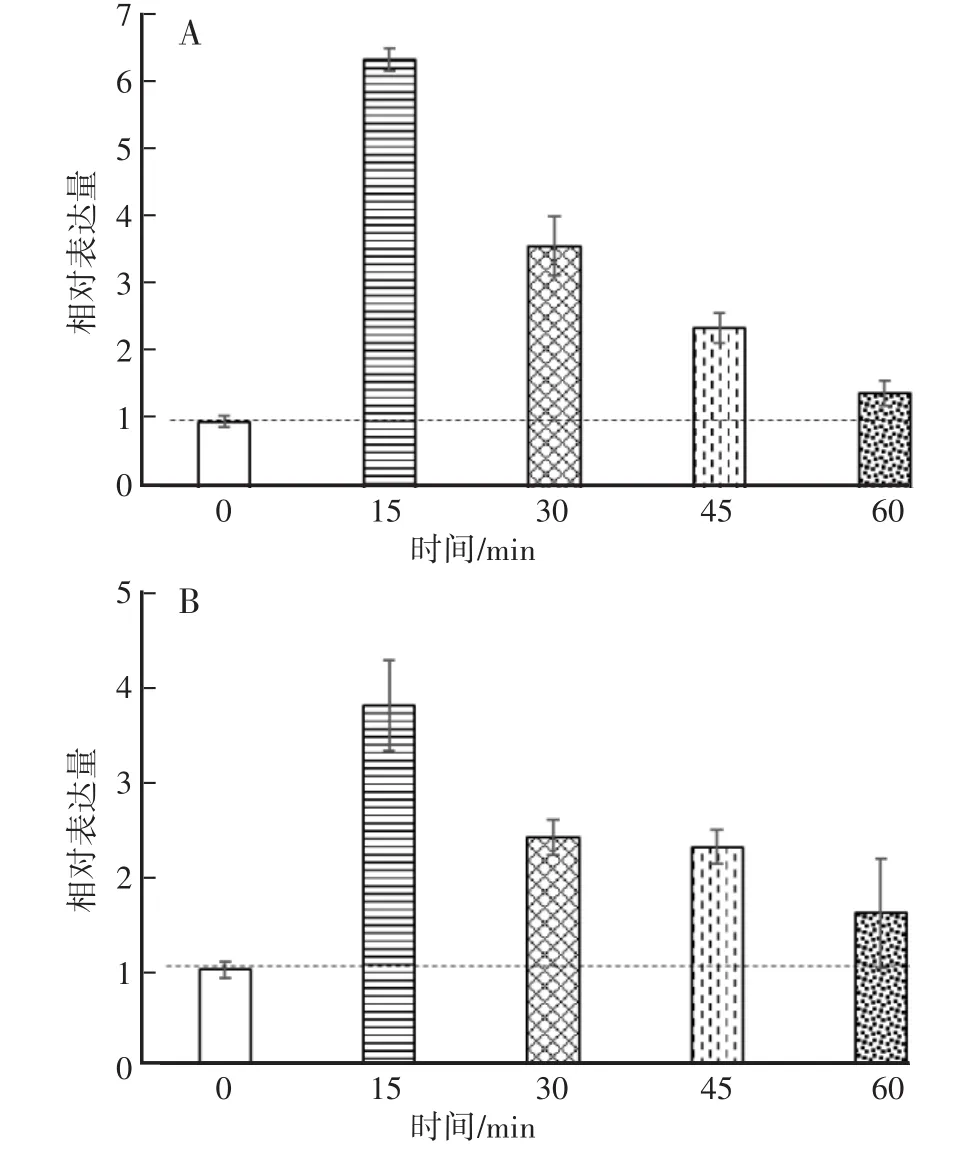
图7 不同光照时间糙皮侧耳Po.WC-1的差异表达
3 小结与讨论
光作为一种重要的环境因子,影响植物和真菌的生长发育,而光受体作为转录因子,在光信号通路中发挥了重要的作用,其中,蓝光受体在大多数真菌中起到主要的调节作用。真菌的光生物学已经在模式菌株粗糙脉孢菌中进行了深入的研究[13],通过多个实验室对蓝光受体WC-1和VIVID的研究,已经证实它们参与调节粗糙脉孢菌的昼夜节律和光适应机制。近年来,有关真菌蓝光受体的研究逐渐增多,尤其是在担子菌香菇[10]和裂褶菌[11]中已经进行了较为深入的研究,在香菇成熟的子实体中菌盖、菌褶、菌柄中蓝光受体基因PHRA的表达量也是不同的,在裂褶菌中敲除蓝光受体基因WC-1即使在有光的条件下也不能形成原基和子实体,并且WC-1的缺失将影响下游基因的转录。
目前,在真菌中关于糙皮侧耳蓝光受体的研究比较少。本研究在糙皮侧耳中首次得到了蓝光受体Po.WC-1基因,SMART网站分析表明Po.WC-1包含真菌蓝光受体保守的PAS A、PAS B、PAS C结构域和ZnF结构域,是香菇、裂褶菌等的同源序列。原核表达的结果表明成功得到了糙皮侧耳蓝光受体Po.WC-1完整的开放阅读框。这些结果表明成功克隆到了糙皮侧耳蓝光受体基因。
采用实时荧光定量PCR分析Po.WC-1在糙皮侧耳菌丝期在一定光照条件下不同光照时间的差异表达情况。结果表明,在一定的光刺激下,糙皮侧耳蓝光受体Po.WC-1在15 min后的表达量显著上调,并且在蓝光条件下表达量约是在白光条件下2倍,随着光照时间的增加表达量逐渐趋于稳定,说明光照刺激真菌的生长发育是一种瞬时反应,这与粗糙脉孢菌等真菌报道的趋势是相似的[3]。目前的报道中,通过对比粗糙脉孢菌和葡萄孢菌下游靶标基因并没有同源性,说明不同真菌具有不同的WCC下游靶标基因,不同真菌中光调节的途径是不同的[17-19],关于糙皮侧耳内Po.WC-1功能以及下游靶标基因还需要进行深入的研究。
综上所述,初步得到了糙皮侧耳的蓝光受体Po.WC-1基因在光照下起到了一定的调节作用,为糙皮侧耳光生物学研究奠定了基础。
