裂褶菌液体培养条件优化及其发酵液功效检测
2019-01-08甄英鑫史豆豆王昌涛
邴 雪 甄英鑫 史豆豆 安 全 苏 宁 王昌涛 李 萌
(1北京工商大学理学院∕北京市植物资源研究开发重点实验室,北京100048;2云南白药集团有限公司,云南昆明650118;3中国检验检疫科学研究院化妆品技术中心,北京朝阳100176;4北京食品营养与人类健康高精尖创新中心,北京海淀100048)
裂褶菌(Schizophyllum commun)别名树花、鸡毛菌、白花、白参等,属于真菌门,担子菌纲,伞菌目,裂褶菌科,裂褶菌属(Schizophyllum)[1]。在段木栽培木耳、香菇及银耳或者毛木耳有时产生的“杂菌”——裂褶菌,其繁殖速度快,繁殖量大,严重时,还可使木质部产生白色腐朽。世界各地均有裂褶菌分布,在我国主要分布于河北、黑龙江、辽宁、内蒙古、安徽、江苏、浙江、湖南、甘肃、福建、海南、四川、贵州等省区。据云南省农科院测试中心对人工栽培的裂褶菌分析,裂褶菌中人体必需的8种氨基酸总含量达17.04%,并富含锌、铁、钾、钙、磷、硒、锗,有较高的药用价值。据《新华本草纲要》等籍记载,此菌“性平,味甘,气味(根)苦、微寒、无毒”。对小儿盗汗、妇科疾病、神经衰弱、头昏耳鸣等症疗效明显。裂褶菌是食药兼用的珍稀菌,有清肝明目,滋补强身的功效。国外对裂褶菌的遗传、生理研究开展较早,我国则侧重研究菌丝体的发酵条件、人工驯化栽培和药用价值[2]。
裂褶菌素是由裂褶菌分泌的胞外多糖,是以主链为β-(1,3)糖苷键连接,支链β-(1,6)连接的β葡聚糖[3],具有β-1,3-D葡聚糖的独特结构活性和良好的水溶性,在调节免疫功能、抗肿瘤、抗辐射等方面具有显著的效果。裂褶菌素具有的独特结构特性,使其生物活性高于其他真菌多糖。夏冬等发现裂褶菌多糖对延缓衰老有帮助原因是它可以促进机体细胞免疫功能和机体的体液免疫应答,并在恢复老年动物细胞免疫及体液免疫的功能方面有良好表现[4]。张虽栓等人研究表明,以酵母粉0.8%和硝酸铵0.2%为混合氮源,加入3-吲哚乙酸0.04%、磷酸二氢钾0.3%、葡萄糖12%的培养基培养菌丝,接种量为13%的发酵条件下多糖提取率较高,其质量分数达1.768%[5]。张琪等人研究裂褶菌多糖的保湿成分,结果表明其能作为护肤保湿产品添加物,其保湿能力较常见的保湿剂成分燕麦β-葡聚糖强,可以开发作为日用化妆品中的保湿剂成分[6]。故裂褶菌素在食品生产、医药卫生、生物、化妆品等方面应用广泛。试验对裂褶菌的发酵培养基进行优化,旨在提高裂褶菌素的产量,并在优化培养基条件下得到的发酵液进行性质检测,分析其抗氧化和美白功效,为研究开发相关化妆品提供参考。
1 材料与方法
1.1 供试裂褶菌菌株
裂褶菌菌株来源于中国科学院微生物研究所,编号5.120。
1.2 试剂与仪器
葡萄糖,北京拜尔迪生物技术有限公司;玉米淀粉、糊精、蔗糖、刚果红、蛋白胨、酵母膏、牛肉膏,上海麦克林生化科技有限公司;KH2PO4、MgSO4、氢氧化钠、酒石酸钾钠、苯酚、十二水磷酸氢二钠、二水磷酸二氢钠,北京化学试剂公司;黄豆饼粉,市售;花生饼粉,市售;浓硫酸,北京化工厂;牛血清蛋白,天津凯茵科技有限公司;L-酪氨酸酶,上海麦克林生化科技有限公司。
1.3 裂褶菌的培养条件优化
1.3.1 单因素法优化培养基
分别以碳源、氮源和pH为单因素,以裂褶菌菌体干重和裂褶菌素含量为考察指标,对裂褶菌培养基进行优化。碳源有葡萄糖、淀粉、糊精、蔗糖,氮源有黄豆饼粉、花生饼粉、酵母粉、牛肉膏,pH为4、5、6。每组试验进行三个平行。先在1000 mL锥形瓶中配好所需培养基,完全溶解后,分装于250 mL锥形瓶中,装液量为100 mL,在28℃培养96 h。检测其菌体干重,发酵液14 800×g离心10 min后,弃上清液,取沉淀置于已知质量的培养皿中,在40℃的烘箱中烘干至恒重,得菌丝体干重,并对裂褶菌发酵液中的裂褶菌素进行检测,筛选出最适宜的碳源、氮源和pH。
1.3.2 正交试验优化培养基
采用正交试验L9(34)分析法探究裂褶菌最优培养基,因素及水平见表1。按表1在1000 mL培养基中加入相应量的玉米淀粉和酵母浸粉,完全溶解后,分装于250 mL锥形瓶中,装液量为100 mL,在28℃培养96 h。

表1 正交试验因素水平
1.4 发酵液活性成分含量测定
1.4.1 多糖含量的测定
还原糖含量的测定:利用DNS法[7]。取发酵液1.0 mL于试管中,加DNS试剂2.0 mL,沸水煮沸2 min,冷却后用水补足到15 mL,在540 nm处测定吸光度。从标准曲线中查出葡萄糖浓度,求出样品中糖含量。
多糖含量的测定:采用苯酚-硫酸法[8]。取发酵液2.0 mL放入试管中,以去离子水做空白对照,加入5%的苯酚溶液1.0 mL混匀,再加入5.0 mL浓硫酸,5 min后,封管沸水浴加热1 h。取出后冷却至室温,在490 nm处测吸光度。
1.4.2 蛋白质含量的测定
采用福林酚法[9]。取1.0 mL发酵液,加入5.0 mL配好的Na2CO3、NaOH、酒石酸钾钠与硫酸铜溶液,迅速混合放入25℃水浴锅,水浴保温10 min。加入0.5 mL配好的福林酚试剂,立即混合,25℃水浴反应30 min,在700 nm处测吸光度。
1.4.3 裂褶菌素含量的测定
采用刚果红法[10]。取2.0 mL发酵液于试管中,加入4.0 mL配好的刚果红溶液,25℃水浴反应10 min,在550 nm处测吸光度。
1.5 发酵液功效测定
1.5.1 酪氨酸酶活性抑制率
对酪氨酸酶活性抑制试验[11]。按照表2中的数据添加L-酪氨酸、发酵液、PBS溶液;C2管在37℃水浴锅中水浴加热10 min,波长475 nm下调零,C1管37℃水浴10 min后,加1 mL100 U∕mL酪氨酸酶,继续水浴10 min,测定C1吸光度值;同样方法,以T2调零测定T1吸光度值;计算样品对酪氨酸酶的活性抑制率。
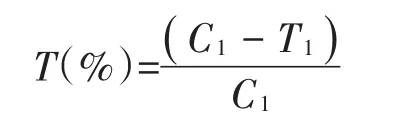

表2 溶液配制列表 mL
1.5.2 抗氧化试验
对DPPH自由基清除作用试验[12]。以制得的发酵液为待测液,取等体积的待测液与2×10-4mol∕L的DPPH溶液混匀(A1管);取等体积的水与2×10-4mol∕L的DPPH溶液混匀(A2管);取等体积的无水乙醇与待测液混匀(A3管);反应30 min后,在517 nm下测A1、A2、A3管吸光度值。

2 结果与分析
2.1 裂褶菌培养条件优化结果
2.1.1 单因素试验结果
当氮源固定为酵母浸粉,pH设定为4,碳源为葡萄糖、玉米淀粉、糊精、蔗糖,试验结果见图1。当碳源固定为葡萄糖,pH设定为4,氮源为酵母浸粉、牛肉膏、花生饼粉、黄豆饼粉,试验结果见图2。氮源固定为酵母浸粉,碳源固定为葡萄糖,pH设为4、5、6,试验结果见图3。
试验结果表明,当培养基碳源为玉米淀粉,氮源为酵母浸粉,pH为4时,裂褶菌菌丝生长状态最好,菌体干重最大,且裂褶菌的发酵液中裂褶菌素的产量最高。
2.1.2 正交试验法优化结果
试验以裂褶菌菌丝干重和发酵液裂褶菌素含量为考察指标,试验结果见表3、表4。
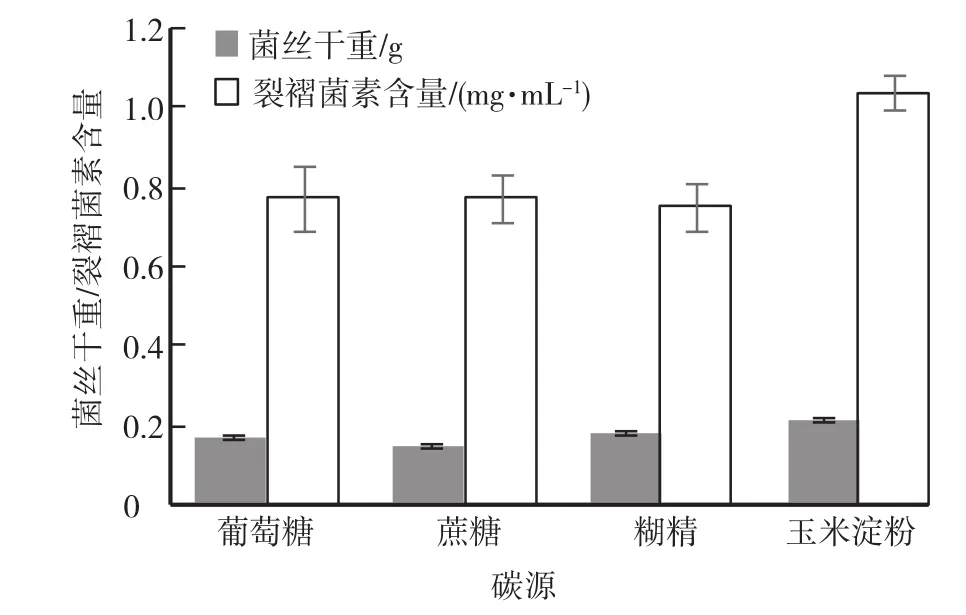
图1 培养基不同碳源试验结果
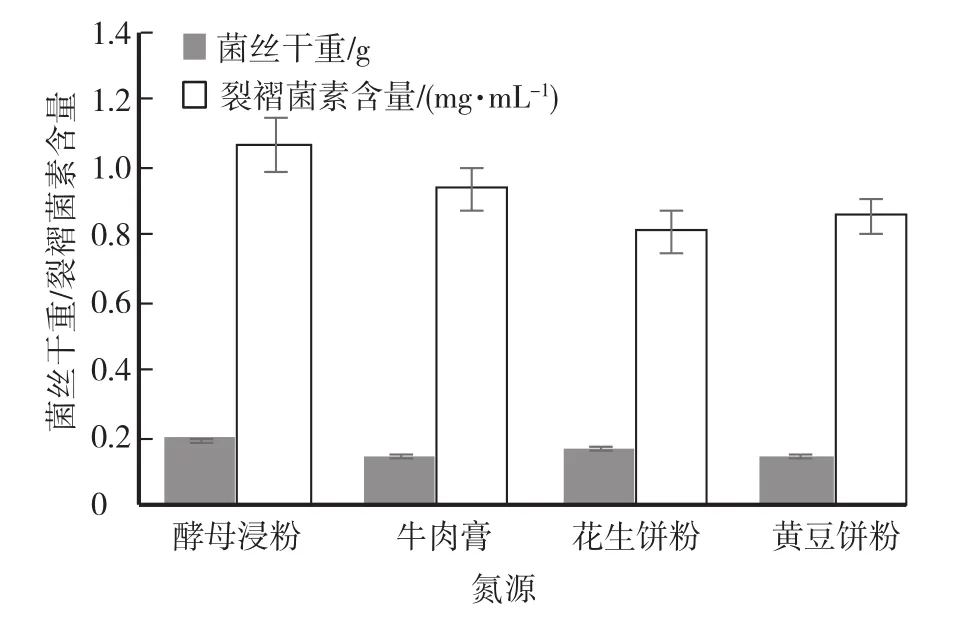
图2 培养基不同氮源试验结果
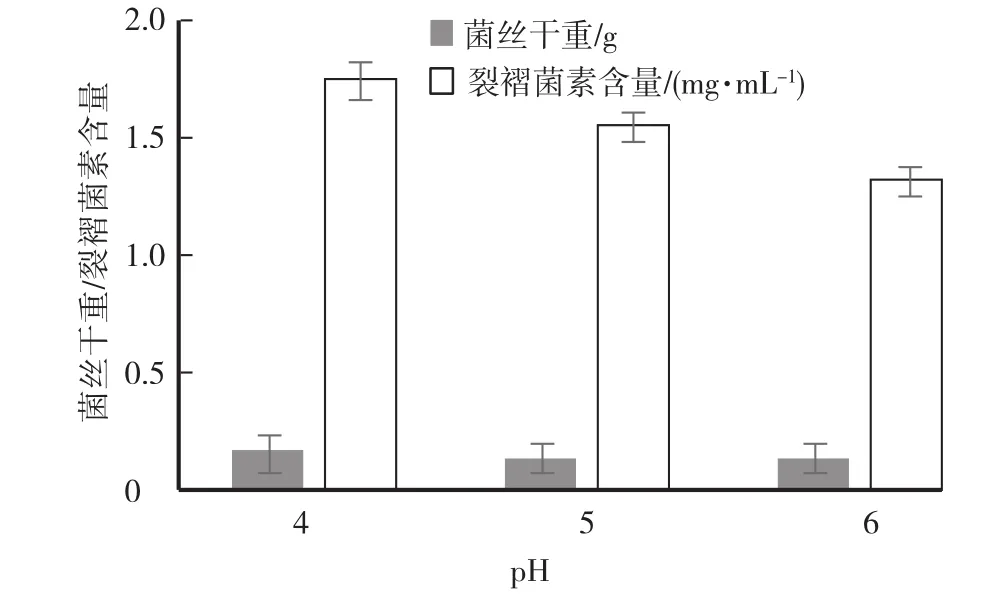
图3 培养基不同pH试验结果
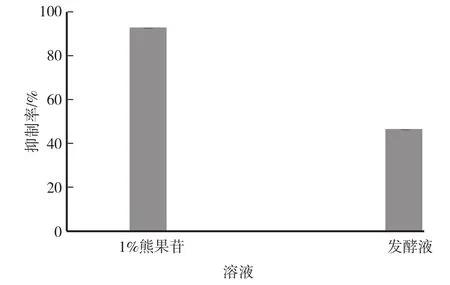
图4 酪氨酸酶抑制率
由表3、表4可知,影响裂褶菌菌丝干重和裂褶菌素含量的因素主次序均为碳源>氮源>pH,试验最优培养条件为玉米淀粉30 g,酵母浸粉4 g,pH 4,裂褶菌菌丝干重为0.21 g,裂褶菌素的含量为2.13 mg∕mL。
2.2 发酵液活性成分
测得还原糖含量的标准曲线方程为y=0.924x+0.0523,R2=0.9985,多糖含量的标准曲线方程为y=0.923x+0.025,R2=0.997,多糖含量为 2.14 mg∕mL。测得蛋白质含量的标准曲线为y=0.0013x+0.0031,R2=0.9986,蛋白质含量为 3315.00 μg∕mL。测得裂褶菌素含量的标准曲线为y=0.038x+0.0136,R2=0.997,裂褶菌素含量为2.13 mg∕mL。
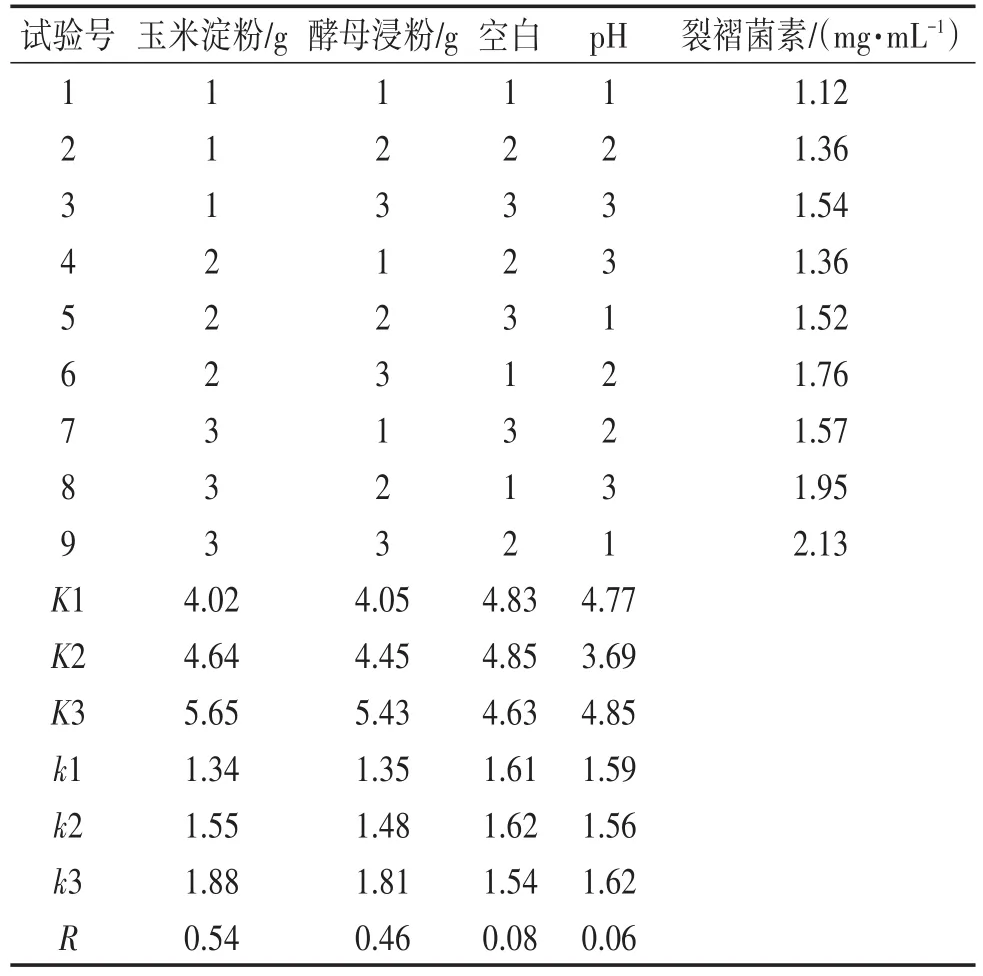
表4 正交试验结果
2.3 酪氨酸酶活性抑制试验结果
选用1%熊果苷溶液作为阳性对照,试验结果如图4所示,1%熊果苷的酪氨酸酶抑制率为95.08%,未稀释发酵液的酪氨酸酶抑制率为47.83%。
2.4 抗氧化试验结果
选用浓度为1%的VC水溶液作为阳性对照,DPPH自由基清除率为90.84%。发酵液的DPPH自由基清除率如图5所示。由图5可知,未稀释发酵液的DPPH自由基清除率为99.20%。
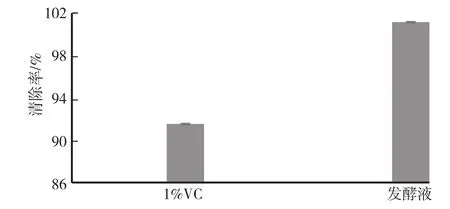
图5 发酵液DPPH自由基清除率
3 小结
单因素试验结果表明当选择碳源为玉米淀粉,氮源为酵母浸粉时,裂褶菌菌丝的生长状态最为良好,菌丝体干重最大,且裂褶菌的发酵液中裂褶菌素的产量最高。正交试验表明1000 mL培养基中加入玉米淀粉30 g,酵母浸粉4 g,pH 4,获得裂褶菌菌丝体干重、裂褶菌素的含量最高,分别为0.21 mg∕mL,2.13 mg∕mL。未稀释发酵液对酪氨酸酶活性的抑制率达到47.83%,说明发酵液可以很好地抑制酪氨酸酶的活性。发酵液的DPPH自由基清除率达到99.20%,可以充当自由基清除剂。试验结果为开发裂褶菌发酵类化妆品提供参考。
