老白干酒曲中酵母菌多样性分析
2019-01-07文淑婷
文淑婷,李 艳,2,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018)
老白干香型是我国白酒第11类香型,代表酒为衡水老白干酒,该酒自然协调、清雅独特的香气与其所用的酒曲密不可分。在白酒生产过程中,一直有“曲为酒骨”的说法,酒曲对于白酒的生产至关重要。酒曲中微生物组成复杂,其中酵母菌、细菌和霉菌这3 类微生物占据很大的比重。传统的酵母菌分离是通过将酵母菌进行培养,WL培养基鉴别,结合菌落和显微形态特征可将其进行初步形态聚类[1-6],再利用限制性片段多态性(restriction fragment length polymorphism,RFLP)分析进行分子水平的分类。26S rDNA D1/D2序列分析和5.8S-ITS RFLP[7]是广泛应用的两种分析鉴定技术。Esteve-Zarzoso等[8]将5.8S-ITS RFLP指纹技术应用于食品和发酵饮料中酵母菌的分类和鉴定;马凯等[9]则以26S rDNA D1/D2区序列分析法对15 株菌进行相关的分类研究;文献[1,10-14]均用到此法对菌种进行分析鉴定。
如今,变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)因具有快速、准确性高的优点,已广泛应用于目标样品中微生物的多样性分析[15-19],Durand[20]和Sha[21]等分别将DGGE技术应用于赭曲霉毒素A产生相关的真菌群体和发酵剂中酵母菌群多样性的研究。该技术的工作原理是使用聚丙烯酰胺凝胶对DNA进行电泳,长度相同而在碱基序列上存在差异的DNA双链的解链需要不同的变性剂浓度,不同的酵母菌被分开,实现了基因组水平的分离、纯化。该技术如今已经普遍应用于酒曲中微生物的群落结构研究。程才璎[22]和谭映月[23]等在对酱香型白酒酒曲中的微生物多样性研究中采用的技术为DGGE;姚淑敏等[24]提取6 种甜酒酒曲的总DNA,采用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)联合技术共鉴定得到3 种真菌和不可培养真菌;闫华文[25]利用DGGE针对不同地区的6 种甜酒曲进行研究发现其主要真菌为酿酒酵母、扣囊复膜酵母、米根霉以及不可培养真菌;李艳等[2]利用PCR-DGGE技术检测到羊羔美酒大曲中6 种细菌和4 种不可培养的细菌种类;赵东[26]在对西藏青稞酒酒曲的研究中曾论述道:PCR-DGGE弥补了以往微生物培养分离时间长、效率低下的缺陷,实现了对微生物较全面的分离鉴定。培养方法和非培养方法能够很好地结合,非培养方法为培养方法提供基础的菌群关系、培养基和培养条件信息,而培养方法可以补充非培养方法没有发现的菌群,得到菌株加以驯化和利用,两种方法相互补充。目前鲜见老白干酒曲中微生物群落结构的相关研究,本研究采用培养和非培养两种方法对老白干酒曲中的酵母菌进行分离鉴定,确定其属、种。采用PCR-DGGE技术对老白干酒曲中酵母菌的多样性进行分析,为进一步研究老白干酒曲的发酵能力提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
老白干香型酒曲 衡水老白干酒业股份有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂20 g/L;WL培养基[2-6]:胰蛋白胨5 g/L,酵母浸粉4 g/L,葡萄糖50 g/L,磷酸二氢钾0.55 g/L,氯化钾0.425 g/L,氯化钙0.125 g/L,硫酸镁0.125 g/L,氯化铁0.002 5 g/L,硫酸锰0.002 5 g/L,氯化钙0.125 g/L,溴甲酚绿0.022 g/L,琼脂20 g/L,pH 5.5±0.2。
1.1.3 分子试剂
PCR引物:上游引物NL1(5’-GCATATC AATAAGCGGAGGAAAAG-3’),下游NL4(5’-GGTCCGTGTTTCAAGACGG-3’);DGGE专用引物:上游引物GC-NL1(5’-CGCCCGCCG CGCGCGGCGGGCGGGGCGGGGGCATATCA ATAAGCGGAGGAAAAG-3’),下游引物 LS2(5’-ATTCCCAAACAACTCGACTC-3’);Taq DNA聚合酶、dNTP、限制性内切酶HinfI、HhalI和HaeIII均购自上海生工生物工程技术服务有限公司(以下简称上海生工公司)。
1.2 仪器与设备
DP-200低温培养箱 广东省医疗器械厂;ZQTY-70振荡培养箱 上海知楚仪器有限公司;AR1140分析天平美国Ohaus公司;ZQTY-70 PCR扩增仪、凝胶成像分析仪、DGGE仪 美国Bio-Rad公司;DYY-8C型稳压稳流电泳仪北京市六一仪器厂;SW-CJ-1BU洁净工作台 苏州安泰空气技术有限公司;XS-212-202双目显微镜(配有单反相机D5100) 尼康映像仪器销售有限公司。
1.3 方法
1.3.1 酵母菌形态学鉴定
1.3.1.1 酒曲样品预处理
将块状酒曲研磨成粉,过40 目筛。准确称取1 g酒曲粉,倒入盛有9 mL无菌水的锥形瓶中,至摇床160 r/min振荡培养0.5 h得到菌液。将菌液于10 mL无菌稀释管中进行梯度稀释,取0.2 mL 10-2、10-3、10-4等合适稀释度的菌液分别均匀涂布于YEPD培养基平板上,28 ℃进行培养。
1.3.1.2 酵母菌的分离
培养12 h后,每2 h观察一次,挑取疑似酵母菌的菌落,划线接种在新的YEPD培养基上[27],同时作好实验观察记录。
1.3.1.3 酵母菌的纯化
将筛选得到的酵母菌在YEPD培养基上重复纯化2~3 次,直到菌落为单菌株形成的菌落,再将其保藏。
1.3.1.4 酵母菌的形态聚类
将纯化菌划线接种于WL培养基,28 ℃恒温培养5 d,观察菌落特征[2-6]。并进行显微形态观察,记录菌落的大小和形状,对菌株进行显微形态聚类。
1.3.2 26S rDNA D1/D2序列分析法鉴定酵母菌
1.3.2.1 DNA的提取
每种形态随机选取1株保藏的酵母菌,反复活化培养2~3 次,28 ℃培养48 h,得到酵母菌单菌落。采用热裂解法[1]提取酵母菌DNA:吸取30 μL 0.25%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液放在离心管中,挑取大小合适的单菌落于管中混匀,振荡30~40 s,90℃水浴锅中水浴4 min,冰浴5min,13 000 r/min离心3.5 min,吸取上清液于0.2 mL的离心管中。-20 ℃保藏备用。
1.3.2.2 PCR扩增
PCR扩增为50 µL体系:上、下游引物各1 µL,Buffer(10×)5 µL,dNTP 1 µL,Taq酶0.5 µL,双蒸水40.5 µL,DNA 1 µL。PCR程序:95 ℃预变性7 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸80 s,循环36 次;再72 ℃延伸8 min。用1.0%琼脂糖凝胶电泳检验扩增结果。
1.3.2.3 26S rDNA D1/D2的RFLP分析
利用限制性内切酶HhalI、HinfI和HaeIII进行酶切分析,根据酶切结果对酵母均进行分子聚类[2,4-5]。20μL酶切体系:无菌双蒸水9 μL,buffer 2 μL,酶1 μL,PCR得到的扩增产物8 μL。酶切条件:37℃水浴2.5h。用2%的琼脂糖凝胶检验酶切的结果80~90 V电泳50~60min,在凝胶成像仪下拍照。
1.3.2.4 测序与数据分析
将PCR扩增产物委托上海生工公司进行测序。登录NCBI上的BLAST将测序结果与GenBank数据库中的序列进行同源性分析[4],同时向NCBI提交序列获得GenBank登录号。
1.3.3 PCR-DGGE法鉴定酒曲中的酵母菌
1.3.3.1 原料的预处理
酒曲样品经粉碎成粒状并过滤,称取4 g酒曲,加入36 mL磷酸盐缓冲溶液(可以用去离子水代替)200 r/min摇床振荡30 min,旋涡振荡5 min之后用4 层纱布过滤,滤液200 r/min离心5 min,取上清液8 000 r/min离心3 min之后得到的沉淀加入5 mL磷酸盐缓冲溶液,旋涡振荡5 min,离心沉淀,重复2 次。最终将所得沉淀溶解于1 200 µL无菌水中,将样品置于-20 ℃贮藏备用。
1.3.3.2 DNA提取
预先称取玻璃珠0.3~0.5 g于1.5 mL的离心管中,依次加入处理的样品250 µL,再加入250 µL TE缓冲液,最终在旋涡振荡仪振荡3~5 min。再加10% SDS 50 µL、氯化苄150 µL、蛋白酶K 10 µL在旋涡振荡仪振荡3~5 min。直至混合物呈现乳浊的状态,于50 ℃水浴10 min,混匀一次。重复上述操作5次。水浴结束之后加入3 mol/L NaAc溶液(pH 5.2)150 µL再混匀,-20 ℃放置持续15 min,12 000 r/min离心10 min之后得到上清液。小心取上清液放置于新1.5 mL已灭菌的离心管中,使用等体积的苯酚-氯仿-异戊醇(25∶24∶1,V/V)抽提2 次,最终用氯仿-异戊醇(24∶1,V/V)的溶液抽提1次。小心吸出上层液体于一新1.5 mL已灭菌的离心管中,拿出已经预冷好的异丙醇,加入上清液2 倍体积的异丙醇和1/10体积的3 mol/L NaAc溶液(pH 5.2)慢慢混匀,之后置于-20 ℃放置沉降2 h。2 h之后取出样品12 000 r/min离心10 min,再用70%的乙醇溶液洗涤2 次,自然晾干,加入30 µL TE缓冲液,-20 ℃贮藏备用。
1.3.3.3 PCR仪扩增片段
在超净台中配制好PCR体系之后用PCR扩增仪按照
1.3.2.2 节中PCR扩增的程序进行扩增,得到扩增产物。
1.3.3.4 变性胶溶液配制
按表1配比配制变性胶溶液,4 ℃保存待用。

表1 不同变性剂浓度胶溶液的配制Table 1 Preparation of gels with different denaturant concentrations
1.3.3.5 灌胶
先用灭菌水将玻璃板清洗干净、晾干,再组装玻璃板。分别向高、低浓度凝胶溶液中加入四甲基乙二胺(N,N,N’,N’-tetramethylethane-1,2-diamine,TEMED)和10%过硫酸铵溶液上下剧烈混匀(每16 mL的胶溶液加入TEMED 18 µL,10%过硫酸铵80 µL)。将高、低浓度胶溶液分别吸入标有高浓度注射器(HI注射器)和低浓度注射器(LO注射器),之后稳定固定在梯度灌胶器上。三通接头的两端连接HI注射器和LO注射器的灌胶管,另外一头连接着通向胶板的软管。手动缓慢转动齿轮开始灌胶,尽可能保持匀速。灌胶结束,插入尺梳,等待下层胶凝固,约需1~2 h(时间随室温而变)。灌入不含变性剂的上层胶,凝固时间约20~30 min。待上层胶溶液凝聚完成后,稍稍拔去梳齿检验胶是否拧好。
1.3.3.6 电泳
将制好的胶从制胶板上取下,将电泳液倒入电泳槽中并将玻璃板及夹具安装好,放入电泳槽内。 依次打开电泳仪的电源、回流泵及控温装置,设置需要的温度(60 ℃),等待电泳缓冲液加热至设置温度,上、下层缓冲液形成电流通路进行预电泳。200 V预电泳20 min。预电泳结束后开始点样,样品为PCR产物,与对应量的loading buffer混合均匀,用移液针点入加样孔中。重新打开各个开关,设置电泳所需的电压与时间,进行电泳。电泳结束后,取出凝胶玻璃板,溴化乙锭染色电泳胶,时间为20~30 min。利用凝胶成像仪观察DGGE凝胶的情况。
1.3.3.7 切胶与回收
准备锋利刀片,在凝胶仪的紫外灯照射下,切下目标的条带,置于1.5 mL离心管中。用适量灭菌双蒸水清洗条带,重新加入30 μL灭菌双蒸水,同时捣碎凝胶使DNA尽量溶出。取适量的浸泡溶液作为下一步PCR扩增模板,测序与数据分析同1.3.2.4节方法。
2 结果与分析
2.1 酵母菌形态学鉴定
从老白干酒曲中分离到57 株酵母菌。利用WL培养基实现对酵母菌的形态聚类,再在显微镜下观察、记录各个形态类型酵母菌的形态、大小,初步区分到6 种形态,其中各个形态的菌落形态描述、所占比例、酵母菌个体大小等如表2所示。6 种酵母的菌落形态、细胞形态见图1。
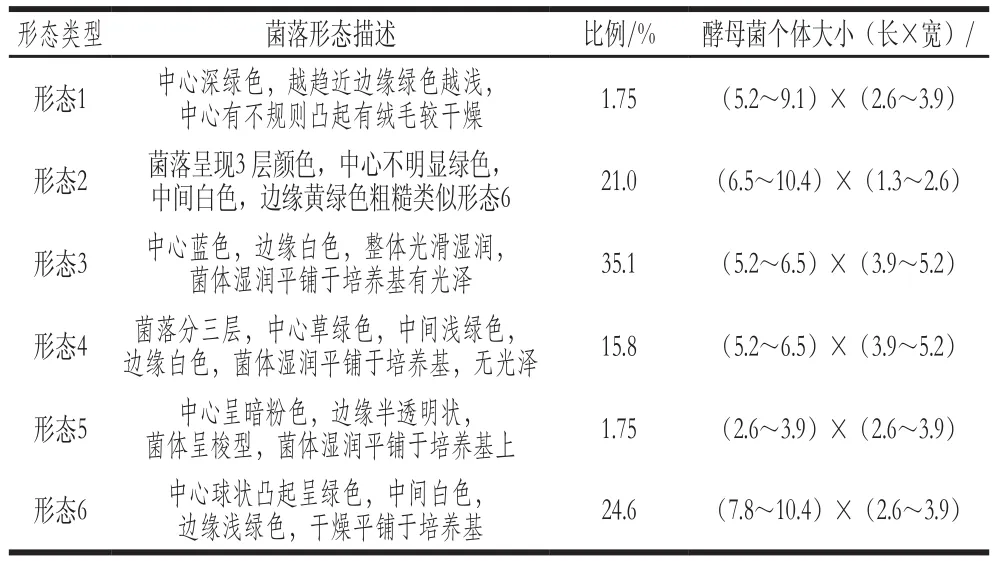
表2 WL培养基上酵母菌的形态特征及数量Table 2 Morphological characteristics and size of yeast strains cultured on WL medium
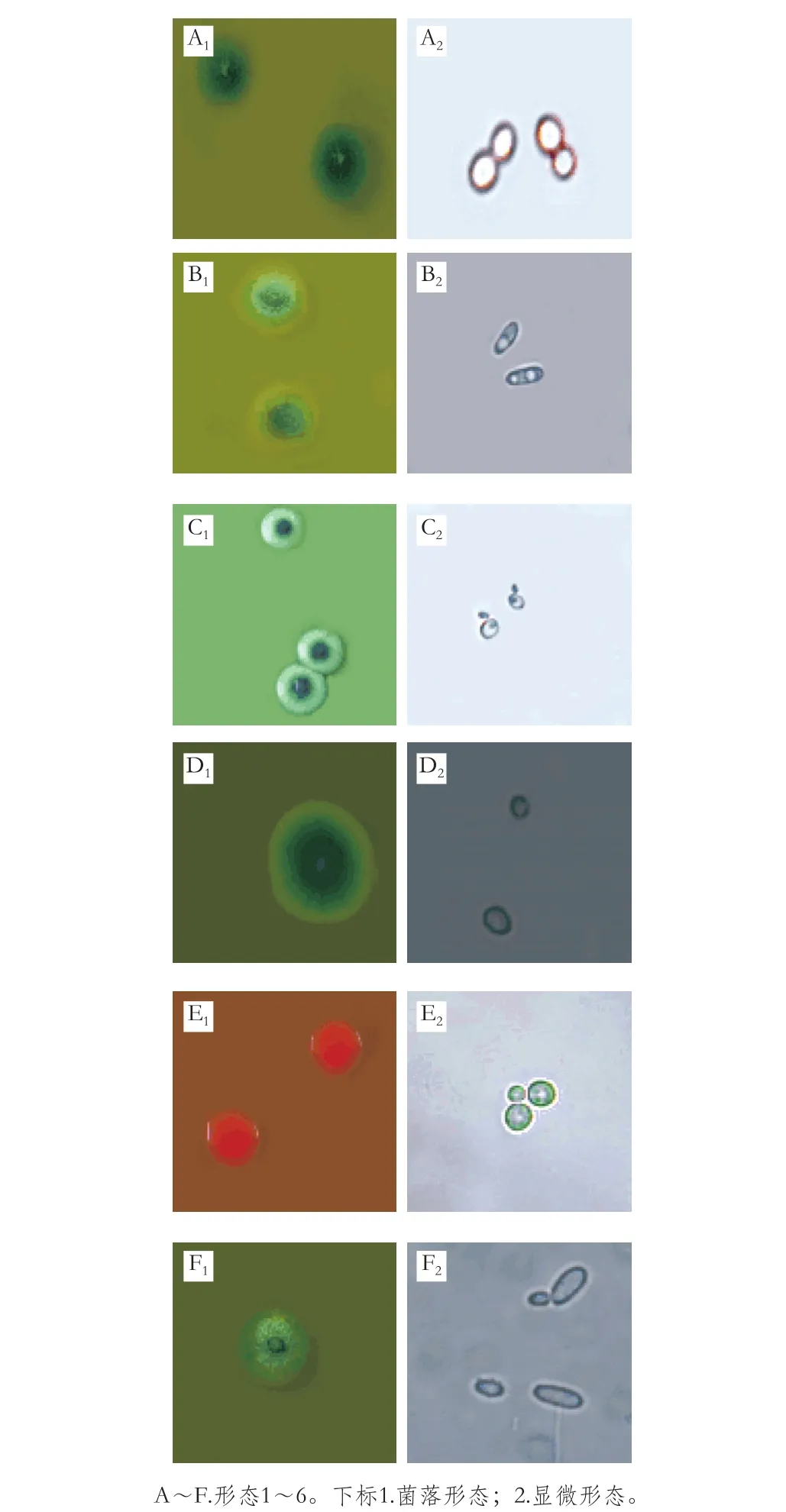
图1 各菌株菌落形态和显微形态Fig. 1 Colony morphology and micromorphology of various strains
根据表2和图1可以看出,形态3和形态6分别占总酵母菌株数量的35.1%和24.6%,两者共占总酵母菌种的59.7%,这两种酵母为老白干酒曲中的优势酵母,形态2和形态4的比例分别为21.0%、15.8%。比例最少的形态种类为形态1和形态5,均为1.75%。其中形态5的颜色呈现红色,张红霞[28]曾经对清香大曲中的微生物结构进行探究,通过培养分类的手段得到一种正面呈现红色,形态呈现球状凸起,表面光滑的酵母菌,经分子鉴定为胶红酵母(Rhodotorula mucilaginosa),该酵母与本研究中得到的形态5极度相似。
2.2 26S rDNA D1/D2 序列分析
2.2.1 酵母菌形态的酶切分析
本研究随机选取各个形态的酵母菌各1株。用SDS热裂解法提取其DNA,以酵母菌DNA为模板进行PCR程序,结果见图2A。由图2A可知,扩增出的形态1~6酵母菌的26S rDNA片段均在600 bp左右且条带明亮清楚,其中比较明显的是形态3扩增产物在540 bp左右,形态1扩增产物在640 bp左右,其他4 种形态基本都在610 bp左右,6 种形态的酵母菌扩增出的片段长度相当,但是其序列不同。进行限制性内切酶RFLP分析可以将酵母菌进行进一步聚类分析,不同的酵母菌序列经过3 种酶的作用,其产物有所差异,实验用到的限制性内切酶有HhalI、HinfI和HaeIII,3 种酶的酶切图谱分别见图2B、C、D。
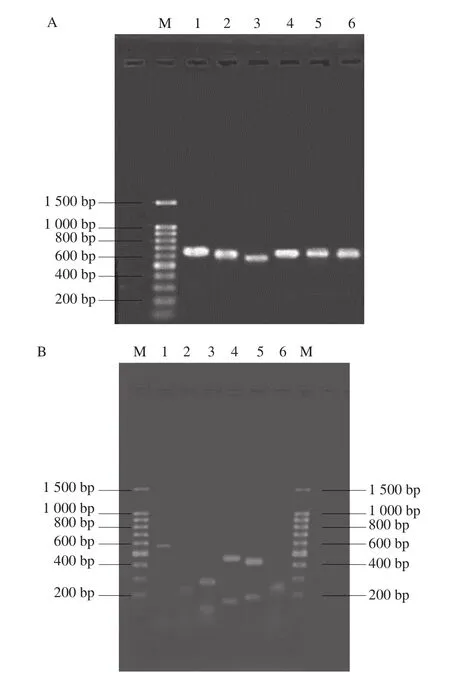
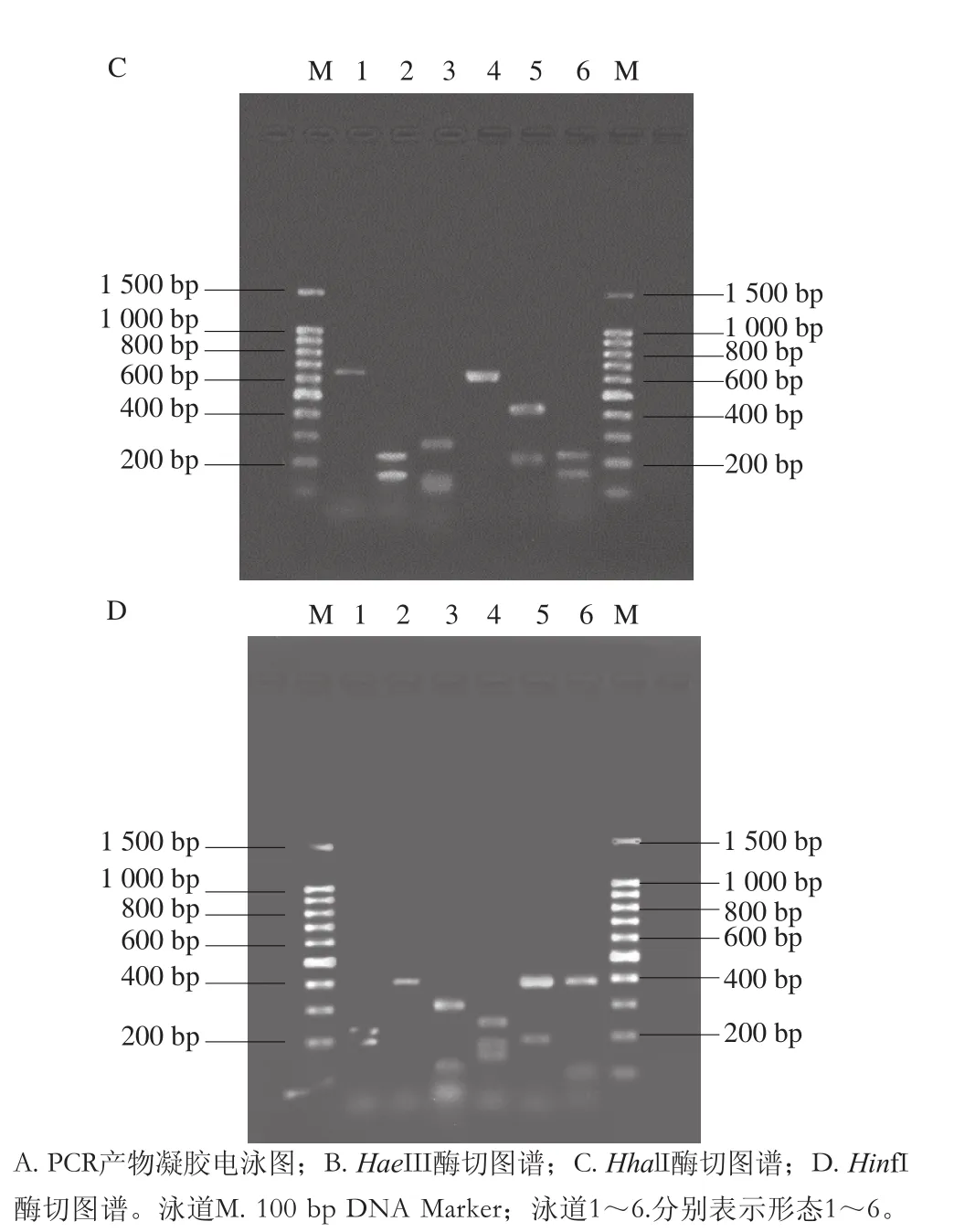
图2 PCR产物及3 种内切酶酶切分析图谱Fig. 2 PCR electrophoretogram and restriction analysis patterns of PCR-amplified 26S rDNA D1/D2 region
由图2B、C、D中可以分析得到共5 个分子类型。形态2和形态6在3 种酶的酶切作用下得到的片段均相同,经过HaeIII酶酶切为220 bp和240 bp 2 个片段,经HhalI酶酶切为180 bp和230 bp 2个片段,经过HinfI酶酶切后分为120 bp和400 bp 2 个片段,所以形态2和形态6为一种分子类型。其他的4 种形态分别被酶切成互不相同的片段,所以可以把6个形态类型归为5 种分子类型,结果见表3。

表3 6 种不同形态的26S rDNA PCR-RFLP结果Table 3 26S rDNA PCR-RFLP analysis of six kinds of yeast
2.2.2 测序结果及同源性分析
将扩增后的产物送至上海生工公司测序获得序列结果,登录NCBI进行BLAST比对,并向NCBI提交序列,获得GenBank的登录号,见表4。菌株序列的相似度比对结果均在98%~100%,在GenBank中下载与相应物种分子类型相似度高的菌株序列,再利用MEGA4和邻接法构建的系统发育树见图3。

表4 5种分子类型的26S rDNA D1/D2序列测定结果Table 4 Determination of 26S rDNA D1/D2 sequence of five molecular types
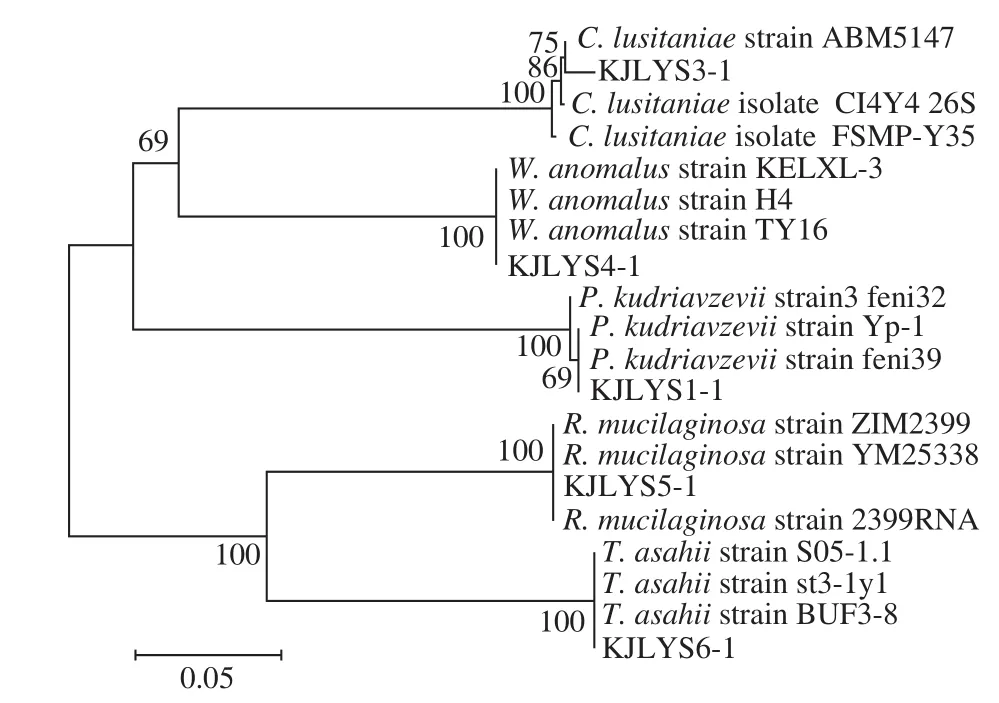
图3 基于26S rDNA D1/D2序列利用MEGA4和邻接法构建的系统发育树Fig. 3 Phylogenetic tree based on 26S rDNA D1/D2 sequence using MEGA4 and neighbor-joining methods
由图3可清楚判断出酵母菌的同源关系远近,各个菌株分支独立分别属于不同的种属。P. kudriavzevii和C. lusitaniae分别占总酵母数的45.6%和35.1%,为主势菌;W. anomalus仅占15.8%;T. asahii和R. mucilaginosa均为1 株,所占比例为1.75%,为数量较少的酵母菌。Jeyaram等[29]对印度一种传统的发酵剂(类似酒曲)中的酵母菌进行研究,分离到的酵母菌有Saccharomyces cerevisiae、P. kudriavzevii、Hansenula anomala、T. asahii、热带假丝酵母(Candida tropicalis)等,P. kudriavzevii为其中主势菌之一,这一点与本研究结果一致。P. kudriavzevii能够同时发酵葡萄糖和木糖两种糖,能最大限度实现乙醇的转化。惠丰立等[30]从河南卧龙酒厂提供的中温大曲中共分离得到92 株酵母菌,通过5.8S-ITS RFLP 指纹图谱分析后,得到12 个不同的类群。从各个类群中随机选取代表菌株进行26S rDNA D1/D2区域序列分析和系统发育分析,大曲中酵母菌主要为Saccharomyces、Pichia、Zygosaccharomyces、Candida、Rhodotorula、Issatchenkia等9 个已知酵母菌属。本研究中也同样鉴定得到P. kudriavzevi、R. mucilaginosa两种酵母属的菌株。C. lusitaniae、R. mucilaginosa和T. asahii虽然属非酿酒酵母,但却是产β-葡萄糖苷酶的菌株,蒋文鸿[31]筛选了昌黎和济源两地产β-葡萄糖苷酶的菌株,其中就有C. lusitaniae、R. mucilaginosa和T. asahii。发酵过程中β-葡萄糖苷酶的出现可以使香气物质从结合态变成游离态[32],达到增香的效果。该菌株对老白干香型白酒特异性香气的形成具有一定的促进作用。王玉霞[33]在发酵过程中发现酿酒酵母出现的频率较少,只在发酵后期出现,发酵前期出现的大部分是非酿酒酵母。这一点可以为本研究未分离到酿酒酵母作出解释,酿酒酵母的出现大多是在发酵后期。W. anomalus具有产苯乙醇能力[34],为白酒产香发挥正向作用,增添风味属于酒曲中不可缺少的一类酵母。非酿酒酵母的存在为老白干香型的白酒增添风味,是酒曲中不可或缺的酵母菌。
2.3 PCR-DGGE法鉴定酒曲中酵母菌
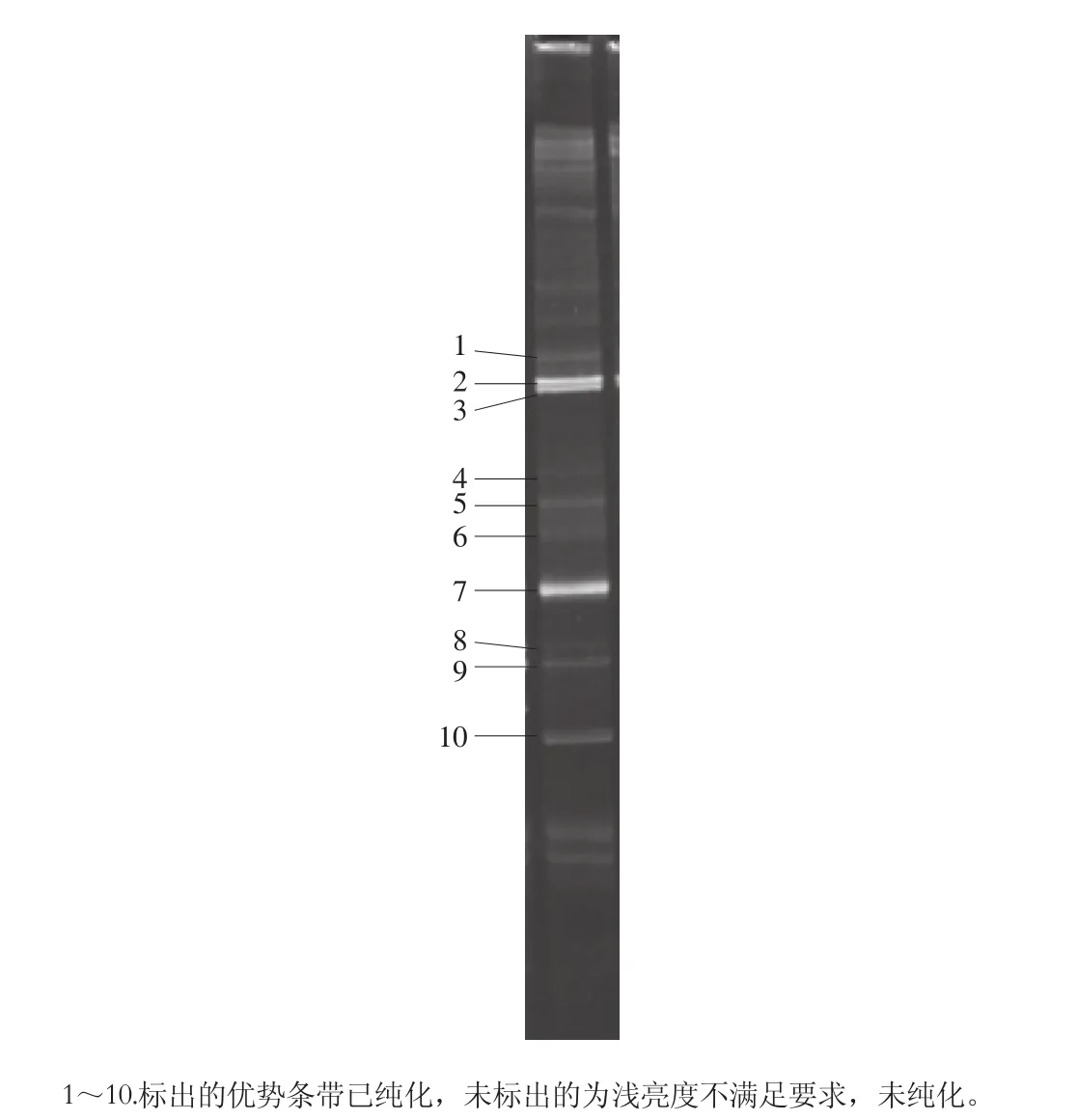
图4 酒曲中DGGE优势条带Fig. 4 Dominant DGGE bands in Laobaigan liquor Daqu
利用PCR-DGGE技术对酵母菌进行鉴定得到DGGE图谱条带见图4。通过对回收的条带进行重新PCR扩增,再委托上海生工公司测序,获得了片段序列和NCBI上的BLAST结果。

表5 PCR-DGGE图谱条带的测序结果Table 5 Sequencing of PCR-DGGE bands
PCR-DGGE非培养方式分离得到10 株条带比较亮的优势菌见表5,其中H. burtonii 2 株,W. anomalus、Wickerhamomyces sp.、T. asahii、C. tropicalis和Candida sp.各1 株,还有3 株为未知的不可培养酵母uncultured Saccharomycopsis。根据DGGE图,其他条带较浅,不满足切胶条件,通过PCR-DGGE方式从遗传基因上证明了酒曲中酵母菌的多样性。W. anomalus和T. asahii是两类产生香气物质的酵母菌。高亦豹[35]利用26S rRNA D1区进行扩增,再经过DGGE实验在大曲中鉴定得到T. asahii、W. anomalus、扣囊复膜酵母(Saccharomycopsis fibuligera)、汉逊德巴利酵母(Debaryomyces hansenii)等13 种酵母菌,本研究中也相应检测到T. asahii、W. anomalus和3 株不可培养酵母uncultured Saccharomycopsis,其结果与本研究基本一致。在酒曲中非酿酒酵母菌一般在发酵初期参与发酵代谢,产生一些非常重要的二级代谢产物,在一定程度上能提高白酒风味的复杂性,同时能够分泌酶的酵母对白酒的风味物质形成具有一定的催化作用。姚淑敏等[24]利用PCR-DGGE对甜酒曲中的真菌进行鉴定,发现在传统的酒曲中的真菌除了酵母属之外,不可培养真菌在甜酒曲中也起到非常重要的作用,这一点印证了本研究的检测结果。
2.4 培养和非培养方法鉴定结果比较
培养方式和非培养方式分别鉴定得到5、10 种分子类型,其中培养方式得到的酵母均能够采用传统的培养技术培养,而非培养PCR-DGGE技术分离得到可培养酵母7 种,不可培养的酵母3 种。一方面,由于PCR-DGGE技术为直接提取酒曲中总DNA,再进行PCR扩增、电泳,所以能够对酒曲中无法通过培养手段分离得到的酵母菌进行鉴定,本研究中鉴定得到了3 株uncultured Saccharomycopsis。彭杨等[36]基于PCR-DGGE技术对四川麸醋固态发酵过程中真菌进行微生物群落分析,分离鉴定到12 株真菌,其中亦有3 株不可培养的真菌,姚淑敏等[24]在甜酒曲中利用DGGE技术分离得到不可培养真菌1 株,不可培养的真菌在酒曲中也占有一定比重。
另一方面,两种鉴定技术均得到W. anomalus和T. asahii,而C. lusitaniae、R. mucilaginosa、P. kudriavzevii则通过培养方式得到,PCR-DGGE技术并未鉴定到这3 种菌。传统的菌株分离与菌株的活性以及培养基的适宜性密切相关,故而分离得到的酵母菌与PCR-DGGE技术鉴定结果具有差异性。在DNA抽提过程中,群落中含量很少的一些菌株,用常规的DNA提取方法可能提不到或提到微量的DNA,这会影响其PCR扩增,从而导致PCRDGGE技术无法检测到[37]。同时,针对非培养酵母,则只能利用PCR-DGGE技术鉴定得到。PCR-DGGE技术具有检测限低、准确、同时可检测多个样品的优点,但是也具有一定的局限性,繁杂的DNA提取、扩增可能会引起分析误差。培养与非培养鉴定技术具有差异性但却相互补充,将两者结合使用则能够更加全面和清楚地探究老白干酒曲中的酵母菌多样性。
3 结 论
本研究通过培养方式分离纯化到57 株酵母菌,分为6 种形态,5 种分子类型,分别为P. kudriavzevii、C. lusitaniae、W. anomalus、R. mucilaginosa、T. asahii。其中,P. kudriavzevii和C. lusitaniae分别占总菌株数的45.7%和35.1%,为优势菌群。PCR-DGGE法鉴定得到10 株酵母菌,分别为H. burtonii 2 株,W. anomalus、Wickerhamomyces sp.、T. asahii、C. tropicalis和Candida sp.各1 株,uncultured Saccharomycopsis 3 株,PCR-DGGE法分离纯化酵母菌直接、快速,能够更详细准确地鉴定出酒曲中的酵母菌。采用培养与非培养两种方式探究老白干酒曲中的酵母菌,两种方法各有特点且相互补充,共得到属于8 个属中的10 株酵母,包括P. kudriavzevii、C. lusitaniae、W. anomalus、R.mucilaginosa、T. asahii、H. burtonii、Wickerhamomyces sp.、 C. tropicalis、 Candida sp.、 uncultured Saccharomycopsis,为后续进一步研究该香型白酒的风味特征和酒曲发酵性能提供理论支持。
