不同热处理温度下大豆11S球蛋白Zeta电位、粒径和红外光谱分析
2019-01-07齐宝坤赵城彬江连洲
齐宝坤,赵城彬,江连洲,徐 靓,李 红,李 杨,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.吉林农业大学食品科学与工程学院,吉林 长春 130118)
大豆11S球蛋白是一种具有不均匀性的寡聚蛋白,由酸性多肽链(A亚基,分子质量350~370 kDa)和碱性多肽链(B亚基,分子质量约20 kDa)构成[1]。酸性亚基和碱性亚基堆积形成2 个六元环结构,形成一个中空的扁圆柱体,以疏水性六聚体的形式存在,氢键和静电作用对大豆11S球蛋白整体结构的稳定具有重要的贡献[2]。热杀菌和喷雾干燥是大豆蛋白食品生产加工过程中常用的热处理方法,这影响着大豆蛋白的稳定性、乳化性和溶解性等功能性质[3]。
目前,关于热处理对大豆11S球蛋白结构和溶解/聚集状态影响的报道较多。Marcone等[4]利用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)研究热处理对大豆11S球蛋白结构的影响,指出酰胺I带1 635 cm-1处红外光谱峰强度的增加表明大豆11S球蛋白在热聚集过程中分子间维持β-折叠的氢键加强。Tezuka等[5]研究指出当大豆11S球蛋白在100 ℃热处理时,大部分球蛋白分子快速形成可溶性聚集体;继续延长加热时间,可溶性聚集体越变越大,最后形成沉淀。Mills等[6]利用核磁共振光谱研究热处理过程中大豆11S球蛋白二级结构的变化,表明当加热温度升高至95 ℃时大豆11S球蛋白富含Gln和Glu残基的高可变区中具有氢键结构的α-螺旋结构消失。Zeta电位和平均粒径表征蛋白质的溶液稳定性和聚集程度,同时能够反映蛋白质分子结构变化[7]。Cruz-Torres等[8]对11S球蛋白的结构及Zeta电位和流体动力学半径等理化性质的研究表明,蛋白质的结构和溶液性质与其功能性质密切相关。FTIR技术是结构分析的重要工具,能够分析蛋白质分子内的氢键,是测定多肽和蛋白质二级结构的有效方法[9]。大豆11S球蛋白的大多数活性基团包埋于紧密球状分子内部,这极大地限制了大豆蛋白在食品加工中的应用。本实验采用加热温度80、90、100 ℃对大豆11S球蛋白进行热处理0~90 min,测定蛋白质的Zeta电位和平均粒径,同时对热处理过程中的蛋白质进行红外光谱分析,比较不同热处理温度条件下大豆11S球蛋白Zeta电位、平均粒径和二级结构的变化规律,为大豆蛋白功能性质的改善及新产品的研发提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆(东农46) 东北农业大学大豆研究所;牛血清白蛋白、溴化钾(分析纯) 美国Sigma公司;Lowry法蛋白质含量测定试剂盒 上海荔达生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FD 5-3型冷冻干燥机 美国SIM公司;Allegra 64R低温高速离心机 美国Beckman公司;AKTA-蛋白质纯化仪 美国GE公司;ZetaPALS-Zeta电位仪、ZetaPALS-激光粒度分析仪 美国布鲁克海文仪器公司;MAGNAIR560 FTIR系统 美国尼高力公司。
1.3 方法
1.3.1 大豆11S球蛋白的制备
参照齐宝坤等[10]的处理方法。1.3.2 大豆11S球蛋白的热处理
将大豆11S球蛋白分散于磷酸缓冲液中,室温条件下磁力搅拌2 h,使蛋白质最终质量分数为2%。对大豆11S球蛋白溶液进行热处理,热处理温度为80~100 ℃,热处理时间为10~90 min。考察热处理对大豆11S球蛋白Zeta电位和粒径分布的影响,同时进行红外光谱分析。
1.3.3 Zeta电位的测定
根据Crudden等[11]的测定方法,采用ZetaPlus Zeta电位仪测定大豆11S球蛋白溶液的Zeta电位。将11S球蛋白样品用缓冲液稀释至质量分数为0.2%,上样体积为1 mL。Zeta电位测定条件:聚苯乙烯池(1 cm)若干,铂电极(0.45 cm2,间距0.4 cm)一对。温度为25 ℃,温度平衡时间为2 min。
1.3.4 粒径分布的测定
根据李杨等[12]的测定方法,采用ZetaPlus粒度分析仪测定大豆11S球蛋白的平均粒径分布。将11S球蛋白样品用磷酸缓冲液稀释至蛋白质量分数为0.2%的溶液。过0.45 μm水系醋酸纤维素滤膜,室温条件下进行测量。
1.3.5 FTIR测定
根据Zhao Chengbin等[13]的方法测定大豆11S球蛋白样品的FTIR。利用五氧化二磷对样品进行充分干燥,取干燥后的样品1 mg,以质量比1∶100的比例与溴化钾混合、研磨,然后采用压片机进行压片。在25 ℃条件下进行4 000~400 cm-1的波数扫描,设置波数精度为0.01 cm-1,分辨率为4 cm-1,扫描次数为64 次。采用Peakfit软件对FTIR图谱进行拟合,分析二级结构类型和相对含量。
1.4 数据统计分析
每组实验进行3 次重复,作图采用Origin 8.5软件完成,采用SPSS V17.0软件进行ANOVA差异显著性分析。
2 结果与分析
2.1 不同热处理条件下大豆11S球蛋白的Zeta电位分析
Zeta电位是溶液中带电微粒双电层中剪切面的电势,能够反映胶体体系的稳定性。当Zeta电位绝对值较低时,体系内的蛋白分子表面电荷较少,体系不稳定,分子间容易相互靠近聚集形成沉淀;当Zeta电位绝对值较高时,体系内的蛋白分子表面电荷较多,可以通过静电斥力维持体系稳定,使蛋白分子间不易发生聚集[14]。Zeta电位不仅与蛋白质表面电化性质有关,而且还与体系温度有关[15]。如图1所示,与未经热处理的大豆11S球蛋白相比,热处理会使11S球蛋白的Zeta电位绝对值降低,这说明热处理后蛋白表面电荷减少。随着热处理时间的延长,80 ℃和90 ℃热处理大豆11S球蛋白的Zeta电位绝对值呈减小趋势,这表明热处理后蛋白质分子结构发生一定程度的展开,疏水性氨基酸外露,使得蛋白质表面电势降低。然而,100 ℃热处理大豆11S球蛋白的Zeta电位绝对值呈先减小后增大的趋势,这可能由于热处理一方面使得大豆11S球蛋白分子结构发生一定程度的膨胀,使得球蛋白分子表面的静电荷密度相对降低,11S球蛋白溶液的Zeta电位绝对值也随之降低,多肽链间静电相互作用增大,使得部分展开的多肽链互相靠近[16];另一方面大豆11S球蛋白部分发生变性,分子结构去折叠展开,疏水基团暴露出来,它们之间通过疏水相互作用互相靠近。在静电相互作用和疏水相互作用下,展开的多肽链间和暴露出来的疏水基团间很容易在2 种作用力下形成聚集体,带电氨基酸在聚集体表面重新排布[17],使得Zeta电位绝对值又出现增大。

图1 不同热处理条件下大豆11S球蛋白的Zeta电位Fig. 1 Zeta potential of 11S glycinin under different heat treatment conditions
2.2 不同热处理条件下大豆11S球蛋白的平均粒径分析
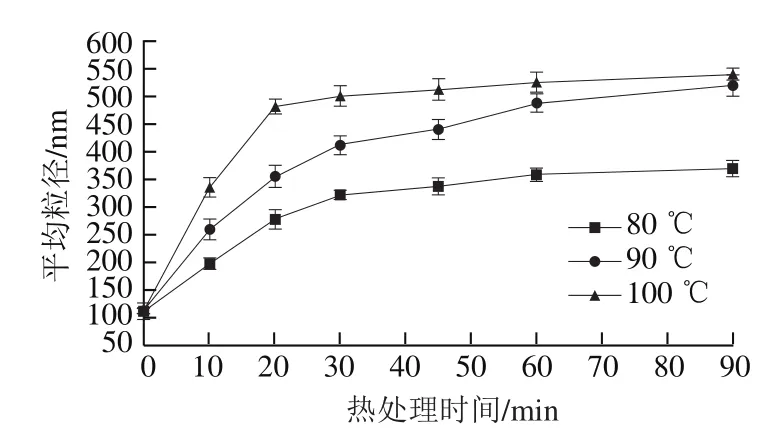
图2 不同热处理条件下大豆11S球蛋白的平均粒径Fig. 2 Average particle size of 11S glycinin under different heat treatment conditions
在蛋白质聚集过程中,常用蛋白质的平均粒径来表征蛋白的聚集程度,平均粒径也能够反映出蛋白质空间构象的改变[18]。由图2可知,与未经热处理的大豆11S球蛋白相比,热处理后的11S球蛋白具有更大的平均粒径,且高温处理的蛋白粒径进一步增大,表明较高温度的热处理利于大尺寸聚集体的形成。
80 ℃热处理的大豆11S球蛋白溶液在加热0~30 min范围内平均粒径显著增大,由112.6 nm增加到321.5 nm,但30 min后平均粒径变化较小。这是因为热处理破坏了维持蛋白质的主要作用力如疏水作用、静电作用、范德华力等,同时热处理时间的延长会加速蛋白质分子运动,增加了蛋白质碰撞几率,蛋白质分子聚集现象增加[19],表现为蛋白质分子平均粒径的增大。在30 min后蛋白质分子粒径的变化较小可能是由于在此温度下大豆11S球蛋白并未发生明显的聚集行为。
90 ℃热处理的大豆11S球蛋白溶液的平均粒径随热处理时间的延长逐渐增加,热处理90 min后粒径由112.6 nm增加到512.5 nm。100 ℃热处理的大豆11S球蛋白分子平均粒径在前20 min增幅较明显,由112.6 nm增加到459.8 nm,但随着加热时间的延长,聚集体粒径变化较小。比较合理的解释认为在90 ℃和100 ℃热处理条件下,高温使11S球蛋白发生变性,酸性亚基和碱性亚基之间的二硫键发生断裂,酸性亚基部分伸展,巯基暴露,经过巯基/二硫键交换反应解离出碱性亚基,通过二硫键、疏水相互作用和静电相互作用等将酸性亚基和碱性亚基结合形成可溶性聚集体[20]。在90 ℃热处理条件下蛋白质部分变性,形成的聚集体数量并不多,体系也没有出现絮凝现象。然而,100 ℃热处理形成大量具有较大粒径的聚集体导致溶液在加热后变得混浊。100 ℃热处理超过20 min后,蛋白质已经完全变性,热聚集体已经形成,蛋白分子的粒径不会发生较大变化。
2.3 不同热处理条件下大豆11S球蛋白的红外光谱分析
FTIR是一种分析蛋白质结构的有效方法,用于反映蛋白质多肽链的构象信息,尤其是二级结构[21]。如图3所示,对于大豆11S球蛋白而言,分子中的肽键是一种酰胺键,它在红外光谱区有特征的光吸收峰。其中在酰胺I带(1 600~1 700 cm-1)处吸收峰最强,主要是由C=O的伸张振动引起的,同时也与N—H的弯曲扭折和C=N的伸缩振动有关[22]。利用波段缩小技术将FTIR图中的酰胺I带细分,同时进行高斯拟合处理,确定拟合图谱中各子峰与二级结构类型的对应关系,即1 610~1 640 cm-1为β-折叠,1 640~1 650 cm-1为无规卷曲,1 650~1 660 cm-1为α-螺旋,1 661~1 700 cm-1为β-转角[23],根据各峰积分面积计算大豆11S球蛋白二级结构的定量信息。
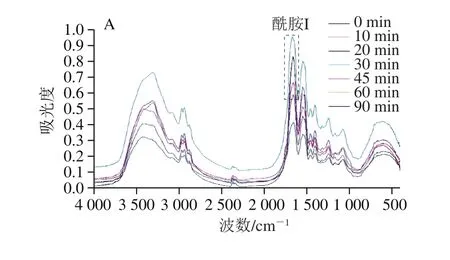
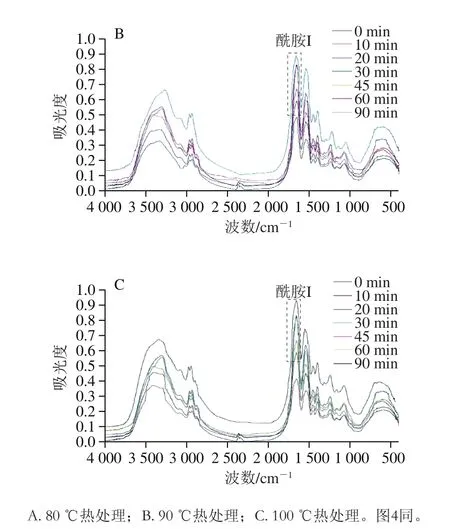
图3 不同热处理条件下大豆11S球蛋白FTIR图Fig. 3 FTIR spectra of 11S glycinin under different heat treatment conditions
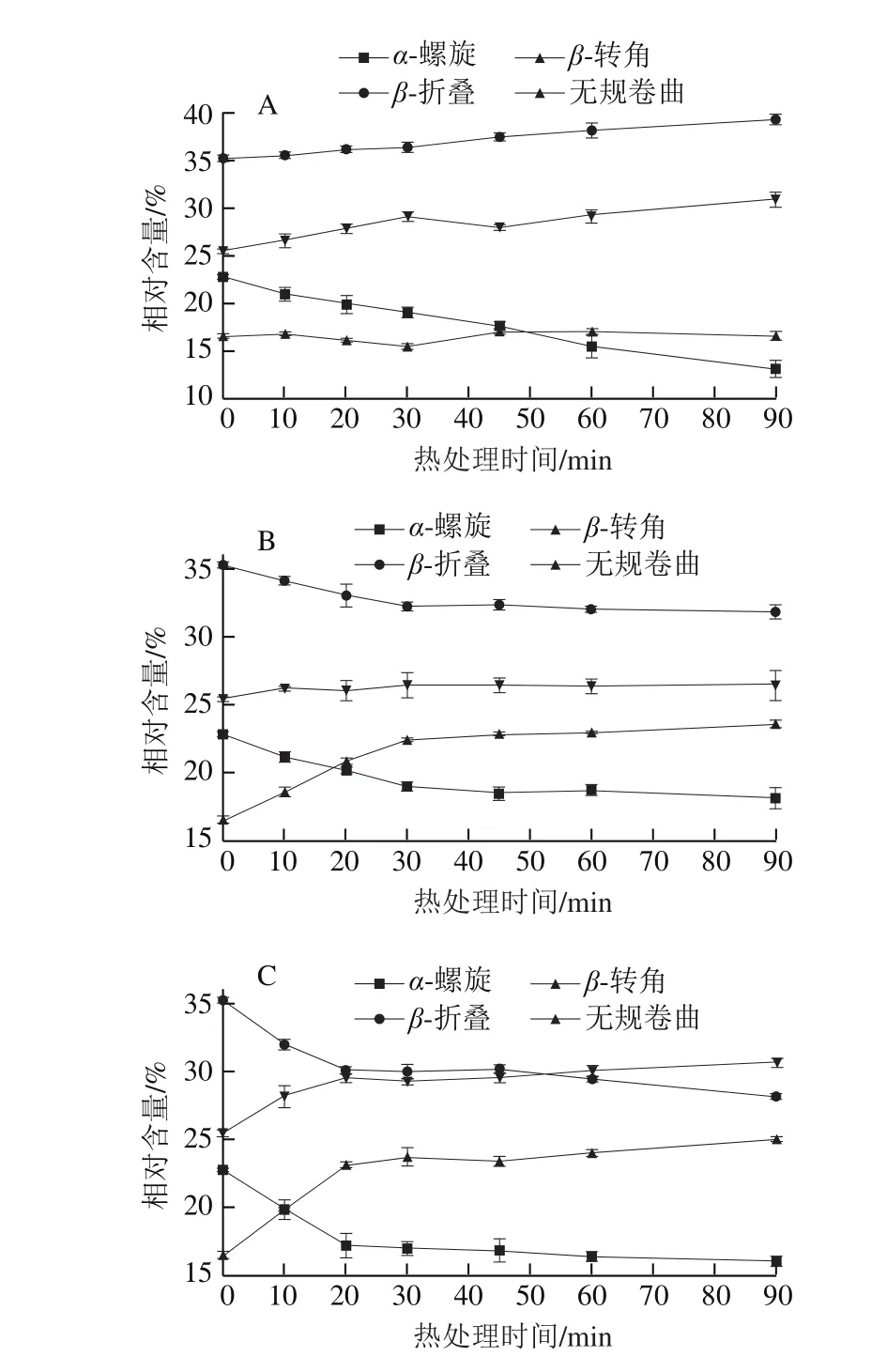
图4 不同热处理条件下大豆11S球蛋白二级结构相对含量的变化Fig. 4 Secondary structure contents of 11S glycinin under different heat treatment conditions
由图4A可知,对于质量分数为2%的大豆11S球蛋白溶液来说,在整个80 ℃热处理过程中,α-螺旋相对含量持续减少,而β-折叠相对含量持续增加。热处理0~30 min β-转角相对含量下降,无规卷曲相对含量升高,超过30 min后此变化趋势相反。这说明80 ℃热处理过程中β-转角和无规卷曲结构的转化可能相互抵消,而最终表现为α-螺旋结构转变为β-折叠结构。陆彬等[24]通过FTIR研究热变性引起白蛋白二级结构的改变,得到与本实验类似的结果。这种变化趋势可能是由于80 ℃热处理破坏了α-螺旋结构的氢键,使α-螺旋结构解旋,进而通过分子间的相互作用重新形成β-折叠结构[25-26]。
由图4B可知,90 ℃热处理2%的大豆11S球蛋白0~30 min会引起α-螺旋和β-折叠相对含量的减少,β-转角相对含量的增加,而无规卷曲相对含量变化不显著。超过30 min热处理,所有二级结构相对含量没有变化,表明90 ℃热处理0~30 min发生α-螺旋和β-折叠结构向β-转角结构转变。由图4C可以看出,在100 ℃热处理条件下,2%的大豆11S球蛋白溶液中的蛋白质二级结构变化速率显著高于80 ℃和90 ℃热处理,这可能与较高温度条件下形成较大尺寸的热聚集体有关(图2)。100 ℃热处理0~20 min会使α-螺旋和β-折叠结构迅速转变为β-转角和无规卷曲结构,20~45 min各二级结构没有相互转化,而超过45 min后这种转变进一步加强。Moriyama等[27]研究指出,采用圆二色谱对牛血清蛋白进行95 ℃热处理,蛋白质中α-螺旋结构含量随温度升高而降低,无规卷曲结构含量随温度升高而增加。Wang等[28]对大豆11S球蛋白二级结构进行研究,在20~60 ℃的低温条件下热处理时,大豆11S球蛋白的构象几乎未发生变化,但将热处理温度升高至90 ℃以上时,就出现了与本实验相同的结果。发生这种二级结构变化可能是由于在高温热处理条件下,大豆11S球蛋白发生变性,蛋白质分子去折叠展开,维持α-螺旋和β-折叠结构的氢键断裂,使α-螺旋和β-折叠结构遭到破坏[29]。被破坏的α-螺旋和β-折叠结构一部分转变为无规卷曲结构,另一部分则形成了更为有序的结构单元,这有利于β-转角结构的形成[30]。
3 结 论
热处理会改变大豆11S球蛋白的Zeta电位和平均粒径。随着热处理时间的延长,80 ℃和90 ℃热处理条件下大豆11S球蛋白的Zeta电位绝对值逐渐减小,平均粒径显著增大,超过30 min后粒径变化较小。而100 ℃热处理条件下蛋白质的Zeta电位绝对值呈先减小后增大的趋势,平均粒径逐渐增加。与80 ℃和90 ℃热处理相比,100 ℃热处理的Zeta电位绝对值变化更显著,平均粒径更大。红外光谱分析表明,酰胺I带(1 600~1 700 cm-1)处吸收峰最强,拟合后得到大豆11S球蛋白的二级结构相对含量。对于2%的大豆11S球蛋白溶液,80 ℃热处理过程中β-转角和无规卷曲结构的转化可能相互抵消,而最终表现为α-螺旋结构转变为β-折叠结构;90 ℃热处理0~30 min发生α-螺旋和β-折叠结构向β-转角结构转变,超过30 min各二级结构不再相互转化;100 ℃热处理0~20 min会使α-螺旋和β-折叠结构迅速转变为β-转角和无规卷曲结构,20~45 min各二级结构没有相互转化,而超过45 min后这种转变进一步加强。
