不同澄清剂对高铝硅玻璃的澄清作用
2019-01-05,,,,,
,,, , ,
(1.海南大学,海南省特种玻璃重点实验室,海南 海口 570228; 2.海南中航特玻科技有限公司,特种玻璃国家重点实验室,海南 澄迈 571924)
1 前 言
高铝硅酸盐玻璃具有强度大、硬度高、耐磨损、化学稳定性好等特点[1],在风电、电子显示、交通工具等领域展现出良好的应用前景[2]。但其具有熔点高、粘度大、表面张力大等基本物理特性,会对玻璃的熔化、澄清造成极大的困难[3]。在玻璃熔化过程中,易出现玻璃熔化不均而产生条纹,在澄清过程中气泡排出异常困难也是目前亟待解决的重要问题[3]。
气泡是玻璃生产过程中最为常见的缺陷之一[4],其会影响玻璃制品外观、透明度、机械强度等性能[5],需要澄清后才能达到生产要求。目前,玻璃澄清方法有两类[6],其中一类就是本研究所采用的化学澄清法。化学澄清法就是向配料里添加一种或多种澄清剂,在玻璃的熔化过程中释放出气体以加速气泡的排出,起到澄清的作用。高铝硅酸盐玻璃熔化温度高、高温粘度大,应该选择适合高温澄清的澄清剂。研发澄清效果好、无污染、低成本的澄清剂成为了高铝硅酸盐玻璃生产企业的主要目标。
由于玻璃熔化澄清过程通常是在1300℃以上高温下进行的,难以观察其真实过程,澄清过程中的气泡长大、上升规律也多是通过模拟得到。在本文中,使用CelSian高温观测系统,可直观得到气泡的数量、尺寸的变化情况及其运动规律等,进而分析澄清剂对气泡的影响。
2 气泡上浮过程的受力分析
气泡在玻璃液中上浮受到几个力的共同作用,其中包括:浮力、气泡自身重力、Basset力、粘性阻力。由于气泡自身重力的数量级比其他力要小很多,因此可以忽略不计。而Basset力是在气泡加速上升过程中带动周围玻璃液运动,由于运动液体存在惯性而产生的阻碍气泡运动的一种力。因此,在气泡达到稳定的匀速运动阶段时,Basset力也可忽略不计[7],此时可认为只受到浮力及粘性阻力的作用,浮力表达式为:
πD3ρlg
(1)
粘性阻力表达式为:

(2)
此时两力达到平衡,即:FV=FD
(3)
通过整理最终气泡上升速度为:
(4)
其中,D为气泡直径;ρl为玻璃液密度;CD为阻力系数;vb为气泡上升速度。
通常情况下,阻力系数的表达式为:
(5)
其中R为气泡半径。
在保温过程中,玻璃液温度、密度保持不变,CD为常数;因此,此时气泡的上升速度只与气泡的直径相关。
3 实 验
3.1 高铝硅玻璃的成分设计及澄清剂用量
主要原料:超白硅砂、氧化铝、无水碳酸钠、无水碳酸钾、碱式碳酸镁;澄清剂:氧化锡、氯化钠、硫酸钠。
本实验设计高铝硅酸盐玻璃化学组成如表1。各组样品澄清剂添加量如表2所示。

表1 高铝硅酸盐玻璃设计成分/wt%Table 1 Composition of high aluminosilicate glass

表2 澄清剂添加量/wt%Table 2 Dosage of fining agents
3.2 实验方法
CelSian高温观测系统,是一种高温可视设备,可测最高温度1600℃。实验过程中可由其专用软件得到以下信息:气泡数目、气泡大小、气泡尺寸分布、气泡上升速率、视频图像中刻度/标尺的显示、视频图像中重要温度及时间信息的显示,同时,利用 CCD 摄像机记录的图片通过视频制作软件制作熔化工艺动画[8]。
熔制工艺:室温加料至石英管中,然后升温至1600℃,并保温1.5h,之后在1.5h内降温至1100℃,再将石英管取出结束实验。加热升温5min后启动摄像头,以每秒两张的速度对石英管摄像,直至降温至1150℃,最后制作成视频,观察石英砂的熔融情况,澄清剂的作用温度,气泡的数量、大小、聚集、破裂等随温度、时间的变化情况;统计气泡的逸出时间及气泡的平均吸收率。
4 结果与讨论
玻璃的澄清过程一般分为两个阶段:第一阶段高温下澄清剂放出气体加速玻璃液中气泡上升逸出;第二阶段在降温过程中没有来得及逸出的气泡通过气体的物理化学溶解被玻璃液吸收。因此,气泡的上升速率、逸出速率和吸收率是评价澄清剂效果的重要标准。
4.1 气泡上升速率的影响因素
在1600℃保温阶段,选择A4、B4、C4三组样品,从每组样品中依次选择五个尺寸最大的气泡,针对其上升速度进行计算研究,讨论各种因素对气泡上升速率的影响。

图1 气泡直径与其最终上升速率平方关系图Fig.1 Relationship between bubble diameter and the square of final escape rate (pentagon-NaCl、tetragonum-SnO2、roundness-Na2SO4)
通过线性拟合得到公式:y=0.9409x-0.56347,拟合度R2因子达0.98117,可说明各点数据存在相关性。由此可知无论哪种澄清剂,气泡上升速率的平方值与气泡直径的增长呈线性相关,这和前文推导出的式(4)相符。根据不同颜色点的分布可知,添加SnO2的气泡直径较大,上升较快,这与澄清剂所释放气体的分压与扩散有关。由图1可看出,有一些点距拟合直线较远,还有其他因素影响了其上升速率。根据实际情况分析,玻璃液的整体运动及所忽略的Basset力等可能是其影响因素。
4.2 气泡平均逸出速率
如图2所示,在视频图像内选择可完整观察其运动轨迹的15个气泡。观测在1200℃至1500℃升温期间(约1h)的气泡的逸出速率,分析三种澄清剂对气泡逸出的作用。统计每个气泡的逸出时间,测出其移动距离,计算平均逸出速率。
图3为不同澄清剂对气泡逸出速率的影响。图3(a)是SO2的影响,随着SnO2添加量的增加,气泡的平均逸出速率也随之增加;SnO2添加量由0.4%提高到0.5%时,气泡逸出速率增加趋于平缓。这是由于SnO2越多,发生反应时释放的氧气量增加,更多的氧气进入气泡中使气泡更易长大,根据第2.1节分析结果,气泡就更易逸出,但当SnO2含量增加到一定程度,玻璃的氧化性增高,SnO2的分解反应趋于缓慢。

图2 气泡选择示意图Fig.2 Illustration of bubbles selection
NaCl作为澄清剂的气泡逸出速率见图3(b)。随着NaCl添加量的增加,NaCl发生气化放出的气体越多,因此气泡更易长大,气泡的平均逸出速率增大。但从数据看增大的幅度较小。这可能是因为每次NaCl添加量的增加幅度仅为0.05wt%,挥发量增加较少,对气泡逸出速率影响较小。
气泡逸出速率随 Na2SO4添加量的关系如图3(c)所示。高铝硅酸盐玻璃的熔化温度在900~1440℃,Na2SO4的反应温度约为1200℃[9]。由添加Na2SO4的配料熔化澄清视频可知,在Na2SO4反应产生气体时,配合料的各种反应尚未结束,继续升温后,配合料之间仍会相互反应而释放出气体,而此时澄清剂已消耗完,所以气泡上升速率减慢,会有较多气泡残留。而SnO2和NaCl的作用温度均在1400℃以上,此时配合料基本反应已结束,SnO2和NaCl对气泡的长大逸出作用更为显著,残留气泡相对较少。

图3 三种澄清剂添加量对气泡平均逸出速率的影响(a:SnO2;b:NaCl;c:Na2SO4)Fig.3 Dosage of fining agent and average bubbles escape rate
4.3 玻璃液对气泡的吸收
在升温阶段,玻璃液中气泡的消除主要是靠气泡逸出,而在降温阶段,则要靠玻璃液对气泡的吸收来消除气泡。
在降温阶段,玻璃液中气泡的消除与表面张力引起的气泡内压的大小有关[10]。气泡内压越大,气泡越容易溶解于玻璃液中。

(6)
式中:P:气泡内压;Px:大气压;ρgh:玻璃液柱的静压;σ:表面张力;r:气泡半径。
通常情况下,大气压力不变,因此玻璃液柱高度不变。此时,表面张力成为影响气泡消除的重要因素。
选定气泡较为集中部分的图像进行观察。在视频中选定4个25*8mm的矩形框(如图4),保温过程结束10分钟后,统计每个方框内的气泡数,在60分钟的降温过程结束后,再一次统计每个方框内的气泡数(此过程中玻璃液的粘度随温度降低而增大,气泡无法逸出),计算出每个方框内的气泡吸收率平均值。三种澄清剂实验结果分别见表3、表4、表5。

图4 气泡吸收率统计区域示意图Fig.4 Illustration of bubbles absorption rate statistical area
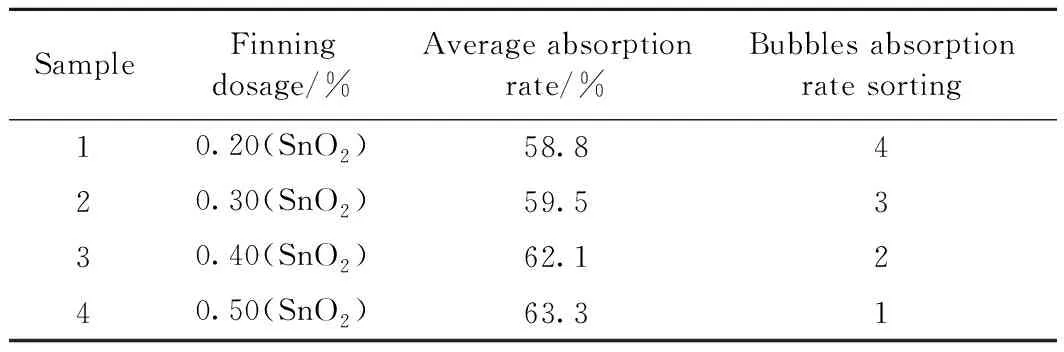
SampleFinning dosage/%Average absorption rate/%Bubbles absorption rate sorting10.20(SnO2)58.8420.30(SnO2)59.5330.40(SnO2)62.1240.50(SnO2)63.31

表4 NaCl澄清剂用量及气泡平均吸收率Table 4 Dosage of NaCl and average bubbles absorption rate

表5 Na2SO4澄清剂用量及气泡平均吸收率Table 5 Dosage of Na2SO4 and average bubbles absorption rate
进入降温阶段,澄清剂所产生的气体对于玻璃液中气泡逸出的加速作用已结束,促残留在玻璃液中的SnO、Cl-、SO2气体会对玻璃液的表面张力产生影响。
由表3可知,不添加任何澄清剂的样品气泡较多并且难以上升逸出,其气泡的消除主要依赖于玻璃液的吸收作用,在本组实验中平均吸收率最高的是添加SnO2的样品,玻璃液对气泡的吸收率随SnO2添加量的增加而上升。
SnO2在高温下发生反应时分解出SnO和O2,O2在玻璃液中的溶解度极低,含量几乎可以忽略不计。因此对气泡吸收率产生较大影响的是玻璃熔体中的SnO含量对表面张力的影响。
添加SnO2作为澄清剂,其对表面张力的影响关系,符合加和性法则,一般可用下式计算[10]:

(9)

由式(9)可知,随着SnO2含量的增加,玻璃液的表面张力增大,气泡吸收率也随之增大。
NaCl主要以自身挥发的形式起到对玻璃液澄清的作用,降温阶段玻璃液中的NaCl含量剩余不多,只有小部分残留在玻璃液和气泡中。NaCl中的氯离子对Si-O-Si键起到一定的破坏作用,在一定程度上减小了玻璃液的表面张力。由表4可知,随着NaCl含量的增加,氯离子对Si-O-Si键的破坏作用加剧,使表面张力减小,玻璃液对气泡吸收作用减弱。
Na2SO4分解时产生SO2气体,随着温度降低SO2在玻璃液中的溶解度逐渐增大。SO2有降低玻璃液表面张力的作用[10],由表5可知,随着Na2SO4加入量的增加,表面张力逐步减小,气泡吸收率也随之减小。
4.4 澄清作用机理
SnO2是氧化还原型澄清剂,在高温下发生如(10)所示的氧化还原反应,产生大量的氧气进入气泡内,此时,气泡中气体的主要成分是氧气,成分较为单一有利于气体的扩散,可使气泡更快地逸出。

(10)
NaCl是高温挥发型澄清剂,通过自身气化产生气体起到澄清作用。同时,由于氯离子的存在降低了玻璃液的表面张力,影响了玻璃液对气体的吸收。
Na2SO4是高温分解型澄清剂,在约1200℃下分解出SO2、SO3、O2等气体,导致气泡中气体种类较多,每种气体的分压下降,气体的扩散速率下降,影响气泡逸出速率。
5 结 论
玻璃的澄清是一个十分复杂的过程。各种气体在窑炉空间、气泡和玻璃液之间运动,澄清剂的加入影响了整个运动过程从而影响最终的澄清效果。
1.对于SnO2、NaCl和Na2SO4三种不同的澄清剂,气泡逸出速率均随澄清剂含量增加而增大,且以SnO2的促进作用最为明显。
2.澄清剂对气泡吸收率的影响会因其种类的差别有所不同,气泡吸收率随SnO2添加量的增加而增大。而添加NaCl和Na2SO4两种澄清剂时,吸收率随添加量增加而减小。
3.由于Na2SO4作用温度相比高铝硅酸盐玻璃澄清所需的温度低200℃左右,在铝硅酸玻璃澄清过程中,对气泡的上升、逸出作用不大,单靠吸收难以获得理想的澄清效果。
4.在本文选取的澄清剂用量范围内,0.50wt%的SnO2对高铝硅酸盐玻璃中气泡的上升逸出和吸收均有良好的作用,可作为高铝硅酸盐玻璃最佳的澄清剂。
