miR-219调控PRKCI表达在舌鳞状细胞癌中作用和机制
2019-01-02姜寰宇宋凯镔
王 蕾 姜寰宇 宋凯镔
舌癌是口腔癌中最常见的恶性肿瘤,80%以上的舌癌病理类型是舌鳞状细胞癌(Tongue squamous cell carcinoma,TSCC)。TSCC容易局部复发和发生淋巴结转移[1],预后较差,因此,研究TSCC的发生及转移机制对于TSCC的预防和治疗具有重要意义。
近年来研究表明,许多微小RNA(microRNA,miRNA)在TSCC中表达异常,与肿瘤细胞的增殖及凋亡密切相关[2-3],其中miR-219在TSCC的发生及发展中发挥了重要的抑癌基因作用。PRKCI基因与多种恶性肿瘤的发生发展有关,如食管鳞状细胞癌[4]、肺鳞状细胞癌[5-6]等。在TSCC中,miR-219与PRKCI基因是否存在相关性尚无研究报道。本文主要通过检测PRKCI在TSCC组织中的表达,探讨其与miR-219的相关性以及对TSCC细胞增殖、侵袭和转移的影响,明确其抑制肿瘤增殖的机制,为TSCC的预防与治疗提供新的线索。
1 材料与方法
1.1 组织标本、细胞系及转染
收集哈尔滨医科大学附属肿瘤医院(2010年1月—2013年12月)手术切除的26例TSCC组织标本及癌旁正常舌黏膜组织,迅速放置于-80℃液氮中保存。全部病例为经过两位独立的病理学专家确诊的初发TSCC患者,全身检查未发现远处肿瘤转移,术前和术后未施行放疗、化疗及生物治疗。本试验所有收集的TSCC组织样本及癌旁正常舌黏膜组织样本全部征得患者及家属同意,并签署生物标本二次利用知情同意书。
人TSCC细胞株(SCC-15和CAL-27)、HEK293细胞购自于美国细胞培养中心,HEK293细胞培养于DMEM。在培养基中添加10%胎牛血清(FBS)、50 U/mL青霉素和50 U/mL链霉素,细胞置于37℃、5%CO2培养箱中。采用脂质体Lipofectamine-2000进行转染试验。
1.2 RNA分离与qRT-PCR
用Trizol提取总RNA,采用PrimeScript®RT reagent Kit进行逆转录,采用miRNA特异性引物扩增miR-219。采用SYBR试剂在IQ5光学系统实时PCR机上进行qRT-PCR。β-actin和U6分别作为mRNA和miRNA的内参。采用2-ΔΔCt法定量计算,试验重复3次。
1.3 PRKCI 3′UTR荧光素酶报告基因的构建
设计引物合成PRKCI基因的荧光素酶报告基因载体,以突变序列载体作为对照,凝胶电泳后回收得到目的片段,与pmirGLO质粒载体连接后提取质粒。将连接产物转化、提取质粒、测序,得到质粒:PLG-3-WT-PRKCI-UTR和PLG-3-mut-PRKCI-UTR。
1.4 细胞增殖试验
将细胞置于96孔板中,3 000个细胞/孔,进行培养,并在37℃孵育,直至细胞达到30%~40%汇合。在转染后24 h、48 h和72 h,用MTT法检测细胞增殖。每孔加入20 μL(5 mg/mL)MTT溶液(Sigma,美国),在37℃孵育4 h,然后用150 μL二甲基亚砜置换上清液。于492 nm下检测各孔的吸光度值。
1.5 克隆形成试验
细胞转染后48 h按每孔2 000个细胞接种于12孔板,孵育14天后,乙醇固定15 min,0.1%结晶紫染色30 min,洗涤三次。显微镜下随机选取4个视野计数大于50个细胞的克隆数。
1.6 迁移和侵袭试验
细胞转染后48 h按1×105个/mL接种于不含血清培养基的Transwell上室,下室加500 μL完全培养基,常规培养24 h,用棉签擦上室内的细胞,0.1%结晶紫染色30 min,显微镜下随机选取4个视野进行细胞计数。侵袭试验与迁移试验的不同在于侵袭试验在Transwells上室多加一个Matrigel基质胶。
1.7 荧光素酶活性分析
应用脂质体Lipofectamine-2000对HEK-293细胞与miR-219及对照质粒(miR CTRL)和PRKCI共转染。转染24 h后,用双荧光素酶报告系统(PROMEGA,美国)检测细胞的荧光素酶活性。
1.8 Western blot试验
转染24 h后,细胞在RIPA缓冲液中裂解。蛋白质通过10% SDS-PAGE加载和分离,并转移到PVDF膜(MiLople,Bead Foad,MA,美国)。在4℃下,用第一抗体孵育膜,然后用HRP标记的二次抗体在37℃孵育2 h,ECL作为底物进行显色,用β-actin作为内参。
1.9 统计学处理
利用SPSS 19.0统计软件分析数据,每个标本独立重复三次,所有细胞实验独立重复三次,计量数据以均数±标准差表示,若满足正态性和方差齐性,两样本均数比较采用独立t检验和配对t检验,相关性分析采用Spearman秩相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-219过表达能够降低PRKCI野生型报告基因载体的荧光活性并抑制PRKCI的表达
图1A为预测的miR-219在野生型PRKCI 3′UTR上的结合位点以及突变型PRKCI上的突变位点。本研究显示,在含有突变型PRKCI 3′UTR的HEK293细胞中,pre-miR-219细胞组与对照组细胞的PRKCI报告基因载体的荧光活性相近。而含有野生型PRKCI 3′UTR的HEK293细胞中,pre-miR-219细胞组与对照组细胞相比荧光活性明显下降(图1B),说明miR-219基因能够下调PRKCI的表达(P<0.05)。通过PCR及Western blot检测到转染miR-219的SCC-15细胞中,miR-219可以抑制PRKCI的表达(图1C,图1D)。

图1 PRKCI是miR-219在TSCC细胞中的靶基因Figure 1 PRKCI is the target gene of miR-219 in TSCC cellsNote:A.The predicted miR-219 binding site within PRKCI 3′-UTR and its mutated type by site mutagenesis;B.After HEK293 cells were co-transfected with miR-219 or miR-ctrl with WT or MT PRKCI 3′-UTR,luciferase activity was examined;C.The expression of PRKCI mRNA was detected by qRT-PCR in SCC-15 cells transfected with miR-219 or miR-control;and D.The expression of PRKCI protein was detected by Western blotting in SCC-15 cells transfected with miR-219 or miR-control.
2.2 PRKCI过表达能够逆转miR-219过表达对TSCC细胞增殖及克隆能力的抑制效应
经转染PRKCI表达载体的SCC-15细胞,与对照组相比,PRKCI基因的表达量显著增加且明显高于未转染PRKCI表达载体的对照组细胞(图2A,2B)。
MTT法检测显示过表达miR-219能显著抑制SCC-15细胞的增殖能力。当miR-219细胞中同时转染PRKCI基因后,PRKCI的过表达逆转了miR-219对肿瘤的抑制增殖作用(P<0.05)(图2C)。克隆形成试验显示miR-219能显著抑制SCC-15细胞的克隆形成能力。共转染miR-219和PRKCI的SCC-15细胞的克隆形成能力比单独转染miR-219的SCC-15细胞强(P<0.05)。说明由于PRKCI的过表达,逆转了miR-219抑制肿瘤克隆形成能力的作用(图2D)。
2.3 PRKCI过表达能够逆转miR-219过表达对TSCC细胞迁移和侵袭的抑制效应
划痕实验及Transwell小室法结果显示,与对照组比较,SCC-15细胞中过表达miR-219能降低SCC-15细胞的迁移及侵袭能力。然而,当共转染miR-219和PRKCI后,SCC-15细胞的迁移能力比单独转染miR-219的SCC-15细胞降低了50%以上(P<0.01),SCC-15细胞的侵袭能力比单独转染miR-219的SCC-15细胞降低了50%以上(P<0.05)。说明由于PRKCI的过表达,逆转了miR-219抑制肿瘤迁移及侵袭能力的作用(图2E,图2F)。
2.4 miR-219与PRKCI在TSCC中的表达关系
通过实时荧光定量PCR法分析26例TSCC患者癌与癌旁正常组织中的PRKCI表达水平,我们发现,TSCC组织中PRKCI的表达水平显著增加(P<0.01)(图3A)。利用Spearman相关系数分析来观察TSCC细胞中PRKCI和miR-219的关系。随着miR-219表达升高,PRKCI的表达相应下调,PRKCI的表达量与miR-219的表达量呈负相关(r=-0.984,P<0.01)(图3B)。

图2 PRKCI逆转miR-219对舌鳞状细胞癌的抑制作用Figure 2 PRKCI overexpression reversed the inhibitory effect of miR-219 on tongue squamous cell carcinomaNote:A.The expression of PRKCI mRNA was detected by qRT-PCR in SCC-15 cells transfected with PRKCI plasmid;B.The expression of PRKCI protein was detected by Western blot in SCC-15 cells transfected with PRKCI plasmid;C.After SCC-15 cells were transfected with miR-219 with/without PRKCI overexpression plasmid,cell proliferation was examined by MTT assay;D.After SCC-15 cells were transfected with miR-219 with/without PRKCI overexpression plasmid,colony formation was examined by colony formation assay;E.After SCC-15 cells were transfected with miR-219 with/without PRKCI overexpression plasmid,cell migration was examined by migration assay;and F.After SCC-15 cells were transfected with miR-219 with/without PRKCI overexpression plasmid,cell invasion was examined by invasion assay.Data were presented as means ±SE from three independent experiments.**P<0.001 compared with the control group.
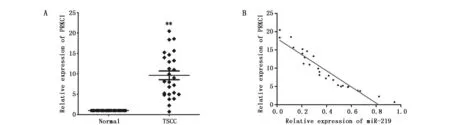
图3 在TSCC中miR-219与PRKCI的表达负相关Figure 3 The negative relationship between miR-219 and PRKCI in TSCC tissuesNote:A.The expression of PRKCI in 26 pairs of TSCC tissues was measured by qRT-PCR;B.The relationship between the expression of miR-219 expression and PRKCI mRNA levels in TSCC tissues were analyzed by Spearman′s analysis.
3 讨论
本研究利用TargetScan生物信息学分析软件对miR-219的下游靶基因进行预测,获得的靶基因为PRKCI。PRKCI是编码aPKC的基因,它与多种类型肿瘤细胞的生长、迁移、耐药性及存活率有关[9-10],Campa等[11]研究推测某些等位变异可以改变PRKCI基因的表达,Yang等[12]用荧光原位杂交的方法检测发现在肿瘤增殖、生长、淋巴结转移及发病过程中,PRKCI基因发挥了积极的作用,这些结果与食管鳞状细胞癌免疫组织化学分析的结果是一致的。PRKCI的表达也预示临床疗效不佳,以及PRKCI诱导的肺鳞状细胞癌的体内外转移和生长[13-17]。近期,Regala等[18]进一步发现早期肺鳞状细胞癌能调控PRKCI基因、SOX2和HHAT基因的过表达,并且能通过细胞自治Hh信号轴来调控PRKCI-SOX2-HHAT通路促使肿瘤的形成。
本研究的荧光素酶报告基因实验中我们发现在TSCC细胞中,miR-219的过表达能够降低PRKCI野生型报告基因载体的荧光活性,qRT-PCR实验和Western blot实验还分别表明miR-219能够抑制TSCC细胞中PRKCI的mRNA的表达以及PRKCI蛋白的表达,证明PRKCI基因是miR-219的靶基因。
为进一步研究TSCC细胞中PRKCI基因与miR-219的相互关系,我们构建了PRKCI基因的过表达载体,将miR-219基因分别转染含PRKCI基因和无义序列对照基因的SCC-15细胞,通过MTT实验、克隆形成实验、细胞迁移和侵袭实验都说明PRKCI能够显著逆转miR-219对TSCC细胞的增殖及发展的抑制作用。Spearman相关性分析证明,在TSCC中,PRKCI基因与miR-219的表达呈负相关。这些结果表明PRKCI基因的过表达可能与TSCC的发生及发展有关。
综上所述,本研究证实了PRKCI是miR-219的下游靶基因,miR-219是通过直接调控PRKCI的表达来实现对舌鳞状细胞癌的抑制作用的。在舌鳞状细胞癌组织中,两者的表达呈明显的负相关。这些结果将为针对舌鳞状细胞癌的miRNAs及其靶基因的药物研究提供新的线索。但是肿瘤基因调控的复杂性不仅仅在于一条通路线性表达的变化,而是网络表达的变化,日后应深入研究miR-219、PRKCI与其他基因调控网络在TSCC细胞中的关系,并且需要更多的临床实验探讨miR-219与PRKCI的表达变化对舌癌患者预后的影响。
