UHRF1通过调控细胞自噬抑制肺腺癌细胞增殖的分子机制研究
2019-01-02卞秀森关欣宇
卞秀森 李 光 关欣宇 张 伊 狄 畅 马 璨
肺腺癌(Lung adenocarcinoma)是非小细胞肺癌的一个病理亚型,其具有发病年龄低,高发于女性患者,严重威胁着人类的健康[1-2]。虽然随着科学技术的不断进步,肺腺癌的治疗方法已经有了很大更新和进步,但肺腺癌患者5年生存率仍然很低。因此探寻新的针对于肺腺癌预防、诊断、治疗新的生物学标记物成为了广大呼吸科以及胸外科的重要着眼点。目前许多研究表明一些基因能够在肺腺癌发生和发展中起关键的调节作用[3-4],但是具有更强功能的基因在肺腺癌的发生、发展中的生物学作用和机制仍需要深入的探讨。泛素样含PHD和环指结构域1(UHRF1)是一种参与DNA甲基化的调控基因[5]。在UHRF1基因丧失功能时,发现其能够导致细胞DNA甲基化失活[6]。UHRF1的特点是广泛表达,是DNA功能的重要调节因子[7]。以往的研究已经证实,UHRF1通过DNA修复对于细胞产生保护作用,进而抗凋亡。最近越来越多的研究发现UHRF1在胶质母细胞瘤、黑色素瘤、乳腺癌和其他肿瘤中发挥细胞周期调控的作用;表明UHRF1在肿瘤发生中起着重要的作用[8-9]。然而UHRF1在肺腺癌中的作用及其潜在的机制鲜有报道,有待进一步研究。
1 材料与方法
1.1 UHRF1基因数据
本研究通过http://ualcan.path.uab.edu/index.html网站获取了TCGA数据库中UHRF1基因在肺腺癌患者的恶性肿瘤组织、癌旁组织中的表达,及UHRF1对于肺腺癌患者生存率的影响。
1.2 细胞培养
人肺腺癌细胞系A549、PC-9和H1299培养于含有10%胎牛血清以及100 U/mL青霉素和100 g/mL链霉素的DMEM培养基中。人支气管上皮细胞16HBE培养于含有10%胎牛血清的RPMI1640培养基中。细胞的培养于含有5% CO2的37℃恒温孵箱中。细胞密度达到75%~85%左右进行传代。
1.3 细胞转染
使用UHRF1敲减试剂盒(stQ0010935-1)转染细胞,其序列为:siRNA UHRF1:5′-GCGCUGGCUCUCAACUGCU-3′,5′-AGCAGUUGAGCCAGCGC-3′;通过脂质体3 000将含有20 nMUHRF1-siRNA以及Control-siRNA转染到A549细胞中,培养5 h后,弃去无血清培养基,加入含10%胎牛血清的DMEM培养基继续培养48 h。
1.4 CCK-8细胞活性检测
将UHRF1-siRNA以及其阴性对照转染到A549(2×103)细胞中48 h后,按照CCK-8说明书进行操作,采用细胞计数试剂盒计算A549细胞存活率。细胞活力的百分比=(实验组吸光度/对照组吸光度)×100%。
1.5 克隆形成
将8×102A549细胞培养于6 cm培养皿中14天后。弃去培养基,并用PBS漂洗。用20%甲醇固定,用1%结晶紫染色。低倍镜下,统计超过50个细胞组成的菌落计数为单个菌落。
1.6 Ki-67免疫荧光
A549细胞接种于铺有无菌盖玻片的6孔板中,分别转染UHRF1-siRNA以及Control-siRNA 48 h后。将Ki-67抗体孵育1 h后,加入荧光显色剂Alexa-488在室温孵育20 min。然后,用DIPA染细胞核。通过免疫荧光显微镜进行拍摄。
1.7 RNA提取和实时定量PCR
采用Trizol试剂提取总RNA,利用Superscriptase II逆转录试剂盒逆转录成cDNA,实时定量PCR法检测UHRF1 mRNA水平。实时定量PCR采用SYBR Green PCR Master Mix试剂盒,采用ABI7500实时定量PCR仪,PCR扩增条件为:95℃变性30 s,60℃退火30 s,72℃延伸35 s,共30个循环。以下引物用于实时荧光定量PCR检测:UHRF1-F:5′-ACAACGTGGCAAGGACTGC-3′;UHRF1-R:5′-GAGCTGGTTGAGGACGGTCT-3′;GAPDH-F:5′-CCTGCACCACCAACTGCTTA-3′;GAPDH-R:5′-GGCCATCCACAGTCTTCTGG-3′。
1.8 抗体和蛋白免疫印迹
利用含蛋白酶抑制剂和RIPA裂解液裂解细胞,4℃,13 500转/分钟离心12 min并收上清。利用BCA法进行蛋白定量。通过10%~12% SDS-PAGE进行分离等量蛋白质并转移到硝酸纤维素膜上。室温5%脱脂牛奶封闭后1~1.5 h后,分别与一抗β-actin(1∶2000),PCNA(1∶1000)、Rb(1∶1000)、UHRF1(1∶1000),CDK6(1∶1000)以及Rb(1∶1000)孵育4℃过夜。PBST洗涤3次后。红外荧光标记的二级抗体孵育1 h。使用红外成像系统检测蛋白印迹带,并使用Odyssey 3.0软件对条带灰度值进行定量。每组条带β-actin作为内参。
1.9 透射电镜观察自噬小体
将UHRF1-siRNA或Control-siRNA转染48 h后,弃去培养基,用PBS冲洗3遍。用0.25%胰酶消化A549细胞,室温3 000转/分钟离心10 min收集细胞。加入4%戊二醛4℃固定。样品送哈尔滨工业大学电镜实验中心进行检测。
1.10 统计分析
使用SPSS 19.0软件分析数据,使用GraphPad Prism 5.0软件绘图,实验数据以均数±标准差表示。两组间比较通过Student′st检验,多组间比较使用方差分析(ANOVA)和Tukey′s方法进行多重比较,肺腺癌患者生存期通过Log-rank检验进行数据分析,P<0.05为差异具有统计学意义。
2 结果
2.1 UHRF1在肺腺癌组织以及细胞中的表达及与患者生存率的关系
UHRF1基因在TCGA数据库的肺腺癌与癌旁数据样本中的结果显示,腺癌组织中UHRF1的表达要显著高于癌旁组织(P=0.0042)(图1A)。且高表达UHRF1组的肺腺癌患者生存期较低(P=0.027)(图1B)。通过免疫蛋白印记以及实时定量PCR的方法检测了UHRF1在A549、PC-9以及H1299中的表达,结果显示,UHRF1在A549、PC-9以及H1299的表达相对于16HBE明显升高(P<0.05),且A549中表达更为明显(图1C-D),因此在后续的实验中我们主要探讨UHRF1在A549为代表的肺腺癌细胞系中的作用。

图1 UHRF1在肺腺癌组织中以及细胞系中的表达Figure 1 The expression of UHRF1 in lung adenocarcinoma tissues and cell linesNote:A.UHRF1 was significantly increased in lung adenocarcinoma tissues in comparison with the normal tissues;B.The survival curves of UHRF1 in lung adenocarcinoma patients;C.UHRF1 at the mRNA level was increased in lung adenocarcinoma tissues;D.UHRF1 at the protein level was increased in lung adenocarcinoma cell lines.
2.2 沉默UHRF1抑制A549细胞增殖
为进一步研究UHRF1对于A549细胞增殖能力的影响。首先通过免疫蛋白印记以及实时定量PCR的方法检测UHRF1的转染效率(图2A-B)。我们发现相对于对照组,UHRF1-siRNA组中UHRF1的表达明显降低。为了进一步验证UHRF1对A549细胞活性的影响,CCK-8以及克隆形成的结果表明(图2C-D),低表达UHRF1能够使A549细胞活性降低,同时克隆形成的结果也证明了相同的结果。此外,我们验证了UHRF1对于A549细胞增殖能力的影响,Ki-67结果显示,低表达UHRF1能够抑制A549细胞的增殖(图2E)。随后我们通过Western blot方法检测细胞增殖相关蛋白PCNA、CDK6以及Rb的变化,我们发现,低表达UHRF1能够使PCNA、CDK6蛋白表达相对于其阴性对照组明显降低,而Rb蛋白相对于对照组表达升高(图2F)。因此,我们的研究结果表明,低表达UHRF1能够在体外抑制肺腺癌A549细胞的增殖。
2.3 UHRF1介导自噬调控A549增殖
自噬是一种细胞本身的代谢需要和某些细胞器的更新的病理生理过程。为了进一步验证UHRF1对于A549细胞增殖。我们首先检测了自噬相关蛋白LC3-I、LC3-II以及Beclin-1的变化,同时采用透射电镜观察了低表达UHRF1对于A549细胞中自噬小体的变化。我们的结果显示相对于对照组,低表达UHRF1能够上调LC3-II/LC3-I的比率(图3A)。同时我们也发现,沉默UHRF1能够上调Beclin-1蛋白的表达(图3B)。而透射电镜显示,相对于对照组,UHRF1-siRNA组中自噬小体的数量明显增加(图3C)。
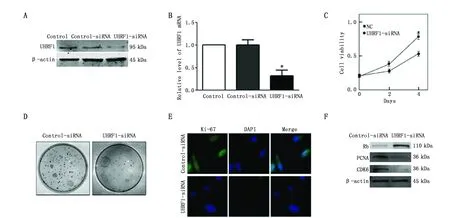
图2 沉默UHRF1抑制A549细胞增殖Figure 2 Silencing UHRF1 inhibited proliferation of A549 cellsNote:A and B.Transfection efficiency of UHRF1-siRNA;C.Knockdown UHRF1 decreased the viability of A549 cells;D.Knockdown UHRF1 decreased capability of colony formation in A549 cells;E.Ki-67 immunofluoresecence staining showed that silencing UHRF1 decreased the proliferative ability of A549 cells;F.The levels of Rb,PCNA and CDK6 proteins after transfect with UHRF1-siRNA or control-siRNA in A549cells.*P< 0.05 vs. control-siRNA or NC.
3 讨论
UHRF1是一种包含多个功能域的模块化蛋白质[10]。在DNA复制过程中,集合和环指结构域在DNA甲基化中起着至关重要的作用。大量的文献证明了UHRF1广泛参与到了癌症的病理、生理学过程。在本研究结果中,我们发现UHRF1基因在肺腺癌组织中的表达上调,证明UHRF1参与到了肺腺癌的病理过程。
越来越多的证据表明,UHRF1通过表观遗传机制调节基因表达,包括DNA甲基化、组蛋白甲基化、组蛋白去乙酰化和可能组蛋白泛素化[11-12]。以前的研究表明,过表达UHRF1能够使斑马鱼DNMT1去稳定,导致DNA甲基化[12]。此外,过表达UHFR1诱导了DNA的低甲基化,导致斑马鱼的肝细胞癌的发生[7]。在我们的研究中,敲除UHRF1能够明显抑制A549细胞活力,抑制A549细胞的增殖能力。但沉默UHRF1后是怎样抑制A549细胞的增殖的作用的,以及其他潜在的分子机制将在我们后续的实验中陆续展开。
目前已有研究证实,UHRF1基因能够调节细胞自噬[13]。而自噬是一种在细胞增殖过程中发挥重要功能的因子[14-15]。本实验结果表明,在UHRF1低表达组中,能发现自噬小体数量明显增多。而Beclin-1和LC3是自噬发生过程中的重要蛋白,其自噬发生的初级阶段诱导自噬小体的形成。此外,UHRF1低表达组中,LC3-II/LC3-I的比率明显升高,而Beclin-1蛋白表达也升高。由此我们推测,沉默UHRF1抑制A549细胞增殖是通过自噬产生的。
综上所述,本研究结果显示UHRF1是通过调节自噬进而影响肺腺癌细胞系A549增殖的。本研究结果为UHRF1成为潜在治疗肺腺癌的生物学标记物提供了实验依据。
