紫云英苷通过抑制HIF-1α诱导的糖酵解途径发挥抗卵巢肿细胞作用的研究
2019-01-02宋玲付琼
宋 玲 付 琼
卵巢癌是妇科常见肿瘤,其诊断时多为晚期,是死亡率最高的妇科恶性肿瘤[1-3]。手术和化疗是卵巢癌最常用的治疗方法,近年来,化疗耐药成为困扰卵巢癌治疗的重要问题,因此,发现新的抗肿瘤药物具有重要的临床意义。正常细胞主要通过线粒体氧化磷酸化产生能量,然而,大多数癌细胞,尤其是实体肿瘤,即使在氧含量正常的条件下,也主要通过高速糖酵解产生能量,然后在富含氧的情况下进行乳酸发酵,这被称为Warburg效应[4-6]。与传统的2 D细胞培养相比,3 D细胞肿瘤微球培养可更好的模拟实体肿瘤缺氧等条件,是肿瘤药物临床前评估较好的细胞模型[7]。紫云英苷是一种广泛存在于食品成分中的天然黄酮类物质,具有抗炎、抗氧化作用[8-10]。此外,紫云英苷被证实对体外培养的不同类型肝癌及肺癌细胞具有增殖抑制作用[11-13],而对卵巢癌的研究未见相关报道。本研究通过体外细胞水平实验检测紫云英苷对人卵巢癌细胞的作用及其分子机制,为抗卵巢癌新药发现提供新的思路。
1 材料与方法
1.1 主要试剂和设备
紫云英苷(Astragaline)购于美国Sigma公司(79851,HPLC纯度≥97%);RPMI1640培养基(11875093)、磷酸盐缓冲液(PBS,14190144)、胎牛血清(FBS,10099141)购于美国ThermoFisher科技有限公司;RAPI裂解液(P0013B)、CCK-8试剂盒(C0038)和BCA试剂盒(P0012)购于中国碧云天生物技术有限公司;抗β-actin(20536-1-AP)、Glut1(21829-1-AP)、Glut3(20403-1-AP)、HK2(22029-1-AP)、PDK1(10026-1-AP)、PDK3(12215-1-AP)、Bcl2(12789-1-AP)、Bax(50599-2-Ig)和HIF-1α(20960-1-AP)一抗购自Proteintech公司;cleaved-caspase-3(9664T)一抗购自美国CST公司;荧光二抗(C40109-04)购于美国LI-COR公司;3 D细胞增殖活性检测试剂盒(CellTiter-Glo®3D cell viability assay,G9683)购自美国Promega公司;HK2 Elisa试剂盒购自上海江莱生物有限公司。
1.2 实验方法
1.2.1 细胞培养 人卵巢癌OVCAR-8细胞培养于RPMI 1640培养基(含10%FBS、青霉素100 U/mL和链霉素100 μg/mL)中,置于5%CO2、37℃恒温培养箱中培养。
1.2.2 2 D水平培养细胞增殖活力检测 OVCAR-8细胞以3×103细胞/孔接种于96孔板,贴壁24 h后更换含不同浓度紫云英苷的培养基100 μL。药物浓度分别为0(对照组)、4、11、33和100 μmol/L,分别于24、48、72 h更换CCK-8检测试剂100 μL(90 μL RMPI 1640培养基 + 10 μL CCK-8液),于5%CO2、37℃培养箱中孵育4 h,用酶标仪在450 nm波长检测各孔的吸光度值(A)。实验重复3次。计算细胞增殖活力:细胞活力(%)=(实验组平均A值/对照组平均A值)× 100%。
1.2.3 3 D水平培养细胞增殖活力检测 OVCAR-8细胞以每孔3×103细胞接种于每孔含5 μL胶原蛋白的超低粘附96孔板,设置紫云英苷处理组和对照组,每组设置两组复孔,每组5个复孔,72 h后采用倒置显微镜拍照记录,并采用3 D细胞增殖活性检测试剂盒检测处理组和对照组中各自一组复孔肿瘤微球荧光强度(Luminescence);后于处理组剩余组复孔加入紫云英苷(33 μmol/L),对照组加入等量培养基为对照,以加入紫云英苷处理时为0 h;处理48 h后再次拍照记录,并采用3 D细胞增殖活性检测试剂盒检测各组复孔肿瘤微球荧光强度;计算各组相对0 μmol/L-0 h时的相对荧光强度即为细胞增殖活力;相对荧光强度=(紫云英苷组各时间点或对照组48 h时荧光强度值-检测试剂本身荧光强度值)/(对照组0 h时荧光强度-检测试剂本身荧光强度值)。
1.2.4 划痕实验 OVCAR-8细胞以每孔2×105细胞接种于六孔板,待细胞长至完全融合后采用无菌200 μL枪头在中央划痕,PBS冲洗后采用倒置显微镜拍照;更换培养基后用11 μmol/L紫云英苷处理24 h,再次使用显微镜拍照,以0 μmol/为对照,以划痕宽度变化反应细胞迁移能力。
1.2.5 Western blot 以0 μmol/L组为对照组,采用11和33 μmol/L紫云英苷处理OVCAR-8细胞或3 D肿瘤微球48 h后使用RIPA裂解液提取细胞总蛋白,并使用BCA法测定各组细胞蛋白样品浓度。电泳以每孔30 μg总蛋白量,通过10%凝胶(SDS-PAGE)电泳后电转印至PVDF膜;随后3%脱脂奶粉室温封闭1 h,一抗4℃孵育过夜;于3次TBST洗膜(5 min/次)后加入荧光二抗(室温孵育1 h);3次TBST洗膜(5 min/次)后于Odyssey扫描成像仪收集荧光信号。以β-actin为内参照,通过QuantityOne-v4.6.2软件对Western条带进行灰度值测定进行定量分析。
1.2.6 细胞凋亡检测 以0 μmol/L组为对照组,采用11和33 μmol/L紫云英苷处理OVCAR-8细胞48 h后消化收集细胞,采用Annexin V-FITC/PI 双染细胞凋亡检测试剂盒孵育细胞后通过流式细胞仪检测细胞凋亡水平。结果采用FlowJo 7.6进行分析。
1.2.7 HK2活性检测 以0 μmol/L组为对照组,采用11和33 μmol/L紫云英苷处理OVCAR-8细胞48 h后提取细胞总蛋白,采用BCA法检测总蛋白浓度。设置空白对照组及0,11和33 μmol/L组,每组5个复孔。每孔加入样品稀释液40 μL及待测样品10 μL,封板后37℃孵育30 min;打开封板膜,弃去液体,甩干,每孔加满洗涤液静置30 s,并重复洗涤5次。后每孔加入酶标试剂50 μL,空白孔除外,37℃孵育30 min后按上述步骤洗涤5次。每孔加入显色剂A 50 μL,再加入显色剂B 50 μL,37℃避光显色15 min后加入终止液50 μL。采用酶标仪(PerkinElmer Victor3 1420 Multilabel Counter)检测450 nm OD值。以对照组为100%计算各组HK2活性值。
1.3 统计学方法
应用SPSS 21.0进行统计学处理,计量资料以均数±标准差表示;不同时间点、不同药物浓度处理后的细胞增殖活性、微球直径以及迁移能力比较采用重复测量的双因素方差分析;相同处理时间不同药物浓度组之间蛋白表达比较采用单因素方差分析,多组间两两比较采用Tukey法;2 D培养与3 D培养条件下药物浓度均为0 μmol/L时蛋白表达比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 紫云英苷在2 D及3 D细胞培养水平对OVCAR-8细胞增殖活力的作用
与0 μmol/L对照组相比,采用4、11、33和100 μmol/L紫云英苷处理卵巢癌OVCAR-8细胞24、48和72 h后,细胞活力明显下降,增殖受到明显抑制,且呈一定剂量-时间依赖效应关系,差异均有统计学意义(P<0.05)(图1A)。此外,为进一步验证紫云英苷对OVCAR-8细胞增殖的抑制作用,我们使用紫云英苷处理OVCAR-8细胞肿瘤微球,结果显示,与对照组相比,33 μmol/L的紫云英苷在3 D培养水平可明显抑制OVCAR-8细胞的增殖活力(图1B-C)。

图1 紫云英苷对OVCAR-8细胞增殖活力的影响Figure 1 Effect of astragalin on proliferation of OVCAR-8 cellsNote:A.2 D cell culture conditions;aP<0.05,when compared to the negative control group;bP<0.05,when compared to the 4 μmol/L of astragalin group;cP<0.05,when compared to the 11 μmol/L of astragalin group;dP<0.05,when compared to the 33 μmol/L of astragalin group;eP<0.05,when compared to the 48 h group;(B-C).3 D cell culture conditions.*P<0.05,when compared to the 0 h group;# P<0.05,when compared to the negative control group.
2.2 紫云英苷在2 D细胞培养水平对OVCAR-8细胞迁移能力的作用
为进一步验证紫云英苷对OVCAR-8细胞的抑制作用,我们使用划痕实验检测紫云英苷对OVCAR-8细胞迁移的作用,结果显示,与0 μM对照组相比,11 μmol/L的紫云英苷在2 D培养水平可明显抑制OVCAR-8细胞的迁移能力(图2)。
2.3 紫云英苷在2 D及3 D细胞培养水平对OVCAR-8细胞凋亡及相关蛋白表达的影响
在2 D培养水平,紫云英苷处理后细胞凋亡水平明显增高,且可减少抗凋亡蛋白Bcl2的表达,并增加促凋亡蛋白Bax及cleaved-caspase-3的水平(P<0.05),且呈一定的剂量依赖效应关系(图3A-B)。与此相似,在3 D培养水平,紫云英苷可明显减少抗凋亡蛋白Bcl2的表达,并增加促凋亡蛋白Bax及cleaved-caspase-3的水平(P<0.05),且呈一定的剂量依赖效应关系(图3C)。
2.4 紫云英苷在2 D及3 D细胞培养水平对OVCAR-8细胞糖酵解相关蛋白表达及活性的影响
在2 D培养水平,紫云英苷可明显抑制糖酵解相关蛋白Glut1、Glut3、HK2、PDK1和PDK3的表达(P<0.05)(图4A)。与此相似,在3 D细胞培养水平,紫云英苷可明显降低糖酵解相关蛋白Glut1、Glut3、HK2、PDK1和PDK3的表达(P<0.05),且均呈一定剂量依赖效应关系(图4B)。此外,紫云英苷可明显降低HK2活性,并呈一定剂量依赖效应关系(图4C)。

图2 在2 D细胞培养水平紫云英苷对OVCAR-8细胞迁移能力的影响Figure 2 Effect of Astragaline on migration of OVCAR-8 cells in 2 D cultureNote:*P<0.05,when compared to 0 h group;#P<0.05,when compared to 0 μmol/L group;Scale bar is 200 μm.
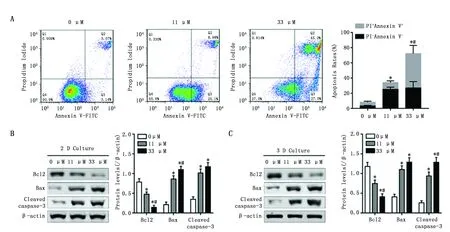
图3 在2 D及3 D细胞培养水平紫云英苷对OVCAR-8细胞凋亡及相关蛋白表达的影响Figure 3 Effect of astragalin on apoptosis and its related protein expression in OVCAR-8 cells both in 2 D and 3 D culture conditionsNote:A.Effect of astragalin on apoptosis of OVCAR-8 cells in 2 D culture conditions;B.Effect of astragalin on the expression of Bcl2,Bax and cleaved-caspase-3 in OVCAR-8 cells in 2 D culture conditions;C.Effect of astragalin on the expression of Bcl2,Bax and cleaved-caspase-3 in OVCAR-8 cells in 3 D culture conditions.*P<0.05,when compared to the negative control group;#P<0.05,when compared to the 11 μmol/L of astragalin group.
2.5 紫云英苷可抑制3 D细胞培养引起的HIF-1α表达
3 D细胞培养是肿瘤细胞缺氧较好的研究模型,而缺氧诱导因子HIF-1α是糖酵解通路及Warburg效应重要调节因子,在无紫云英苷作用时,3 D细胞培养条件HIF-1α蛋白表达较2 D培养明显升高,而紫云英苷作用可明显减少HIF-1α蛋白表达,且呈现一定的剂量依赖效应关系(图5)。

图4 在2 D及3 D细胞培养水平紫云英苷对OVCAR-8细胞糖酵解相关蛋白表达的影响Figure 4 Effect of astragalin on glycolysis related protein expressions in OVCAR-8 cells both in 2 D and 3 D culture conditionsNote:A.Effect of astragaline on glycolysis related protein in OVCAR-8 cells under 2 D culture;B.Effect of astragaline on glycolysis related protein in OVCAR-8 cells under 3 D culture;C.Effect of astragaline on HK2 activity in OVCAR-8 cells under 2 D culture.*P<0.05,when compared to the 0 μmol/L group;#P<0.05,when compared to the 11 μmol/L group.

图5 紫云英苷对OVCAR-8细胞3 D培养诱导的HIF-1α蛋白表达的作用Figure 5 Effect of astragaline under 3 D culture on induction of HIF-1α in OVCAR-8 cellsNote:The concentration of astragaline was 0 μmol/L in 2 D culture is 0 μmol/L;aP<0.05,when compared to 0 μmol/L group in 3 D culture;bP<0.05,when compared to 4 μmol/L group in 3 D culture;cP<0.05,when compared to 11 μmol/L group in 3 D culture;In the comparations between different groups of 3 D culture,F=66.04,P<0.0001;In the comparation between 0 μmol/L group in 2 D and 3 D culture,t=14.34,P=0.0001.
3 讨论
Warburg效应理论认为,即使在氧含量充足的情况下,肿瘤细胞通常表现出以糖酵解为主的能量代谢,称为有氧糖酵解[4-6,14-16]。这种由于线粒体功能障碍、缺氧和致癌信号等导致的代谢变化使得恶性肿瘤细胞在缺氧等恶性环境中也具有较好的增殖活性和生成能力。此外,由于增加糖酵解而引起乳酸积累相关的酸性肿瘤微环境为选择具有高生存能力和恶性行为的癌细胞提供了组织环境[15-17]。这些肿瘤生物学改变和微环境改变为癌症治疗带来巨大挑战。因此研发具有糖酵解抑制作用的抗肿瘤药物对卵巢癌等恶性肿瘤的防治具有重要临床意义。葡萄糖通过葡萄糖转运体(Glucose transporter,Glut)转运进入细胞后通过己糖激酶(Hexokinase)等一系列酶的作用转化为丙酮酸,丙酮酸可进入线粒体通过三羧酸循环生成乙酰辅酶A并释放较多的三磷酸腺苷(Adenosine triphosphate,ATP),而丙酮酸脱氢酶激酶(Pyruvate dehydrogenase kinase,PDK)可抑制丙酮酸进入三羧酸循环而促进其通过糖酵解途径生成乳酸及较少的ATP,从而较少由氧化磷酸化带来的活性氧簇累积以及提高代谢速率,从而使肿瘤细胞适应缺氧等恶性肿瘤微环境,促进肿瘤的增殖和转移[18-20]。
紫云英苷是存在于多种食物中的一种天然黄酮类物质,有研究表明紫云英甘对肝癌及肺癌细胞具有增殖抑制作用,且可抑制肝癌细胞HK2的表达[11],因此我们猜测,紫云英苷可能通过抑制糖酵解发挥抗肿瘤作用。3 D肿瘤细胞培养因其能更好的模拟实体肿瘤缺氧微环境,是评估抗肿瘤药物效果较好的细胞模型。因此我们通过评估在2 D及3 D培养条件下紫云英苷对卵巢癌OVCAR-8细胞增殖的作用,确认紫云英苷在2 D及3 D培养条件下对卵巢癌OVCAR-8细胞增殖均具有较好的抑制作用。同时,紫云英苷在2 D及3 D培养条件下均可抑制抗凋亡蛋白Bcl2的表达,并促进促凋亡蛋白Bax的表达及caspase-3的活化。与我们的结果相似,Chen等的结果证实,紫云英苷可促进多种肺癌细胞caspase-3,-8,-9及PARP的活化促进肺癌细胞凋亡[12]。为进一步确定紫云英苷抗肿瘤的机制,我们采用Western blot方法检测了紫云英苷处理后OVCAR-8细胞葡萄糖转运体Glut1和Glut3、己糖激酶HK2以及丙酮酸脱氢酶激酶PDK1和PDK3的蛋白表达变化,结果证实,紫云英苷可显著降低卵巢癌OVCAR-8细胞上述糖酵解相关蛋白的表达。同时,为进一步证实紫云英苷对糖酵解途径的抑制作用,我们检测了3 D肿瘤细胞培养条件下紫云英苷对糖酵解相关蛋白的作用,结果表明,紫云英苷可明显抑制卵巢癌OVCAR-8肿瘤微球糖酵解相关蛋白Glut1、Glut3、HK2、PDK1和PDK3的表达。这些结果表明,紫云应该可能通过抑制糖酵解抗肿瘤作用。而缺氧诱导因子HIF-1α是糖酵解途径的重要调节因子,可通过抑制三羧酸循环并促进糖酵解途径从而促进肿瘤细胞对缺氧环境的耐受性。在我们的研究中,与2 D细胞培养相比,3 D细胞培养可使HIF-1α表达明显增多,而紫云英苷处理可显著降低3 D细胞培养诱导的HIF-1α表达。此外,有研究证实,紫云英苷可抑制肺癌细胞ERK、Akt及NF-κB等信号通路[12],而这些通过都是HIF-1α下游调控通路。因此,我们推测,紫云英苷可能通过抑制HIF-1α诱导的糖酵解途径及其他多条信号通路发挥抗卵巢癌细胞的作用。
综上所述,紫云英苷是一种具有潜在抗人卵巢癌作用的活性成分,可通过抑制HIF-1α诱导的糖酵解等通路来抑制卵巢癌细胞的增殖、促进卵巢癌细胞的凋亡,为抗卵巢癌新药的研发提供重要依据和参考。
