micro RNAs调控肿瘤有氧糖酵解的研究进展
2021-05-13王婷潘雨佳刘乃华张覃宇金家民
王婷,潘雨佳,刘乃华,张覃宇,金家民
(桂林医学院,广西 桂林 541199)
0 引言
肿瘤作为致死率最高的疾病,与正常细胞不同,其特征表现为增殖快速,细胞能量代谢异常。1924年德国科学家Warburg发现即使在有氧条件下,癌细胞也倾向于通过糖酵解,而非氧化磷酸化(oxidativephosphorylation,OXPHOS)途径,来产生更多能量,从而满足自身旺盛的代谢需求,这种现象称为有氧糖酵解或“Warburg效应”。在糖酵解过程中,一些关键限速酶负责将葡萄糖转化为乳酸,其中成员包括葡萄糖转运蛋白1(glucose transporters1,GLUT1)、己糖激酶2(hexokinase 2,HK2)、磷酸果糖激酶(Phosphofructokinase,PFK)、乳酸脱氢酶A(lactate dehydrogenase,LDHA)和丙酮酸脱氢酶(Pyruvatedehydrogenasekinase,PDK)等[1]。随着细胞代谢过程中葡萄糖摄取和糖酵解速率的增加,这些关键酶在许多癌症中表达水平升高。
miRNAs是一类长度在20-25个核苷酸、具有调控功能的保守的非编码单链RNA。其常见作用方式一般为3种:①翻译抑制:在哺乳动物中,通过碱基互补配对的方式,与靶基因的 mRNA 不完全互补结合,在蛋白质翻译水平抑制靶基因表达;②促进mRNA降解:与靶基因的 mRNA完全互补结合,切割靶基因mRNA,引起降解;③促进靶基因的 mRNA表达[2]。因此miRNAs具有在转录后水平调控蛋白质编码基因表达的能力。报道显示,miRNAs参与肿瘤细胞有氧糖酵解过程[3]。本文就miRNAs在肿瘤细胞有氧糖酵解过程中的调控方式作简要论述。
1 miRNAs调控有氧糖酵解关键酶
癌细胞旺盛的生长和增殖,会导致线粒体功能受到抑制,环境中的氧气减少,缺氧诱导因子HIF-1表达增多,引起糖代谢从氧化磷酸化向无氧糖酵解过渡,导致Warburg过程中代谢酶表达增加。首先,葡萄糖转运蛋白(GLUT)负责将葡萄糖转运入细胞内;之后在己糖激酶(HK)、6-磷酸果糖-激酶-1(PFK-1)和丙酮酸激酶(PKM)三种限速酶作用下,葡萄糖转化为丙酮酸;乳酸脱氢酶A (LDHA)是Warburg的最后一步,催化丙酮酸生成乳酸;最后,单羧酸转运体(MCT)将乳酸释放到细胞外基质中。此外,丙酮酸脱氢酶激酶(PDK)通过抑制丙酮酸脱氢酶(PDH),阻断丙酮酸生成乙酰CoA[4]。
miRNAs参与调节Warburg效应分为促进和抑制作用,其调节多种关键酶的表达,具体机制将分节介绍,总的归纳见图1所示:
1.1 miRNAs靶向己糖激酶2(HK2)作用于糖酵解过程
己糖激酶(HKS)是葡萄糖代谢催化的第一个不可逆步骤。己糖激酶有4种亚型,目前研究报道最多的是HK2,其在多种类型肿瘤中高表达,参与肿瘤细胞的有氧糖酵解,是抑制肿瘤糖酵解的新靶点[5]。
在肝癌中,miR-199a靶向HK2 3’-UTR,抑制其表达,从而降低葡萄糖消耗和乳酸生成,抑制Warburg[6];在结肠癌细胞中,过表达miR-4458靶向HK2,抑制癌细胞Warburg和乳酸产生[8]。miR-98靶向HK2,减少葡萄糖摄取、抑制乳酸产生和细胞增殖[9];在乳腺癌细胞中,miR-155一方面上调转录激活因子STAT3,促进HK2的表达[10]。另一方面,miR-155靶向转录激活因子C/EBPβ,从而在转录后水平促进HK2的表达[11];在前列腺癌和胃癌中,miR-181b通过靶向HK2,抑制细胞Warburg、增殖和迁移能力[12][13](见表1)。
1.2 miRNAs靶向磷酸果糖激酶(PFK)作用于糖酵解过程
研究表明,在乳腺癌中,miR-206靶向6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3(PFKFB3)mRNA的3’-UTR,降低PFKFB3的表达从而抑制糖酵解[14]。而且17β-雌二醇通过对ERα的调控,影响miR-206表达,从而抑制癌细胞的活力和迁移;已知PFK1的表达增加会促进糖酵解发生,胰腺癌中miR-135靶向PFK1,抑制细胞的有氧糖酵解能力[15]。miR-128直接靶向肺癌细胞中的PFK,miR-128的过表达降低了葡萄糖的摄取和乳酸的产生,以及细胞ATP含量的增加,即抑制了肺癌细胞糖酵解[16](见表2)。
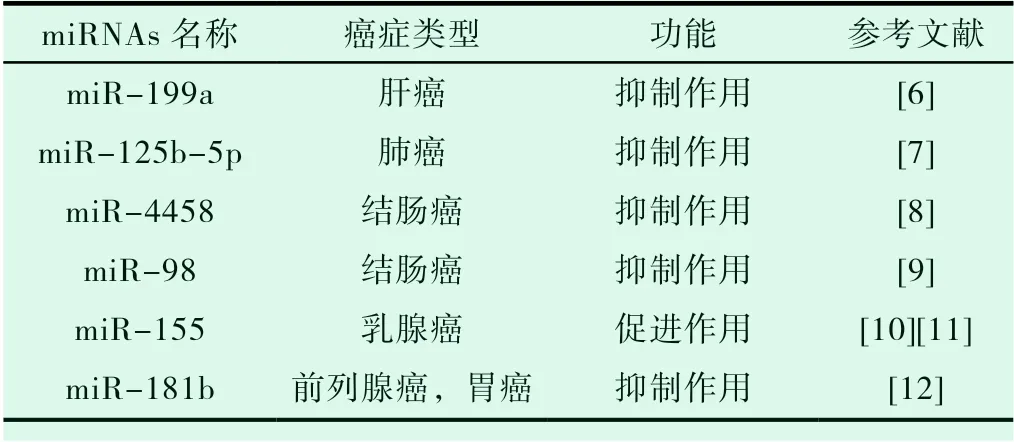
表1 miRNAs靶向HK2调节癌细胞糖酵解

表2 miRNAs靶向PFK调节癌细胞糖酵解
1.3 miRNA通过丙酮酸激酶(PKM)作用于糖酵解过程
在哺乳动物中,PKM有四种亚型(PKL、PKR、PKM1和PKM2),其中PKM2在Warburg效应中起关键作用[17]the glycolytic pyruvate kinase isoenzyme M2 (PKM2,M2-PK。在肝癌中,miR-122靶向PKM2,抑制其转录,进一步抑制了癌细胞对葡萄糖的摄取,从而抑制糖酵解[18]。而过表达的miR-122-5p通过负调控PKM2促进肾癌细胞的细胞活力,增殖,迁移,糖酵解和自噬[19]。另外,在结肠癌中,miR-124、miR-137和miR-340通过调节PKM的表达,将磷酸烯醇式丙酮酸转化为丙酮酸,从而抑制了有氧糖酵解,以及癌细胞的生长[20](见表3)。
1.4 miRNA通过乳酸脱氢酶A(LDHA)作用于有氧糖酵解过程
乳酸脱氢酶A(LDHA)可以将丙酮酸转化为乳酸,其在许多类型癌症中高表达,参与调节肿瘤的生长和转移,作为癌症的诊断标记物和靶点,具有重要的研究意义[21]。
在结肠癌细胞中,miR-34a、miR-34c、miR-369-3p、miR-374a和miR-4524a/b均可通过靶向LDHA,抑制有氧糖酵解[22];在肝癌中,LDHA 3’-UTR也是miR-142-3p的靶点,过表达miR-142-3p可以抑制癌细胞的有氧糖酵解和细胞增殖;在卵巢癌[23]和肝细胞癌[24]中,过表达miR-383靶向LDHA,减少糖酵解从而抑制细胞增殖和侵袭;在胃癌组织中,高表达的miR-323A-3p可显著降低LDHA的mRNA和蛋白表达水平,同时miR-323A-3p的过表达抑制了胃癌细胞乳酸的产生[25];在乳腺癌细胞中,miR-30a-5p靶向LDHA 3‘-UTR,抑制其表达,降低细胞的葡萄糖摄取、乳酸生成、ATP生成和胞外酸化率(ECAR),增加氧耗率(OCR),从而抑制糖酵解,并诱导细胞将糖酵解方式转换为线粒体呼吸[26];在膀胱癌细胞中,miR-204-3p也可以与乳酸脱氢酶A(LDHA)的3‘-UTR结合,从而抑制LDHA的mRNA和蛋白表达,降低葡萄糖消耗和乳酸产生。对膀胱癌细胞的生长抑制和细胞凋亡起到促进作用[27](见表4)。
1.5 miRNAs通过其他因子或蛋白作用于糖酵解过程
除上述关键酶之外,丙酮酸脱氢酶激酶(PDK)作为丙酮酸脱氢酶(PDH)的负性调节因子,减少线粒体中丙酮酸的氧化,在维持能量平衡方面起着关键作用[28]。miR-34a能够抑制PDK1的表达,减少癌细胞糖酵解,增强线粒体氧化磷酸化[29]。
SLC2A3是一种广泛表达的功能性葡萄糖转运蛋白,可促进癌细胞的糖酵解。在前列腺癌细胞中,转染miR-29c导致SLC2A3的表达下调,并降低前列腺癌细胞中的葡萄糖消耗和L-乳酸的产生[30]。
2 miRNAs调节与有氧糖酵解相关的信号通路
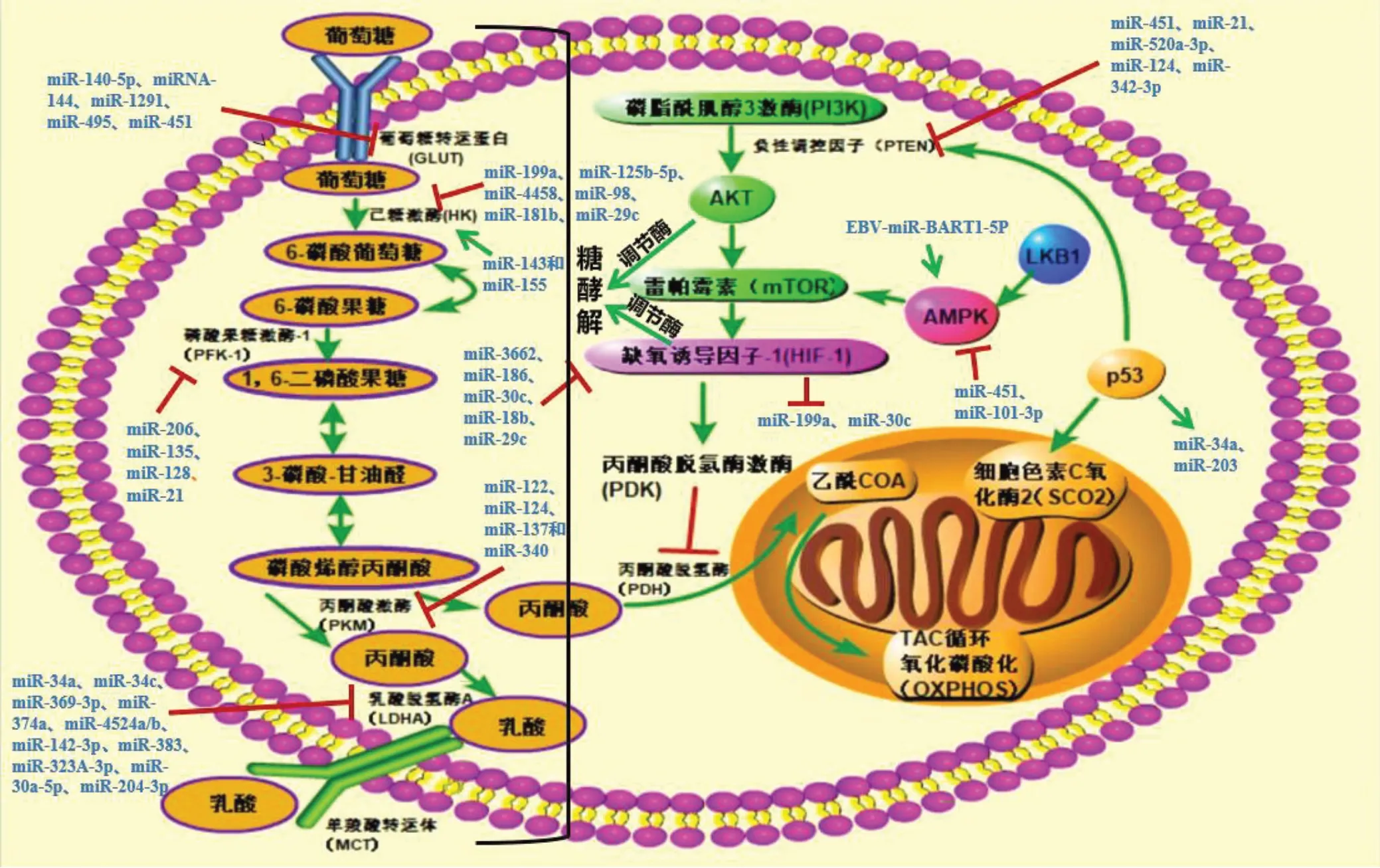
图1 microRNAs调控Warburg效应关键酶及相关信号通路
癌细胞的新陈代谢受到多种信号通路调节,例如,磷脂酰肌醇3激酶(PI3K)/AKT、AMPK和缺氧途径等参与了从氧化磷酸化(OXPHOS)到有氧糖酵解的转变,直接或间接地影响参与葡萄糖代谢的酶活性。各信号通路之间形成了一个复杂的调控网络,调节癌细胞的糖代谢(见图1)。

表3 miRNAs靶向PKM调节癌细胞糖酵解
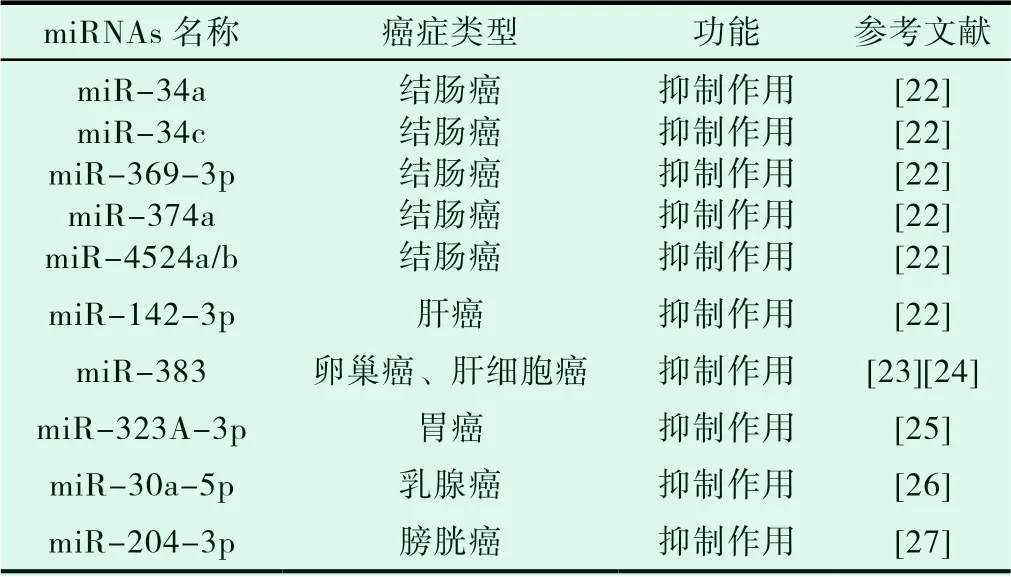
表4 miRNAs靶向LDHA调节癌细胞糖酵解
2.1 miRNAs通过PI3K/Akt通路调节癌细胞糖酵解
AKT又称蛋白激酶B(PKB),是一种进化保守的丝氨酸/苏氨酸激酶。Akt激活后,细胞内ATP含量增加。氧耗增加,而在Akt缺乏的细胞中则减少[31]。Akt介导的糖酵解有多种机制:(1)Akt增加葡萄糖转运蛋白的表达和膜转位[32];(2)Akt影响HK的表达、活性和线粒体相互作用[32];(3)Akt间接激活糖酵解过程中重要的限速酶:磷酸果糖激酶-1(PFK1)[33]。增强的PI3K/Akt信号增加了营养转运蛋白的表达,使葡萄糖、氨基酸和其他营养物质的摄取增加。
在胶质瘤细胞中,miR-451靶向重组人钙结合蛋白39(CAB39),从而抑制PI3K/Akt信号通路,减少胶质瘤细胞的葡萄糖摄取、乳酸产生和ATP水平,从而影响细胞的生长,增殖等生物学行为[34];在膀胱癌细胞中,miR-21通过PI3K/AKT/mTOR通路调节GLUT1、GLUT3、LDHA等有氧糖酵解关键酶相关基因的表达,抑制糖酵解,进一步抑制癌细胞生长[35];在胃癌中,miR-520a-3p通过调节AKT通路,抑制胃癌细胞的增殖和糖酵解[36];在非小细胞肺癌细胞中,miR-124靶向AKT1/2-葡萄糖转运蛋白1/己糖激酶II,抑制癌细胞的增殖和糖酵解[37]。
2.2 miRNAs通过AMPK通路调节癌细胞糖酵解
AMPK调节细胞对葡萄糖的摄取,脂肪酸的β氧化,以及葡萄糖和线粒体的生物发生。激活AMPK会增加分解代谢ATP的生成过程,并抑制消耗ATP的生物合成过程。从代谢的角度来看,在转化和未转化的细胞中,AMPKα1的失活都有助于转化为有氧糖酵解,并增加葡萄糖向脂质的分布。而EBV-miR-BART1-5p通 过 靶 向AMPKα1,激 活AMPK/mTOR/HIF1通路,上调鼻咽癌细胞的糖酵解,诱导血管生成,最终促进鼻咽癌细胞的生长[38];AMPK作为miR-101-3p的直接靶标,miR-101-3p通过靶向作用于AMPK抑制了三阴性乳腺癌细胞的葡萄糖代谢和增殖[39]。
2.3 miRNAs通过缺氧途径调节癌细胞糖酵解
缺氧和Warburg效应之间有密切的联系。实体瘤遇到缺氧时,会激活HIF1转录因子复合体,低氧诱导因子-1α(HIF-1α)通过以下几方面诱导Warburg效应:(1)翻译出有利于癌症发生的蛋白,如通过升高GLUT1表达,提高葡萄糖的利用率和摄取;(2)糖酵解酶,加速从葡萄糖到丙酮酸的流动;(3)丙酮酸脱氢酶激酶1,抑制丙酮酸向乙酰辅酶A的转化,减少丙酮酸氧化,抑制氧化磷酸化途径产生的ATP;(4)过表达的HIF1会产生类似p53丢失的作用,导致糖酵解现象增强,促进血管生成,抑制癌细胞发生凋亡。
miRNAs则通过靶向HIF-1α调节有氧糖酵解,如在肝癌细胞中,miR-3662靶向HIF-1α,抑制癌细胞糖酵解和增殖[40];在胃癌细胞中,过表达miR-186抑制HIF-1α表达,抑制葡萄糖摄取和乳酸生成[41];在恶性黑色素瘤细胞中,miR-18b通过直接靶向HIF-1α,在体内外抑制癌细胞的生长和糖酵解[42]。
3 结语
癌细胞为何偏向于使用低能效的有氧糖酵解供能,是一直以来困惑研究者的问题,根据目前研究进展,我们总结主要原因有4点:(1)虽然人为计算在氧化磷酸化途径中,每单位葡萄糖可以产生36个ATP,而有氧糖酵解途径只有2个ATP产生。但有氧糖酵解的葡萄糖代谢率较高,葡萄糖产生乳酸的速度比葡萄糖在线粒体中完全氧化快10-100倍。并且存在一种假设,即事实上,细胞内酶动力学存在差异,导致葡萄糖无论被以任何一种形式代谢利用时,其在一定时间内产生的ATP总量都是大致相似的;(2)为了确保ATP的持续供应。由于肿瘤的生长速度过快,常规供氧途径无法满足其所需,而有氧糖酵解可以保障能量的持续供应;(3)合成出癌细胞分裂所需的各种原料。有氧糖酵解各步骤中产生的各种脂质、蛋白质和核苷酸,中间代谢酶,被证明可以发挥各种生物学作用,如有氧糖酵解过程的果糖激酶PFKFB4能够修饰蛋白质。该酶可以作用于转录激活蛋白SRC-3,增加其转录活性,以及乳腺癌细胞增殖和转移能力;(4)增强癌细胞侵袭性,葡萄糖消耗增加导致乳酸分泌增加,从而导致局部微环境酸化(即酸中毒)。由癌细胞分泌的H+离子表达水平升高,改变了细胞间质环境,抑制免疫作用,增加了癌细胞侵袭性。
miRNAs在有氧糖酵解过程中发挥重要作用,其通过靶向有氧糖酵解途径中关键酶基因的3’-UTR,降低其mRNA和蛋白表达水平,降低葡萄糖消耗,乳酸生成,ATP生成,同时增加氧耗率(OCR),以此抑制糖酵解,促进有氧糖酵解转为氧化磷酸化,从而抑制癌细胞有氧糖酵解,达到抗肿瘤策略。另外,miRNAs通过抑制葡萄糖消耗和乳酸产生,改善了细胞的酸化环境,增强免疫作用,抑制癌细胞迁移和侵袭能力。miRNA通过直接和间接调节与有氧糖酵解相关的基因来参与调节癌细胞的代谢。以上研究增强了我们对癌细胞糖代谢的理解,为临床癌症的治疗提供新的思路和方向。
