西替利嗪对鼻息肉细胞中JAK/STAT信号及NF-κB表达的影响
2018-12-28贾全凡刘冬梅常艺琼
贾全凡,袁 龙,刘冬梅,常艺琼
(四川省广元市中心医院耳鼻咽喉-头颈外科 628000)
鼻息肉病是临床常见的鼻部黏膜慢性炎症,患者常因鼻腔堵塞导致鼻阻、头痛等症状,部分患者伴哮喘、中耳炎等并发症[1]。酪氨酸激酶JAK/转录因子STAT信号(janus kinase/signal transducer and activator of transcription,JAK/STAT)属于重要的细胞内信号转导通路,在细胞生理反应中发挥重要作用[2]。核因子κB(nuclear factor kappa-B,NF-κB) 属于核转录调控因子,为炎性反应中的重要介质[3]。近年来研究显示,JAK/STAT、NF-κB的激活与鼻息肉的发生有着密切联系,但具体作用机制目前尚未阐明[4]。本研究体外培养鼻息肉细胞,并给予西替利嗪处理,探究西替利嗪对鼻息肉细胞中JAK/STAT信号及NF-κB表达的影响,为鼻息肉的治疗提供一定的参考。
1 资料与方法
1.1 一般资料 选取2016年6月至2017年8月在本院耳鼻喉科进行治疗的40例鼻息肉病患者为试验组,其中男22例,女18例,年龄23~65岁,平均(43.59±7.23)岁。患者组织分型均为Ⅱ型,其中Ⅰ期19例,Ⅱ期15例,Ⅲ期6例,患者均进行手术治疗获取鼻息肉组织。另选取同期在本院进行鼻中隔手术的27例正常中鼻甲标本作为对照组,其中男16例,女11例,年龄24~62岁,平均(43.26±8.17)岁。以上纳入患者均知情同意,无哮喘、过敏性鼻炎等病史,近期1个月内未服用抗组胺药物或糖皮质激素。两组患者在性别、年龄方面比较,差异无统计学意义(P<0.05),具有可比性。
1.2 方法
1.2.1 仪器与试剂 DMEM培养基购自美国Gibco公司;胰蛋白酶、胎牛血清购自碧云天生物技术研究所;鼠抗β-肌动蛋白(β-actin)、蛋白酪氨酸激酶(Janus kinase 3,JAK3)、磷酸化JAK-3(p-JAK3)、信号传导转录激活因子3(signal transducer and activator of transcription 3,STAT3)、磷酸化STAT3(p-STAT3)、NF-κB p50、NF-κB p65抗体购自于美国Santa Cruz公司;B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、辣根过氧化物酶标记羊抗鼠免疫球蛋白G(IgG)二抗购自于美国R&D公司;蛋白提取试剂盒、BCA蛋白检测试剂盒购自于美国Thermo Fisher Scientific公司;RT-PCR检测试剂盒购自于日本Takara公司;蛋白凝胶成像仪购自于美国Bio-Red公司;细胞流式仪购自于美国Thermo公司。
1.2.2 试验方法
1.2.2.1 鼻息肉细胞原代培养 取出保存鼻息肉组织、正常中鼻甲组织,置于含双抗的磷酸盐缓冲液(PBS)中清洗后,将组织剪碎,加入2.5 g/L胰蛋白酶消化液放置4 ℃冰箱中消化12~16 h,轻柔吹打组织块,细胞脱落后,在细胞悬液中加入胎牛血清,置于离心机中1 000 r/min离心5 min,添加10%胎牛血清DMEM培养基,置于37 ℃ 5%CO2培养箱中进行培养,当细胞生长至90%时,更换新鲜培养液,放置在5%CO2、1%O2细胞培养箱内进行培养,当细胞培养至第3代时可用于后续研究。
1.2.2.2 Western blot检测JAK3、p-JAK3、STAT3、p-STAT3、NF-κB p50、NF-κB p65的表达 收集培养后细胞培养液,离心后加入蛋白裂解液反应30 min,提取细胞总蛋白,BCA法测定蛋白浓度,配制12%分离胶、5%浓缩胶,将蛋白样品与Loading buffer 1∶4混匀后上样,蛋白上样量为20 μg,起始电压设置为80 V。待样品指示剂进入分离胶时,将电压升高至120 V。电泳结束后,将蛋白凝胶转移至聚偏二氟乙烯(PVDF)膜上,4 ℃条件下进行转膜反应,电压设置80 V,转膜时间为90 min。结束后用Tris缓冲生理盐水吐温(TBST)溶液清洗蛋白凝胶,加入5%脱脂牛奶室温下封闭90 min。TBST溶液清洗后,加入一抗,4 ℃过夜;TBST清洗后加入二抗,室温下孵育90 min;TBST清洗后滴加电化学发光(ECL)发光液显色,置于凝胶成像仪中观察蛋白表达情况。
1.2.2.3 细胞增殖测定 收集培养至对数期鼻息肉细胞,制备单细胞悬液添加至96孔培养板,调整细胞密度为5×104/孔,在37 ℃、5%CO2培养箱内培养24 h,弃上清液,向孔内加入2.5×10-7、5×10-7、1×10-6mol/L西替利嗪(分别为西替利嗪低、中、高浓度组),对照组不进行药物处理,继续培养48 h后,向孔内加入20 μL CCK8溶液,继续培养48 h后,在酶标仪中检测450 nm处吸光度值。
1.2.2.4 细胞凋亡检测 细胞处理后继续培养48 h加入胰蛋白酶进行消化,调整细胞密度为1×106/mL,用预冷PBS清洗2次后,加入70%乙醇溶液固定过夜,PBS清洗细胞后加入异硫氰酸荧光素(FITC),避光下孵育20 min,与细胞流式仪中观察细胞凋亡情况。

表1 JAK3、p-JAK3、STAT3、p-STAT3、NF-κB p50、NF-κB p65蛋白水平
a:P<0.05,与正常中鼻甲细胞比较
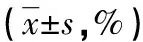
表2 各组鼻息肉细胞增殖水平比较
a:P<0.05,与对照组比较;b:P<0.05,与西替利嗪低浓度组比较;c:P<0.05,与西替利嗪中浓度组比较
1.2.2.5 细胞免疫荧光试验 细胞处理后继续培养48 h,制备细胞爬片,PBS清洗3次,每次清洗3 min,置于4%多聚甲醛中固定15 min。PBS再次清洗3次,每次清洗3 min,随后加入0.5%Triton X-100室温放置20 min。PBS又清洗3次,每次清洗3 min,晾干后滴加山羊血清,室温下封闭30 min,用滤纸吸走封闭液后滴加一抗,4 ℃过夜孵育。次日PBS清洗3次,每次清洗3 min,加入荧光二抗,37 ℃孵育1 h,避光下加入4,6-联脒-2苯基吲哚(DAPI)孵育5 min,磷酸盐缓冲液吐温20(PBST)清洗4次,每次清洗5 min,晾干后置于荧光显微镜下观察保存图像。
1.2.2.6 西替利嗪对鼻息肉细胞中JAK3、p-JAK3、STAT3、p-STAT3、NF-κB p50、NF-κB p65、Bcl-2、Bax的表达 西替利嗪处理后,继续培养48 h,收集细胞培养液,离心后保留下层细胞沉淀,参照1.2.2.3方法进行蛋白表达检测。

2 结 果
2.1 鼻息肉细胞及正常中鼻甲细胞中JAK3、p-JAK3、STAT3、p-STAT3、NF-κB p50、NF-κB p65蛋白水平比较 两种细胞中JAK3、STAT3蛋白水平无明显变化,差异无统计学意义(P>0.05)。与正常中鼻甲细胞相比,鼻息肉细胞中p-JAK3、p-STAT3、NF-κB p50、NF-κB p65蛋白水平均升高,差异有统计学意义(P<0.05),见表1。
2.2 西替利嗪对鼻息肉细胞增殖的影响 随着细胞培养时间延长,西替利嗪各浓度组细胞抑制率逐渐升高。在同一时间点,与对照组相比,西替利嗪各组随着处理剂量的升高,细胞抑制率均升高,差异有统计学意义(P<0.05),见表2。
2.3 西替利嗪对鼻息肉细胞凋亡的影响 与对照组相比,西替利嗪处理组细胞凋亡率逐渐升高,且随着处理剂量的增加逐渐升高,差异有统计学意义(P<0.05),见图1、表3。
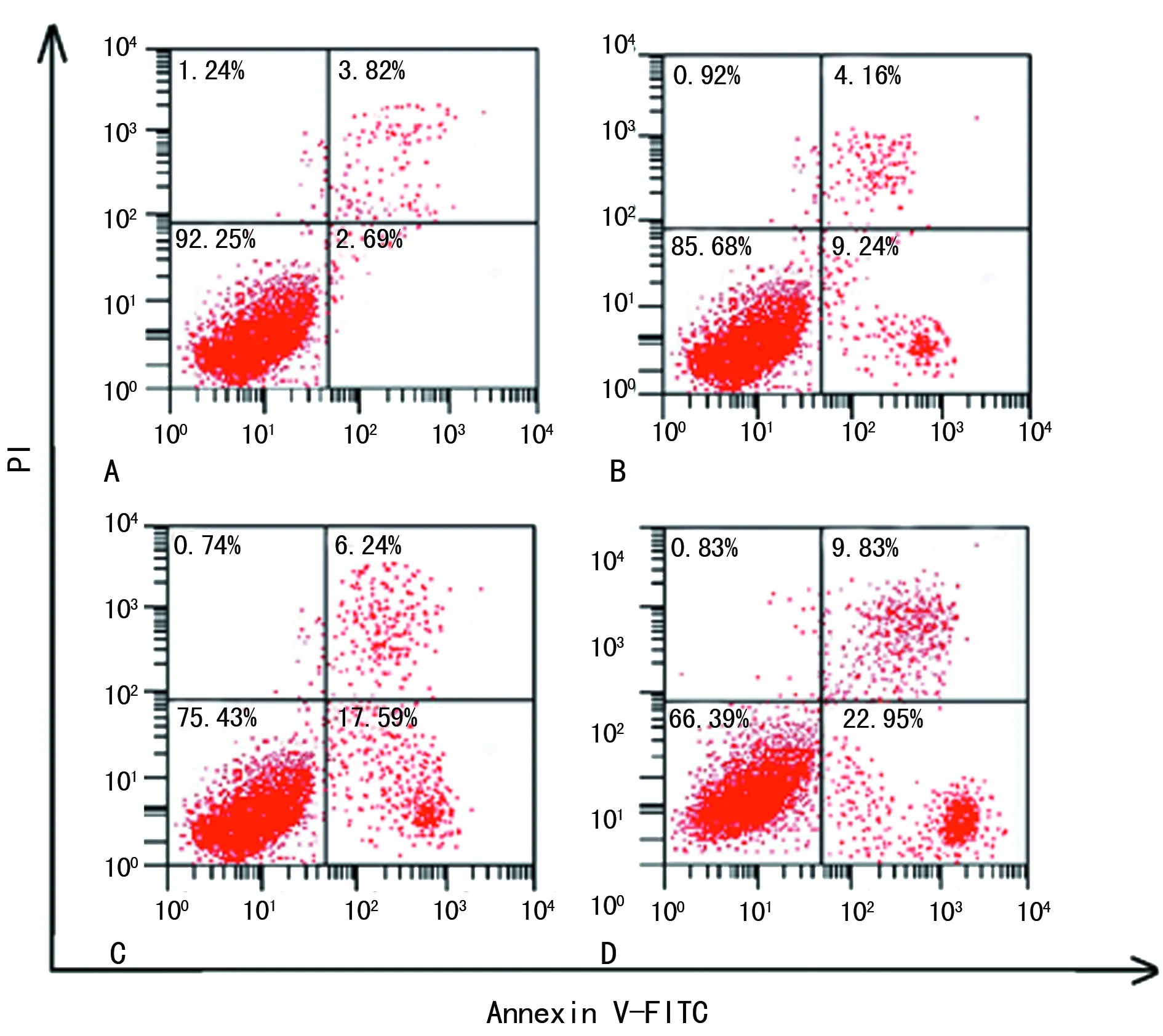
A:对照组;B:西替利嗪低浓度组;C:西替利嗪中浓度组;D:西替利嗪高浓度组
图1鼻息肉细胞凋亡情况
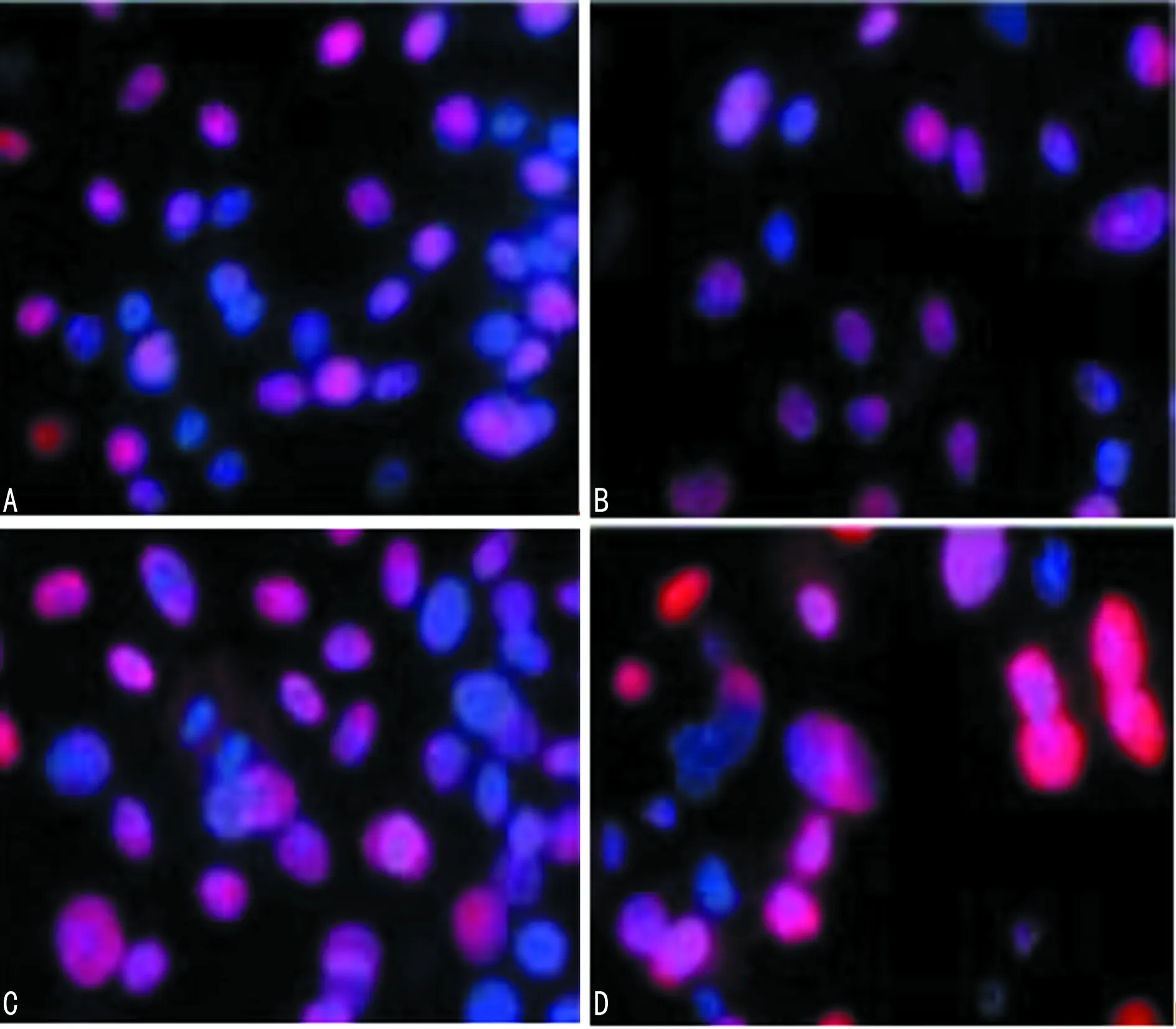
A:对照组;B:西替利嗪低浓度组;C:西替利嗪中浓度组;D:西替利嗪高浓度组
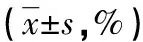
图2 鼻息肉细胞中STAT3免疫荧光检测(×100)
a:P<0.05,与对照组比较;b:P<0.05,与西替利嗪低浓度组比较;c:P<0.05,与西替利嗪中浓度组比较
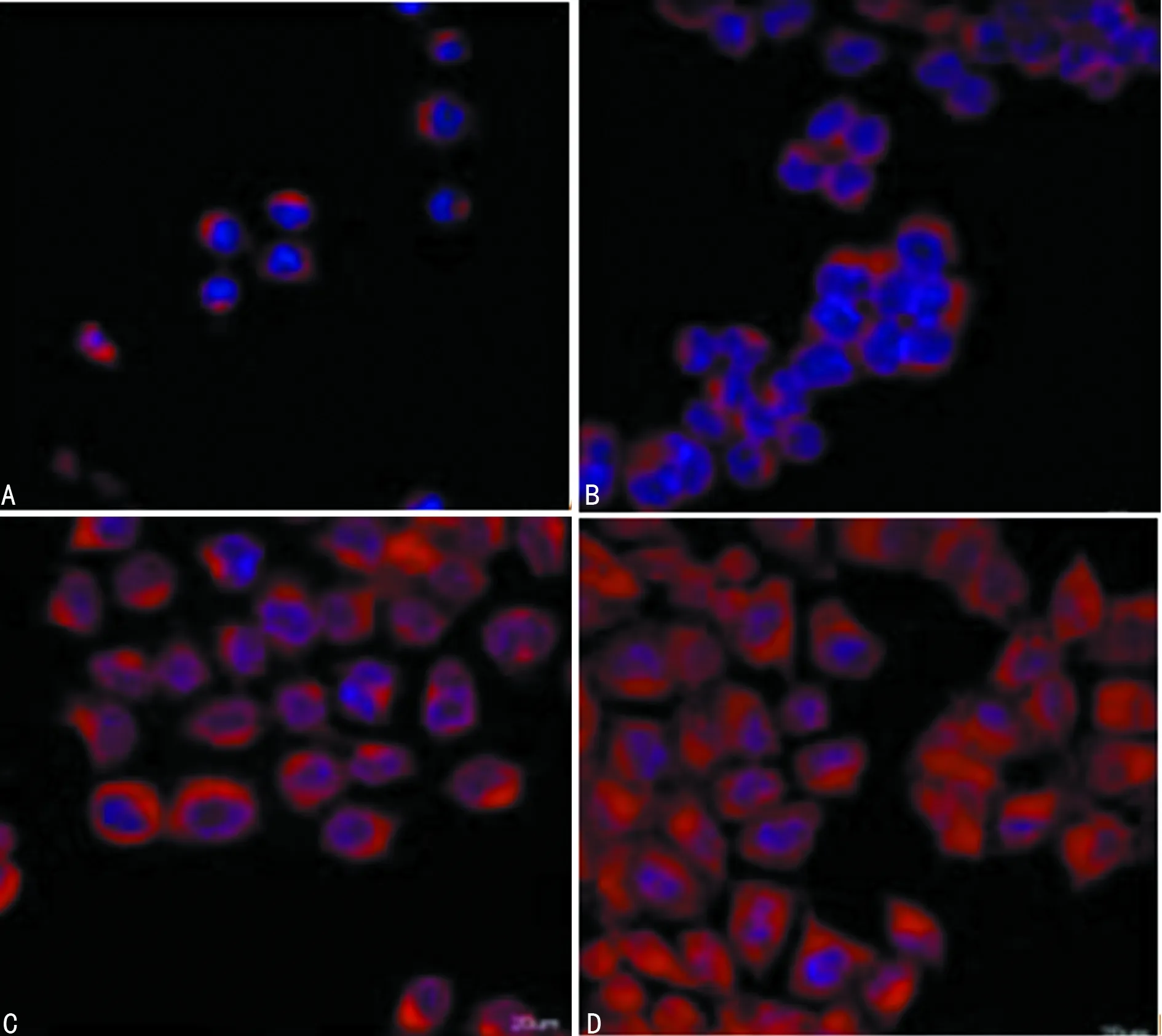
A:对照组;B:西替利嗪低浓度组;C:西替利嗪中浓度组;D:西替利嗪高浓度组
图3鼻息肉细胞中NF-κB p65免疫荧光检测(×100)
2.4 细胞免疫荧光检测鼻息肉细胞中STAT3、NF-κB p65表达 免疫荧光检测显示,STAT3、NF-κB p65在对照组细胞中主要定位在细胞核中,经西替利嗪处理后,STAT3、p65逐渐向细胞质中移动,随着处理剂量的增加,细胞质荧光强度增强,见图2、3。
2.5 西替利嗪对鼻息肉细胞中JAK/STAT信号、NF-κB、Bcl-2、Bax表达的影响 4组JAK3、STAT3蛋白表达无明显变化,差异无统计学意义(P>0.05)。与对照组相比,西替利嗪处理组p-JAK3、p-STAT3、NF-κB p50、NF-κB p65、Bcl-2蛋白表达均降低,Bax蛋白表达升高,且具有剂量依赖性,差异有统计学意义(P<0.05),见图4、表4。
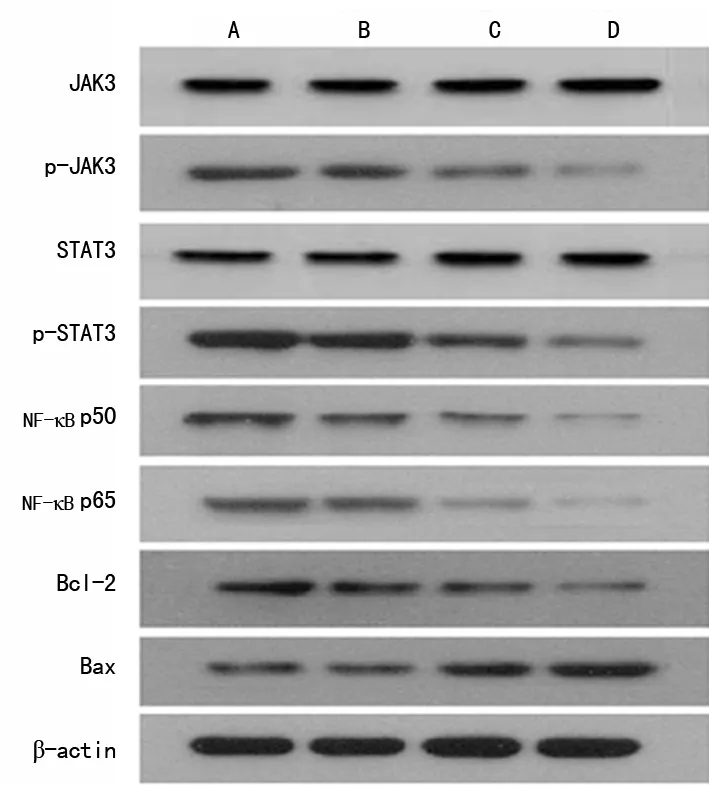
A:对照组;B:西替利嗪低浓度组;C:西替利嗪中浓度组;D:西替利嗪高浓度组

图4 鼻息肉细胞中JAK3、p-JAK3、STAT3、
a:P<0.05,与对照组比较;b:P<0.05,与西替利嗪低浓度组比较;c:P<0.05,与西替利嗪中浓度组比较
3 讨 论
抗组胺药物为临床治疗鼻炎、过敏性鼻炎的主要药物,第1代抗组胺药物虽然有一定的效果,但具有严重毒副作用,如心脏毒性[5]。西替利嗪属于抗组胺第2代药物,为高选择性H1受体拮抗剂,可选择性与靶细胞H1受体结合,进而发挥抗组胺作用。与第1代药物相比,其对胃肠、心脏、头部的不良反应明显减弱,且半衰期增长,药效持久,在鼻炎、过敏性鼻炎中治疗效果较好[6-7]。基于此,本研究通过离体培养鼻息肉细胞,并给予西替利嗪处理,以观察其对鼻息肉细胞增殖的影响及与JAK/STAT信号、NF-κB通路的关系,以探究西替利嗪作用机制。
JAK/STAT信号通路在多类细胞生长、分化、凋亡及炎性反应发生中发挥着重要作用。细胞因子与受体结合后形成二聚体且与JAK靠近,进而被酪氨酸残基磷酸化,吸引转录因子STAT与受体结合,使STAT磷酸化并与受体解离形成二聚体,逐渐转移至细胞核内参与下游靶基因的调控,因而JAK的磷酸化后能够激活STAT磷酸化,进而发挥生物学作用[8-10]。过往研究显示在鼻息肉形成过程中炎症细胞释放的炎症介质激活JAK进而激活STAT3,放大炎性反应[11]。本研究结果显示在鼻息肉细胞中p-JAK3、p-STAT3明显高于正常中鼻甲细胞,根据以往研究结果推测,STAT3可能与鼻息肉的发生有关。进一步研究显示西替利嗪处理后鼻息肉细胞增殖明显受到抑制,且p-JAK3、p-STAT3蛋白表达降低,免疫荧光检测显示STAT3逐渐向细胞质中转移,表明JAK/STAT信号通路参与鼻息肉的发生,西替利嗪可通过抑制JAK/STAT信号通路的磷酸化,进而抑制鼻息肉细胞的增殖。
NF-κB属于重要核转录因子,在炎性、免疫反应中发挥重要作用,一般以p50-p65异二聚体的形式存在于细胞质。NF-κB被激活后逐渐转移至核内,与DNA启动位点结合调控细胞因子转录,NF-κB被激活后可大量分泌炎症介质,进而调控多种炎症因子表达[12-13]。CHO等[14]研究表明,鼻息肉组织中NF-κB 呈阳性表达,其可以通过调控白细胞介素(IL)-1、IL-10、肿瘤坏死因子α(TNF-α)等细胞因子的转录扩大炎性反应,促进鼻息肉的发生、发展。本试验结果显示,鼻息肉组织中NF-κB p50、NF-κB p65蛋白有较强的表达,明显高于正常中鼻甲细胞,且经西替利嗪处理后可明显降低其蛋白表达,免疫荧光检测显示西替利嗪粗粒后NF-κB逐渐向细胞质中转移,表明在鼻息肉的发生中,转录因子NF-κB 的激活可能为中心环节,其激活可介导炎症介质的释放和活化,形成炎症级联反应,致使鼻息肉的发生、发展。本研究结果提示可通过西替利嗪抑制 NF-κB 蛋白的活性,以缓解鼻息肉发展。
鼻息肉组织中存在细胞增殖、凋亡失衡,以往对鼻息肉凋亡相关研究主要集中于凋亡障碍研究上,对于鼻息肉中促进细胞凋亡研究较少[15]。卞俊杰等[16]研究显示鼻息肉上皮细胞中存在细胞凋亡,且通过蛋白检测显示鼻息肉组织中Bcl-2、Bax蛋白阳性表达率均较高。大量研究证实凋亡有关因子Bcl-2、Bcl-xl、髓细胞白血病基因1(Mcl-1)、Survivn均为STAT3信号通路下游靶基因,STAT3可对以上凋亡相关蛋白进行调控促进细胞的增殖或凋亡,进而参与肿瘤及其他疾病的发生[17]。YANG等[18]研究显示通过抑制STAT3活性能够降低抑制Bcl-2的表达。本研究显示西替利嗪处理组p-JAK3、p-STAT3、NF-κB p50、NF-κB p65、Bcl-2蛋白表达均降低,Bax蛋白表达升高,且具有剂量依赖性,表明西替利嗪处理后可抑制JAK/STAT信号通路,促进凋亡蛋白的表达进而促进鼻息肉细胞的凋亡,提示西替利嗪可诱导鼻息肉细胞凋亡。
综上所述,西替利嗪能够抑制鼻息肉细胞的增殖,促进其凋亡,其机制可能与抑制JAK/STAT信号、NF-κB表达,促进凋亡蛋白的表达相关。但鼻息肉病的发病机制较复杂,所涉及的具体机制还有待后续深入研究。
