阿德福韦酯联合干扰素 -2b对慢性乙型肝炎患者细胞免疫与趋化因子水平的影响
2018-12-25贺旭,柴进,刘巍
贺 旭,柴 进,刘 巍
(1.中国人民解放军第九五八医院,重庆 400020; 2.陆军军医大学附属西南医院消化内科,重庆 400038)
慢性乙型肝炎(chronic hepatitis B,CHB)为我国常见传染病[1],以肝细胞炎症性坏死为主要病理特征,患者常出现乏力、纳差、恶心、腹胀、肝区疼痛等症状,可进展为肝硬化、肝癌、肝功能衰竭,也能引起全身多个脏器受损[2-3]。治疗 CHB的关键在于抑制乙型肝炎病毒(HBV)的复制和体内对HBV的免疫反应,从而控制病情进展。阿德福韦酯(ADV)和干扰素是常用治疗CHB的药物,两者各有优缺点,前者属核苷(酸)类似物,其对HBV DNA的阴转率较高,但HBeAg的转换率较低,而后者对HBeAg的转换率较高,HBV DNA的阴转率较低,故临床常将两者联用。以往的研究[4-5]主要关注这2种药物的临床疗效,对其细胞免疫水平与趋化因子的表达水平影响研究较少。本研究中选取医院2015年收治的CHB患者96例,进行分组治疗,观察了治疗前后的细胞免疫水平与各种趋化因子的变化。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合2000年西安会议修订的《病毒性肝炎防治方案》中CHB的诊断标准[6];HBeAg阳性至少1 年,HBV DNA 载量 >1.0×105copies/mL,血清丙氨酸氨基转移酶(ALT)水平 80~400 U/L,血总胆红素(TBil)<正常值上限的2倍,血小板(PLT)计数>80×109/L,凝血功能正常;治疗前6个月未使用抗病毒药物与免疫调节剂;能完成至少48周的疗程,临床资料完整、可靠;本研究获得我院医学伦理委员会批准,患者自愿参加本研究,且签署知情同意书。

表1 3组患者一般资料比较(n=32)
排除标准:合并肝硬化、肝性脑病、肝癌;合并甲型、丙型、丁型等其他肝炎病毒或EB病毒、巨细胞病毒等感染;合并严重的心、肺、肾、内分泌、血液、神经精神等系统疾病或恶性肿瘤;妊娠期或哺乳期。
病例选择与分组:选取医院2015年1月至12月收治的CHB患者96例,其中男87例,女9例;年龄26~60 岁,平均(37.4±5.3)岁。按随机数字表法将96 例患者分为ADV组、干扰素组和联合组,各32例。3组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
1.2 治疗方法
全部患者均给予常规生活指导。ADV组患者应用阿德福韦酯胶囊(正大天晴药业集团股份有限公司,国药准字H20060666,规格为每粒10 mg),口服,每日1次,每次10 mg;干扰素组患者应用重组人干扰素α-2b注射液(安徽安科生物工程<集团>股份有限公司,国药准字S20040010,规格为每支 600万 U),隔日皮下注射1次,每次600万U;联合组患者同时应用2种药物,其用法、用量同其他两组。3组患者疗程均为48周,治疗期间进行随访,停药后继续随访24周,共72周。治疗期间定期检测患者血常规、血生化与凝血功能等指标。
1.3 观察指标
临床疗效与安全性:分别于治疗后24周、48周、72周时评价临床疗效,包括血常规、肝肾功能、HBVDNA载量、HBV两对半等,记录各个时间点有无HBV DNA 阴转(<5×102copies/mL)、HBeAg阴转与 ALT复常(≤40 U/L),以及治疗期间有无不良反应发生,包括发热、乏力、肌肉与关节酸痛、脱发、PLT降低、肾功能损害等。
细胞免疫水平:分别于治疗前,治疗后24周、48周、72 周时检测 T 淋巴细胞亚群,包括 CD3+,CD4+,CD8+的表达情况,具体操作为在 0.1 mL全血中加入 20 μL三色荧光抗体,室温静置0.5 h后采用流式细胞术检测。并检测T淋巴细胞组织中核仁组织区嗜银蛋白(AgNORs)含量,具体操作为采集外周静脉血8 mL,全血分离出淋巴细胞,然后进行培养、繁殖与染色,检测并对图像进行分析[7]。
趋化因子水平:分别于治疗前,治疗后24周、48周、72周时采用酶联免疫吸附(ELISA)法检测外周血趋化因子 CXCL9,CXCL11,CCL20水平,试剂盒由伊莱瑞特生物科技有限公司提供,严格按照说明书进行操作。
1.4 统计学处理
采用SPSS18.0统计学软件分析。计量资料以均数±标准差(s)表示,行 t检验,多组比较采用方差分析,然后进行两两比较;计数资料以率表示,行 χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表4。ADV组未出现1例不良反应;干扰素组共出现28例(87.50%)不良反应,包括23例发热、乏力与肌肉关节酸痛,5例脱发;联合组共出现26例(81.25%)不良反应,包括20例发热、乏力与肌肉关节酸痛,5例脱发,1例PLT一过性减少。均未发生严重不良反应,未影响继续治疗,全部完成规定疗程。ADV组的不良反应发生率显著低于另两组(P<0.05)。
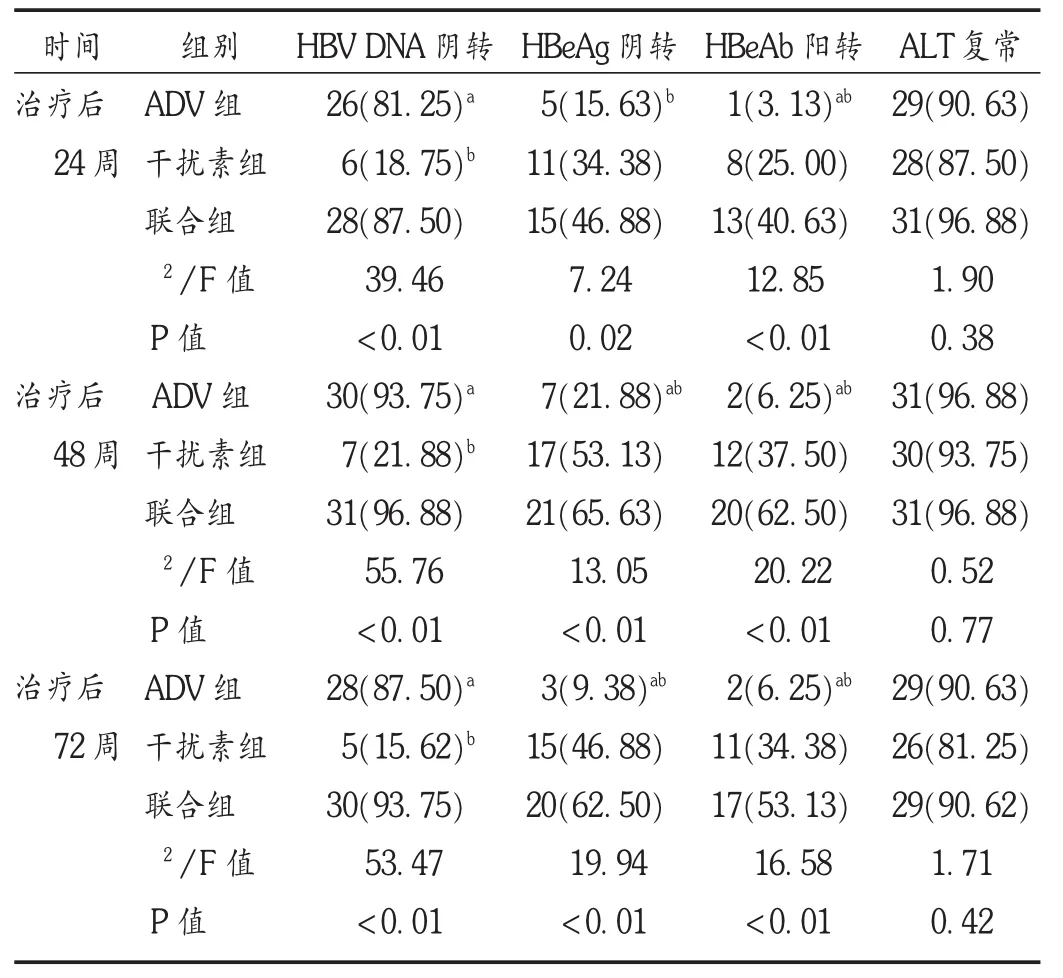
表2 3组患者各时间点临床疗效比较[例(%),n=32]
表3 3组患者T淋巴细胞亚群分布与AgNORs含量比较(s,n=32)

表3 3组患者T淋巴细胞亚群分布与AgNORs含量比较(s,n=32)
注:与本组治疗前相比, P <0.05;与干扰素组相比,aP <0.05;与联合组相比,bP <0.05。表 4 同。
时间治疗前治疗后24周治疗后48周治疗后72周组别ADV组干扰素组联合组2/F 值P值ADV组干扰素组联合组2/F 值P值ADV组干扰素组联合组2/F 值P值ADV组干扰素组联合组2/F 值P值CD3+(%)64.30 ± 10.60 65.10 ± 9.80 66.00 ± 10.20 0.55 0.58 66.80 ± 6.50 68.00 ± 6.10 69.80 ± 5.80 2.39 0.09 68.00 ± 5.90b 70.70 ± 6.20 72.20 ± 5.50 4.00 0.02 67.30 ± 6.60b 69.50 ± 6.00 71.30 ± 5.90 3.56 0.03 CD4+(%)33.30 ± 7.80 34.00 ± 7.20 34.30 ± 7.60 0.33 0.71 35.10 ± 7.90 37.10 ± 8.50 38.30 ± 8.90 1.68 0.19 36.30 ± 8.60b 39.20 ± 9.00 41.60 ± 9.20 3.90 0.02 35.80 ± 8.20b 38.50 ± 8.30 41.10 ± 9.00 3.52 0.03 CD8+(%)32.50 ± 7.60 31.80 ± 7.80 31.30 ± 8.00 0.20 0.81 30.30 ± 7.90 29.30 ± 7.50 28.10 ± 8.20 1.77 0.17 27.80 ± 8.50 25.50 ± 8.30 23.70 ± 8.60 2.78 0.06 28.30 ± 7.90 26.70 ± 7.80 24.30 ± 8.50 2.55 0.08 CD4+ /CD8+1.03 ± 0.22 1.07 ± 0.20 1.10 ± 0.19 1.28 0.28 1.16 ± 0.26b 1.27 ± 0.26 1.36 ± 0.27 4.22 0.01 1.31 ± 0.36 ab 1.54 ± 0.33 b 1.76 ± 0.35 5.07 0.00 1.27 ± 0.37b 1.44 ± 0.35b 1.69 ± 0.40 4.81 0.01 AgNORs含量(%)4.08 ± 1.22 4.17 ± 1.36 3.98 ± 1.30 0.29 0.74 5.51 ± 1.28 5.78 ± 1.35 6.01 ± 1.43 1.11 0.33 6.92 ± 1.35b 7.33 ± 1.39 7.72 ± 1.43 3.39 0.03 6.49 ± 1.30 6.99 ± 1.33 7.15 ± 1.38 2.80 0.06
表 4 3组患者血趋化因子水平比较(s,pg/mL,n=32)
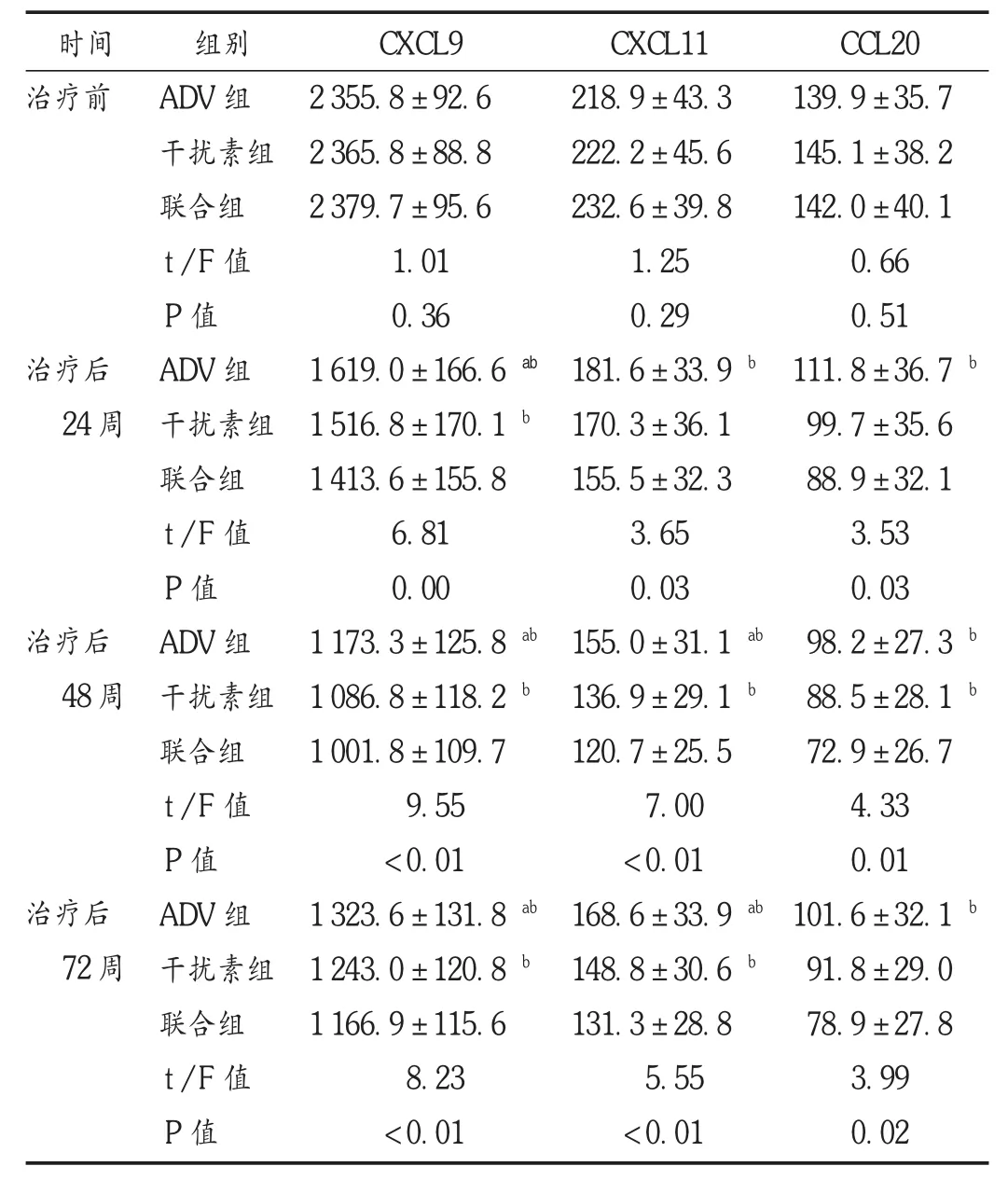
表 4 3组患者血趋化因子水平比较(s,pg/mL,n=32)
时间治疗前治疗后24周治疗后48周治疗后72周组别ADV组干扰素组联合组t/F 值P值ADV组干扰素组联合组t/F 值P值ADV组干扰素组联合组t/F 值P值ADV组干扰素组联合组t/F 值P值CXCL9 2 355.8 ± 92.6 2 365.8 ± 88.8 2 379.7 ± 95.6 1.01 0.36 1 619.0 ± 166.6 ab 1 516.8 ± 170.1 b 1 413.6 ± 155.8 6.81 0.00 1 173.3 ± 125.8 ab 1 086.8 ± 118.2 b 1 001.8 ± 109.7 9.55< 0.01 1 323.6 ± 131.8 ab 1 243.0 ± 120.8 b 1 166.9 ± 115.6 8.23< 0.01 CXCL11 218.9 ± 43.3 222.2 ± 45.6 232.6 ± 39.8 1.25 0.29 181.6 ± 33.9 b 170.3 ± 36.1 155.5 ± 32.3 3.65 0.03 155.0 ± 31.1 ab 136.9 ± 29.1 b 120.7 ± 25.5 7.00< 0.01 168.6 ± 33.9 ab 148.8 ± 30.6 b 131.3 ± 28.8 5.55< 0.01 CCL20 139.9 ±35.7 145.1 ± 38.2 142.0 ±40.1 0.66 0.51 111.8 ±36.7 b 99.7 ± 35.6 88.9 ±32.1 3.53 0.03 98.2 ±27.3 b 88.5 ± 28.1 b 72.9 ±26.7 4.33 0.01 101.6 ±32.1 b 91.8 ± 29.0 78.9 ± 27.8 3.99 0.02
3 讨论
ADV联合干扰素α-2b治疗CHB是临床常用治疗方案,2种药物各有优缺点,有互补作用,疗效显著。本研究结果表明,经过48周完整的治疗后,3组患者的整体疗效较理想,ADV与干扰素 α-2b 2种药物对CHB患者的生化学应答效果均非常明显,ALT复常率与两者联用后无明显差异。ADV治疗后患者的病毒学应答效果显著,但血清学应答效果很差。与ADV相反,干扰素α-2b对CHB患者的血清学应答效果较明显,但病毒学应答效果很差。两者联用后同时提高了病毒学与血清学应答效果,HBV DNA阴转率、HBeAg阴转率、HBeAb阳转率均优于单用药物组患者,且停药后能维持半年,三者的比例分别为93.8%,62.5%和53.1%,较停药时无明显降低,提示疗效能在短期内维持,不需要终身服药,与以往研究结果[5]类似。但以往的研究并未观察3个治疗方案对CHB患者细胞免疫水平与趋化因子的表达差异。
人体内 T 细胞主要由 CD3+,CD4+,CD8+3 个亚群组成,其亚群数量与比例是维护体内细胞免疫稳定的关键。目前认为,乙型肝炎的发生、发展与机体的细胞免疫功能状态息息相关,其中T淋巴细胞起关键作用,具体表现为T淋巴细胞数量及亚群比例失调,是HBV在体内持续进行复制的重要原因之一,在乙型肝炎慢性化过程中发挥重要作用。当机体感染HBV后,体内会出现特异性的T淋巴细胞,以此清除细胞内病毒,当发生急性自限性的HBV感染时,体内有较强的特异性T淋巴细胞反应。但对于CHB患者,其T淋巴细胞的反应较弱,甚至难以检测到,故促进体内细胞免疫水平有助于控制疾病进展,这也是当前抗病毒药物的药理作用机制之一。ADV是核酸类似物,其通过抑制HBV DNA的多聚酶来抑制病毒繁殖,且能诱导体内干扰素的合成,增加NK细胞活力,刺激体内免疫反应,从而起到较强的抗病毒作用。体外注射干扰素不仅能抑制病毒的复制及病毒相关蛋白的表达,还能诱导体内多种抗病毒蛋白的细胞因子合成,在抗病毒的同时还能起到调节免疫的作用[8]。本研究结果表明,3 组患者治疗后 CD3+,CD4+,CD4+/CD8+的比例逐渐升高,而CD8+的比例逐渐降低。CD3+T淋巴细胞代表总T淋巴细胞水平,CD4+与 CD8+T淋巴细胞代表了主要的T细胞亚群[9],两者直接参与了肝细胞的损伤,在乙型肝炎慢性化的过程中起到重要作用[10]。CD4+/CD8+比例也反映了机体的细胞免疫功能,本研究中经过ADV、干扰素α-2b或两者联用治疗后,该比值显著升高,且联用的效果显著优于单用。T细胞是一种免疫活性细胞,其细胞核的核仁由组成区构成,早期研究已发现细胞核中存在能被硝酸银染色的物质,不是RNA或DNA,而是一组酸性的嗜银蛋白(AgNORs),其作用是帮助DNA的转录,故其含量的高低能间接反映细胞内核酸的活性,从而反映部分细胞的整体活性变化[11]。目前,临床常通过检测外周血的T淋巴细胞内AgNORs的含量来判断机体的免疫状态。本研究结果发现,联合组治疗后外周血T淋巴细胞的AgNORs含量逐渐升高,且联合组治疗后48周的AgNORs含量显著高于ADV组,而联合组与干扰素组间无显著差异。提示ADV与干扰素α-2b均能显著提高CHB患者的细胞免疫水平,且干扰素α-2b的效果更强,两者联用效果最佳。
趋化因子是指一组能吸引免疫细胞移行到感染部位的小分子蛋白质,其相对分子质量多较低(8~10 kD),因其具有定向细胞趋化作用而得名,其在炎性反应中具有重要作用。外周血的炎症细胞募集到炎症部位的过程主要包括2个步骤,首先由选择素与整合素介导炎症细胞黏附在血管内皮,然后由趋化因子结合炎症细胞表面的受体,从而介导该细胞定向迁移到炎症部位。HBV感染能通过上调外周血清中趋化因子的表达水平来促进T细胞活化,活化后的T细胞经特异受体识别迁移至肝脏,实现减轻肝脏组织因对抗HBV而引起的炎性反应,同时清除进入人体的HBV病毒。在急性病毒性肝炎中,淋巴细胞被趋化因子募集至肝脏,从而能辅助病毒的清除。但CHB患者淋巴细胞的募集却是致病因素之一,因为持续的慢性肝炎可导致肝纤维化、肝硬化。已有研究显示,机体对HBV的免疫耐受与免疫应答低下是导致CHB的重要机制之一[12],如趋化因子及其受体直接参与了淋巴细胞在肝组织内募集,并使其在其靶区域内实现增殖和活化,HBV感染细胞后,能通过调节细胞表面相关的趋化因子受体表达使淋巴细胞无法对其识别与清除[13]。本研究中检测了所有患者治疗前后外周血CXCL9,CXCL11,CCL20 3种趋化因子的表达水平,发现其均参与了HBV慢性感染患者的炎性反应[14-16],其中CXCL9被认为是CHB患者干扰素治疗效果的重要影响因素。国内已有研究表明,血CXCL9的基线水平可作为干扰素治疗效果的预测指标,其表达水平较高者经过聚乙二醇干扰素治疗后病毒学应答率较高,可能有利于指导慢性乙型肝炎患者的个体化用药[17-18]。孟凡凡等[19]的研究表明,CHB患者血清CCL20水平显著升高,是独立于血清其他生化指标之外的病情评估指标。Xin等[20]也发现,慢性重型肝炎引起的肝功能衰竭患者的血CCL20水平显著高于CHB患者。故认为血CCL20水平与CHB的病情严重程度有关。本研究中3组患者治疗后外周血CXCL9,CXCL11,CCL20水平均逐渐降低,且干扰素α-2b的效果优于ADV,两者联用的效果最明显,并能持续到停药后半年,尤其是血CXCL9水平,干扰素α-2b的抑制效果最明显。
综上所述,与单用ADV和单用干扰素α-2b相比,ADV联合干扰素α-2b能显著提高CHB的临床疗效,增强细胞免疫活性,抑制外周血 CXCL9,CXCL11,CCL20的水平。
