弹簧圈或联合支架栓塞治疗大脑中动脉M1末端分叉处动脉瘤21例
2018-12-13陈光贵罗来兵魏巍马术强李春国
陈光贵,罗来兵,魏巍,马术强,李春国
(安徽省六安市人民医院·安徽医科大学附属六安医院, 安徽六安237005)
大脑中动脉瘤是约占颅内动脉瘤总数的18%~20%。大脑中动脉M1末端分叉处因血管解剖因素及血流动力学因素导致其是颅内动脉瘤好发部位之一,约占大脑中动脉瘤的85%,其余15%位于大脑中动脉其他部位[1~3]。大脑中动脉瘤以抽搐、轻偏瘫、精神症状等大脑中动脉供血区的缺血症状及局部占位症状为主要临床表现,瘤体位于优势侧者可伴随失语。弹簧圈栓塞是目前临床常用的颅内动脉瘤治疗方法。大脑中动脉血管解剖结构及动脉瘤形态的特殊性,导致该部位部分动脉瘤单纯采用弹簧圈栓塞治疗效果较差,并可能影响分支血管而导致脑梗死等并发症。弹簧圈联合支架栓塞治疗大脑中动脉血管瘤是目前的研究热点。2014年1月~2017年12月,我们采用弹簧圈或联合支架栓塞治疗了21例大脑中动脉M1末端分叉处动脉瘤患者,临床效果较好。现报告如下。
1 临床资料
我院同期收治的大脑中动脉M1末端分叉处动脉瘤患者21例,其中男8例、女13例。年龄46~71岁,平均56岁。颅内动脉瘤Hunt-Hes分级为Ⅰ级2例、Ⅱ级8例、Ⅲ级7例、Ⅳ级4例。21例患者入院时皆行头颅CT检查证实为大脑中动脉M1末端分叉处动脉瘤,头颅CTA检查明确瘤体形态、局部血管条件等。21例患者共22个动脉瘤,其中1例为多发颅内动脉瘤(2个动脉瘤,其中未破裂动脉瘤1个,曾因右侧大脑前动脉A4段大型动脉瘤破裂出血行开颅血肿清除+瘤颈夹闭术,左侧大脑中动脉M1末端分叉处微小动脉瘤,当时未予处理,随访2年行DSA检查提示A4段动脉瘤夹闭满意,无复发征象,但M1末端分叉处动脉瘤进行性增大),其余20例患者均为破裂动脉瘤。21患者均行全脑血管造影(DSA),小型动脉瘤16例(瘤体直径<5 mm,其中瘤体直径<3 mm的微型动脉瘤1例)、一般型动脉瘤(瘤体直径5~15 mm)5例,按瘤颈宽窄分为窄颈动脉瘤8例、宽颈动脉瘤9例、相对宽颈动脉瘤4例。本研究经本院伦理委员会批准通过。患者及其家属均签署知情同意书。
21例患者均采用全麻和全身肝素化,Selding′s技术穿刺右侧股动脉,6F ENVOY导引导管置颈内动脉岩骨管下方,如颅外段血管迂曲明显,采用长鞘及Navien导引导管[4],根据患侧颈内动脉3-D旋转造影及三维重建血管成像,多角度分析瘤体形态、直径、周围血管条件及其关系,选定几个工作角度。窄颈动脉瘤单纯用弹簧圈栓塞,相对宽颈动脉瘤栓塞时支架微导管放置在可能需要放置支架的载瘤血管内,根据栓塞情况酌情决定是否放置支架,如不需放置支架,栓塞完毕后拆除支架微导管。宽颈动脉瘤采用支架辅助弹簧圈栓塞。术中动脉瘤破裂出血1例,立即予鱼精蛋白中和肝素和控制性降低血压后出血很快停止,术后复查头颅CT提示少量出血。未用支架辅助栓塞的患者术后常规给予补液、扩容、预防脑血管痉挛等治疗。根据头颅CT所示积血情况,酌情行腰穿释放血性脑脊液或持续腰大池引流。如用支架辅助栓塞的患者,术后常规给予低分子肝素钙、阿司匹林、硫酸氢氯吡格雷。患者麻醉复苏后如反应良好,后意识及病灶对侧肢体肌力变差,即考虑支架内血栓形成可能,及时予盐酸替罗非班注射液 5~8 mL静推,后3~5 mL/h静脉持续泵入,症状即可改善。溶栓及抗凝治疗期间应注意监测凝血功能。
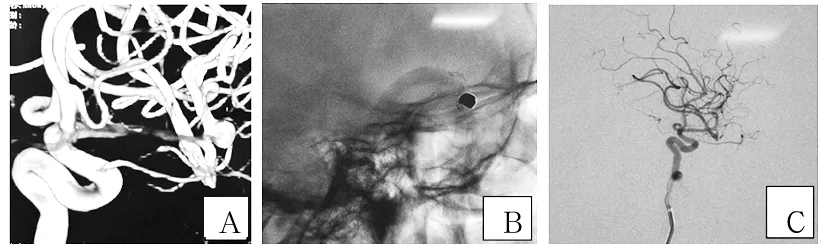
注:A为栓塞术前3D-DSA重建图像(提示M1狭窄明显);B为术中LVIS支架置入M1和载瘤血管内图像;C栓塞术后即刻造影(提示瘤腔致密栓塞,M1狭窄缓解,血流改善)。
图1LVIS支架辅助栓塞大脑中动脉M1末端动脉瘤的影像学资料
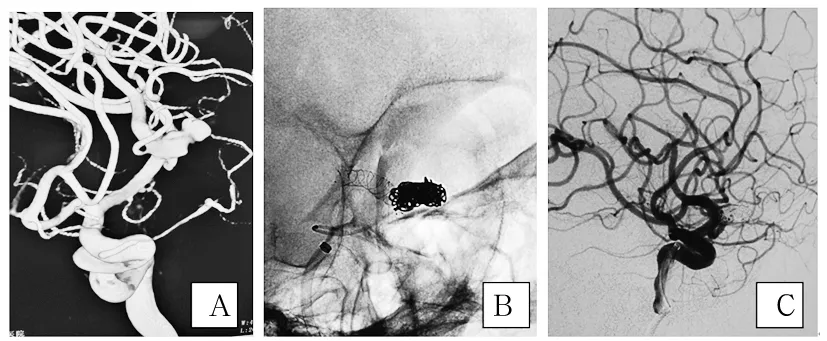
注:A为栓塞术前3D-DSA造影血管重建图像;B为Lvis支架置入M2段载瘤血管内(支架近端封堵瘤颈口);C为栓塞术后即刻造影(显示各血管通畅良好)。
图2LVIS支架辅助栓塞M1末端分叉处动脉瘤影像学资料
21例患者均顺利完成栓塞治疗,其中单纯采用弹簧圈栓塞治疗8例、弹簧圈联合支架栓塞治疗13例(宽颈动脉瘤中联合Solitaire 支架辅助栓塞2例、Enterprise 支架辅助栓塞4例、Lvis 支架辅助栓塞3例,相对宽颈动脉瘤采用支架微导管辅助栓塞4例)。见图1、2、3。术后即刻造影,按照改良Raymond分级为Ⅰ级15例、Ⅱ级5例、Ⅲ级1例。 18例随访6~30个月,随访期间均无动脉瘤再破裂出血,无肢体瘫痪及其他并发症发生。DSA检查提示动脉瘤复发1例,其余均无复发。
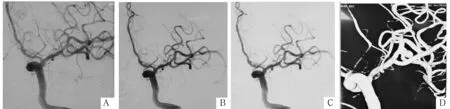
注:A为栓塞术前造影(提示M1末端分叉处窄颈动脉瘤);B为弹簧圈栓塞过程中图像(瘤体形态明显改变及瘤颈处破裂出血); C为栓塞术后即刻造影图像(提示瘤腔致密栓塞,瘤颈口少许残留); D为栓塞术前3D-DSA造影血管重建图像(提示瘤颈处有突起小泡)。
图3栓塞术中瘤体形态变化伴破裂的影像学资料
2 讨论
颅内动脉瘤破裂出血的致残率及致死率均较高。目前介入栓塞已是治疗颅内动脉瘤的主要方法之一。大脑中动脉M1末端分叉处动脉瘤无论采用开颅夹闭还是介入栓塞都存在争议,有学者认为该部位动脉瘤多为宽颈,常有穿支血管从瘤体发出,不适合介入治疗,如开颅夹闭,动脉瘤位置相对表浅,容易暴露、分离,且可避开从瘤体发出的分支血管,因此主张开颅夹闭。但也有学者认为该部位动脉分支变异多见,瘤体往往被分支血管包绕,或被临近血管遮挡,导致开颅处理动脉瘤颈时误夹分支血管致脑梗死,或瘤体夹闭不全,也可能导致载瘤动脉狭窄[5]。出血时间较长者瘤体表面可能有纤维黏连,术中分离瘤体困难,甚至可能导致动脉瘤破裂,宜首选介入治疗。介入栓塞与开颅夹闭比较,具有创伤小、风险低、并发症少等优点,且患者家属易接受。
对于窄颈动脉瘤单纯采用弹簧圈栓塞即可达到致密闭塞瘤腔目的,而对于宽颈动脉瘤,单纯弹簧圈栓塞往往难以达到致密栓塞,并可能影响载瘤动脉及分支血管而产生脑梗死等并发症。对于宽颈动脉瘤应采用支架辅助弹簧圈栓塞,常用支架有Eenterprise、Solitaire和 Lvis支架等[6]。具体采用何种及何规格的支架,应根据动脉瘤的大小、形态、M1及其分支血管条件和术者经验综合考虑。一般的,支架放置时横跨瘤颈口两端,宽颈动脉瘤置入支架具有以下优点:遮挡弹簧圈脱入载瘤动脉,增加致密栓塞可能;改变血流动力学,减缓血流对瘤壁的冲击;血管内皮细胞可通过支架匍匐生长,封闭瘤颈口。如M1痉挛明显,支架可放置在M1及载瘤血管内,因支架的径向支撑作用而改善M1血流,但如血管粥样硬化致血管狭窄置入支架应慎重,因支架置入后可能进一步影响血流。如M1不狭窄,而瘤颈口所在分支血管较粗大和平直,可选相应规格的LVIS支架,精确地将其放置在载瘤血管内,支架末端封堵住瘤颈口。这样,既能起到栓塞动脉瘤、减轻血流对瘤腔的冲击力,又不影响M1及其他分支血管血流。支架释放方式有前释放、后释放、半释放等,建议尽量采用半释放技术,因为此时支架既能起到遮挡弹簧圈从瘤腔脱入载瘤血管作用,又尚未完全压住弹簧圈微导管,便于调整其位置,尤其栓塞瘤颈时减少破裂风险,也便于回收支架重新释放。为了尽量避免置入支架可能产生的并发症及降低患者经济负担,对于某些相对宽颈动脉瘤可不用支架[6~8]。但对于在栓塞术前尚不能确定是否使用支架的患者,为防止栓塞过程中因弹簧圈脱入载瘤动脉影响血流才上支架导管的被动局面,可先用微导丝引导支架微导管进入相应载瘤血管内适当位置,做好释放支架的准备工作,如在栓塞过程中和/或栓塞后弹簧圈突入载瘤动脉,可及时放置支架,将脱出的弹簧圈压回瘤腔。栓塞完毕后如瘤腔填塞满意,弹簧圈无脱出,考虑不用置入支架,此时应缓慢拆除支架微导管,拆除支架微导管时最好用微导丝辅助拆除,支架微导管头端临近瘤颈口时微导丝应在微导管头端外载瘤动脉较远处,待支架微导管头端完全退过瘤颈口时才缓慢回撤微导丝。微导丝牵引支架微导管头端不会弹跳入瘤颈而带出已填塞好的弹簧圈,同时拆除支架微导管时如发现弹簧圈脱出,微导丝牵引可再将支架微导管推送至远处,采用支架后释放技术放置支架。
为了让患者获得良好的预后,避免术中动脉瘤破裂出血相当重要。术者除了操作轻柔之外,还要对各种栓塞材料的物理结构及特性有所了解,这样便于术中选择最合适的栓塞材料。栓塞过程中术者除了操作轻柔之外,还应注意观察瘤体形态的变化,如瘤体形态发生明显变化,提示动脉瘤有破裂可能,此时可酌情停止手术,待后期随访观察。如术中动脉瘤破裂出血,立即予鱼精蛋白中和肝素,并控制性降低血压,继续填塞弹簧圈止血,此时应选择直径较小、长度较短、质地较软的弹簧圈,防止填塞时继续撑破动脉瘤,经过处理后如出血停止,则应酌情停止手术,即使瘤腔填塞不满意也不建议继续填塞弹簧圈而追求致密栓塞,建议短期内随访,可行二期修饰性填塞。术后及时复查头颅CT,如血肿量大,局部占位效应明显,必要时开颅清除血肿及去骨瓣减压。破裂如发生在瘤底,迅速填塞弹簧圈出血往往较容易止住,但如瘤颈处破裂出血,继续填塞弹簧圈时有可能撕裂瘤颈口,造成灾难性结果。为避免此类情况发生,本研究认为,术前应注意多角度观察动脉瘤形态,尤其瘤颈处有无突起小泡,如有突起小泡,填塞弹簧圈时更应慎重,多角度观察填塞结果,因为为防止动脉瘤复发,致密栓塞瘤颈口相当重要,在力求致密栓塞瘤颈时可能致小泡破裂。另外,栓塞瘤颈时所选弹簧圈直径应稍小于瘤颈直径,且填塞时力求缓慢,可半圈半圈缓慢推送弹簧圈,让其自行寻找空间,对于老年患者或瘤颈处血管粥样硬化/钙化明显的患者,不强求致密栓塞瘤颈,随访观察[9,10]。
综上所述,血管内介入栓塞治疗大脑中动脉M1末端分叉处动脉瘤的临床效果较好。根据大脑中动脉瘤形态及局部血管条件采用个性化的血管内介入治疗方案,疗效安全可靠。
