miRNA-19a对结肠癌细胞增殖活性的影响
2018-12-13贺亚峰
杨 庚 李 昱 贺亚峰
(西安市武警工程大学医院检验科,陕西 西安 710086)
结肠癌在大多数国家的发病率呈上升趋势〔1~3〕,资料显示世界上新患结肠癌约120万例/年,而死于此病的约60万例/年〔4~6〕,结肠癌患者5年生存率仍然少于10%〔7〕。目前miRNA(miR)与肿瘤的相关性研究已成为热点〔8〕。miR与肿瘤的发生发展及其细胞凋亡增殖等相关机制的调控有关〔9〕,由20~25个核苷酸组成的内源性非编码小RNA〔10〕,能与靶基因 3′非翻译区域的结合位点互补或不完全互补,促进其mRNA 降解或抑制翻译参与细胞生长、增殖、分化、凋亡等多个生物学过程〔11〕。多项研究证实不同差异的miR存在于结肠癌中〔12,13〕。而文献指出在结肠癌高表达的一类miR就是miR-19a〔14~16〕。miR-17-92是首个被发现的非编码致癌基因族〔17〕,该家族包括6个成员:miR-17、miR-18a、miR-19a、miR-20a、miR-19b和miR-92a〔18〕。其中miR-19在多种癌症中高表达,使其凋亡能力减低〔19,20〕。上调miR-19使细胞增殖和恶变作用加强,是通过抑制B细胞淋巴瘤中抑癌基因同源性磷酸酶-张力蛋白(PTEN)的表达途径实现的〔21〕。源于各种组织的miR表达谱可能存在差别〔19,22〕,当检测到异常的miR时,可根据其表达谱对多种低分化肿瘤进行分类〔15,23〕,它还与细胞周期的调控〔24〕及治疗时药物的敏感性相关〔25〕,由此可见miR对结肠癌的三级预防及防止复发等方面的用途值得深入探究。本文探讨miR-19a对结肠癌LoVo细胞周期、细胞增殖凋亡及其侵袭力的作用。
1 材料与方法
1.1材料 结肠癌LoVo细胞购自中国医学科学院,由陕西省医学实验动物中心实验室冷冻保存。胎牛血清(FBS)、DMEM培养液(Gibco公司);0.25%胰酶(Hyclone公司);Lipofectamine2000(Invitrogen,美国);miR-19a模拟物、抑制物(GenePharma,上海); CCK8试剂盒(上海和元生物);碘化丙啶(PI)试剂盒(美国BD公司);侵袭小室(Sigma 公司); 人工基质胶(南方医科大学研究所)。
1.2结肠癌LoVo细胞体外培养建立实验模型及分组 实验模型建立:冻存于液氮中的LoVo细胞复苏后,在5%二氧化碳(CO2)、湿度饱和的条件下,并将箱内温度设为37℃,DMEM培养液中加入100 μg/ml链霉素和100 μg/ml青霉素及10%灭活胎牛血清,然后进行培养,注意在培养液有变化时换液。细胞长满瓶底70%~80%时传代一次。细胞传代后弃掉全部培养液,加入适量的磷酸盐缓冲液(PBS)将其清洗干净,导出,加入0.25%胰酶37℃消化2~3 min。当镜下发现胞质回缩、细胞间隙扩大时,为停止其消化需要加入DMEM培养基。待用工具反复轻轻吹打细胞形成单细胞悬液后,1 000 r/min离心5 min,倒掉上清液。用新的含10%血清的DEME重悬细胞,接种在新的培养板中,取对数生长期的LoVo细胞为实验细胞,将其铺于6孔板中,即为实验模型。实验分组:转染miR-19a模拟物组、空白对照组、转染miR-19a抑制组。
1.3脂质体介导miR-19a转染人结肠癌LoVo细胞 取对数生长期LoVo细胞,根据Lipofectamine2000说明书按照步骤转染等量的miR-19a模拟物和miR-19a抑制物,100 pmol羧基荧光素(FAM)标记的hsa-miR-19a模拟物或hsa-miR-19a抑制物,分别加入5 μl Lipofectamine2000与250 μl Opti-MEM,混合,室温下孵育5 min。将稀释液轻轻摇匀,使其充分混合后室温下孵育20 min,以形成转染复合物。转染复合物需加入实验组的每个孔内,然后余下的孔每个都需要补齐无血清DMEM到2 ml,且对照组也加入。转染后6~8 h更换为2%FBS培养基2 ml,置37℃常规培养待检测,再等1~2 d后即可检测〔26〕。
1.4检测转染后miR-19a基因的表达 实时荧光定量(qRT)-聚合酶链式反应(PCR):从转染miR-19a模拟物或抑制物24 h后的LoVo细胞中提取总RNA,1 μg总RNA用于逆转录,反应条件为16℃ 30 min,42℃ 30 min及85℃ 5 min 1 μl RT产物构建20 μl PCR体系扩增miR-19a及GAPDH,引物序:miR-19a:正义:5′-GGAGTTCCTGGACCAGTACG-3′,反义:5′-TTCTTGTGCTTGTG CCATGT-3′;GAPDH:正义5′-AGAAGGCTGGGGCTCATTTG-3′,反义5′-AGGGGCCATCCACAGTCTTC-3′。mRNA扩增参数为95℃预变性5 min,95℃ 15 s,55℃ 30 s,72℃ 30 s,扩增40个循环。miRNA扩增参数为95℃预变性5 min,95℃ 15 s,60℃ 1 min,扩增40个循环。相对表达量用2-△△Ct表示,其中SOCS3 mRNA的△Ct=Ct(SOCS3 mRNA)-Ct(GAPDH),miR-19a的△Ct=Ct(miR-19a)-Ct(U6),△△Ct = △Ct处理组-△Ct对照组〔17〕。
1.5利用CCK8试剂盒检测细胞的增殖能力 将1.3中各组细胞于转染后每过12 h给予100 μl/孔的CCK8。37℃孵育2 h后用酶联免疫检测仪在450 nm波长下测定各孔吸光度,取各组平均吸光度,每组实验重复3次〔17〕。
1.6流式细胞术检测miR-19a对细胞增殖周期、细胞凋亡的影响 将1.3中各组细胞2 000 r/min离心5 min,第一次加入PBS洗涤2次,再离心去除PBS,离心后加入1 ml预冷乙醇,在4℃的温度下一夜后重复操作即第二次加入含0.3% Triton和50 μg/ml RNaseA的PBS洗涤细胞2次,最后37℃孵育30 min离心,再加PBS洗2次后便可收集。将PI染液700 μl加入收集好的细胞中,在37℃避光条件下染色15 min。取104个细胞用于测定结果,取得样品后软件分析计算DNA含量得出细胞周期百分比。
培养好的LoVo细胞接种在6孔板内,5×105个/孔,第2天待其贴壁后转染细胞,并将24、48 h的LoVo细胞置于试管中,按上述分组离心10 min(2 000 r/min)后弃掉上清液,用PBS 清洗2遍,在70%~80% 冰乙醇内保存,-20℃固定2 h以上,再离心10 min(2 000 r/min),PBS漂洗后将PI染料150 μl 置于每孔,在室温避光的条件下孵育30 min,过400目网筛后上机测得结果〔26〕。
1.7细胞侵袭小室法检测细胞的体外侵袭力 首先构建侵袭小室,用5×105个/ml的250 μl细胞悬液,加入铺好基质胶的Boyden小室的上室,将其置于24孔板中,而下室的每个孔中需加入一定条件下的200 μl培养液即建立好小室模型,随机分组(按上述要求)。将其置于含5%CO2的37℃培养箱内,等1~2 d取出小室。用工具擦除聚对苯二甲酸乙二醇酯(PET)膜上表面残留的细胞和基质凝胶,随即用70%甲醇浸泡PET 膜的下表面,固定30 min,再取出用未结合型苏木素染色10 min。染色后在光镜下记录上、下、左、右、中5 个角度下室面的细胞数,结果取均数〔27〕。
1.8统计学处理 采用SPSS20.0软件行t检验。
2 结 果
2.1miR-19a基因的表达 转染miR-19a模拟物组miR-19a水平(0.80±0.09)较空白对照组(0.44±0.04)明显升高(P<0.05),转染miR-19a抑制物组miR-19a水平为(0.23±0.02),各组间有统计学意义(P<0.05);并且说明miRNA-19a在结肠癌LoVo细胞呈高表达,见图1。

图1 各组miR-19a基因的表达
2.2细胞的增殖能力 转染miR-19a模拟物组LoVo细胞的增殖能力(1.58±0.06)较空白对照组(1.06±0.05)明显升高(P<0.05)。转染miR-19a抑制物组LoVo细胞增殖能力(0.83±0.04)较空白对照组明显下降(P<0.01)。提示miR-19a与结肠癌LoVo细胞的增殖能力呈正相关。
2.3细胞增殖周期及细胞凋亡 与转染miR-19a模拟物组和空白对照组相比,转染miR-19a抑制物组的凋亡率明显升高,而且G2/M期所占的比例显著增加,差异有统计学意义(P<0.05),见表1。

表1 各组细胞周期分布及细胞凋亡比较
与转染miR-19a抑制物组比较:1)P<0.05
2.4细胞的体外侵袭力 转染miR-19a模拟物的侵袭能力大于其他两组。见图2。
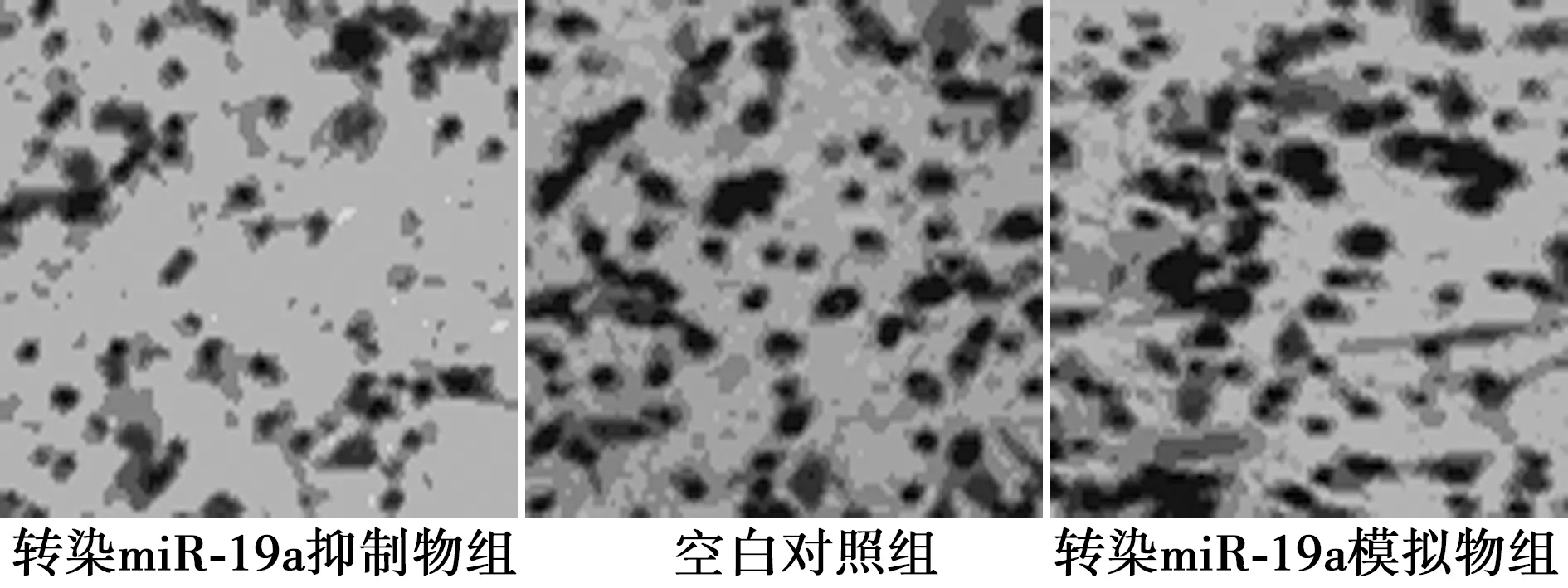
图2 各组LoVo细胞的侵袭能力(×200)
3 讨 论
文献指出,肿瘤组织中的miR也存在于癌症患者的血液循环中,并且能反映它在组织中的表达程度,进一步说明miR对肿瘤早期诊断、早期预防及预后具有重要的作用〔28~30〕。研究显示,miR在指导癌症的诊断和治疗方面有重要的作用〔31,32〕。研究显示〔7〕,miR存在于结肠癌患者血液和结肠癌组织中,这类独特小RNA在研究结肠癌的领域功不可没。郭运生等〔11〕用软件Pictar,TargegtScan 预测miR-19a的靶基因,发现它能与肝癌缺乏基因(DLC)1的3′UTR 端结合,并验证了它与DLC1在促进结肠癌细胞增殖方面的作用。miR-19a在其他细胞中,通过靶定肿瘤坏死因子-α,Cullin5,正次黄嘌呤核苷酸脱氢酶(IMPDH)1和氨肽酶样蛋白1抗体(NPEPL1)等靶基因调控细胞的生物学行为〔33~35〕。本文结果认为miR-19a在结肠癌中有致癌基因的功能。现有研究表明,miR-19a 还可以对非小细胞肺癌起作用,原理就是通过调控组织因子表达和减少PC9细胞的体外增殖〔36,37〕。miR-19a对血液系统相关疾病的诊断也有一定作用〔38〕。而对于结肠癌患者,miR-19a致癌基因的作用应该是通过影响肿瘤细胞的增殖活性,即上调miR-19a的表达,细胞体外增殖能力增强,细胞周期S期细胞数增多,细胞凋亡减少,细胞的侵袭力增强;下调miRNA-19a的表达,细胞体外增殖能力降低,细胞周期S期细胞数减少,细胞凋亡增加,细胞的侵袭力降低。
