原发性醛固酮增多症肾损害危险因素分析
2018-12-13,,,,,,
,,,,,,
原发性醛固酮增多症(PA)的患病率占高血压病人的5%~18%,成为最常见的继发性高血压之一。国内外研究发现,PA病人肾脏损害较原发性高血压(EH)病人更严重[1],特征性的表现为肾小球超滤过和尿蛋白的排泄增加[2]。肾小球超滤过是肾功能下降的代偿性反应,可能直接与慢性肾脏疾病(chronic kidney disease)的进展相关[3]。大量临床试验证实PA病人肾素-血管紧张素-醛固酮系统及电解质紊乱,低钾及高醛固酮可导致肾脏损害[4]。随着疾病的进展肾脏呈现低滤过、高肾素状态,从最初的肾脏功能上的改变发展为不可逆的结构改变[5]。本研究对409例PA病人与444例EH病人临床资料进行分析,研究PA病人肾脏损害及相关危险因素,有助于早期干预及防止PA病人肾脏疾病的进展。
1 资料与方法
1.1 一般资料 选取2005年4月—2016年3月瑞金医院高血压门诊及特需心血管内科病房收治的PA病人409例,其中男228例,女181例;年龄21岁~76岁(48.79岁±11.22岁);高血压病程(9.24±8.62)年。同时选取与PA组在性别、年龄、高血压病程、血压水平相匹配的EH病人(EH组)444例,其中男274例,女170例;年龄17岁~81岁(49.59岁±15.13岁);高血压病程(9.31年±7.88年)。所有入选者记录一般临床资料及检测相关生化指标。
1.2 PA入选标准[6]取立位血浆醛固酮(PAC)与血浆肾素活性(PRA)比值,比值>240为可疑PA病人。PA定性标准:2005年6月—2007年4月的住院病人参考“金标准”氟氢可的松抑制试验[7],即连续4 d口服氟氢可的松,每6 h 0.1 mg,保证有足够的钠盐摄入,并纠正可能发生的低血钾。第5天早晨测血钾3.5 mmol/L~4.5 mmol/L,24 h尿钠/体重>3,立位PAC>60 ng/L,且血浆肾素活性≤1 ng/(mL·h),氟氢可的松抑制试验阳性可确诊为PA。因氟氢可的松片国内停产,自2007年4月—2016年3月住院病人采用静脉盐水负荷试验[8],即在4 h内静脉输注生理盐水2 L,血肾素<1 ng/(mL·h),血钾>4.0 mmol/L条件下,不能将血醛固酮水平抑制到60 pg/mL以下者,确诊为PA。
1.3 诊断标准 肾脏损害:参照美国肾脏基金会轻度肾功能损害的诊断标准[9],即估算肾小球滤过率(eGFR)<60 mL/(min·1.73 m2)。肾小球超滤过滤:临界值范围[10]为125 mL/(min·1.73 m2)~175 mL/(min·1.73 m2),本研究取eGFR>125 mL/(min·1.73 m2)。
1.4 排除标准 ①其他类型继发性高血压:肾性高血压(肾实质性高血压、肾血管性高血压)、内分泌性高血压(嗜铬细胞瘤、库欣综合征)、主动脉缩窄引起的高血压、呼吸睡眠暂停综合征引起的高血压和药物引起的高血压(如口服避孕药、激素等)。②糖尿病、肾功能不全及其他严重内科疾患。③排除药物影响,双氢吡啶类钙离子拮抗剂、血管紧张素转化酶抑制剂(ACEI)和血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂、α甲基多巴和可乐定以及非甾体类抗炎药至少停用2周以上;利尿剂至少停用4周以上。停用上述药物期间,病人血压可用非双氢吡啶类钙离子拮抗剂和α受体阻滞剂控制。
1.5 方法 病人住院次日空腹抽静脉血测定血肌酐、电解质,依据MDRD公式[11]估算eGFR=175×血清肌酐值-1.234×年龄-0.179[×0.79(女性)]。测定晨起空腹立位2 h血浆肾素活性、血浆PAC,测定当日24 h尿醛固酮(24 h UAld)、24 h尿蛋白定量(24 hPr)、24 h尿微量白蛋白(24 hMAU)、24 h尿电解质(Na、K)。尿微量白蛋白与肌酐比值(MA/Cr):收集清晨首次中段尿,参考2007年欧洲高血压指南,MA/Cr=MAU×10/UCr。同位素肾小球滤过率(GFR)检查:99mTC-DTPA肾动态显像法,使用GE-Imfinia/HG型SPECT显像仪,利用Gates法计算GFR,最后用体表面积进行矫正。血浆醛固酮浓度(试剂盒:DSL-8600,USA)、血浆肾素活性测定(试剂盒:北京北方生物技术研究所提供)均采用放射免疫法,由上海市高血压研究所测定。

2 结 果
2.1 PA组与EH组一般资料及生化指标比较(见表1) PA组性别、年龄、高血压病程、收缩压、舒张压、心率、体重指数(BMI)、血钠、血肌酐与EH组比较差异无统计学意义(P>0.05)。PA组尿钠、尿钾、PAC、UAld、eGFR、MA/Cr、GFR、24 hMAU、24 hPr高于EH组(P<0.01);而PA组血钾、PRA低于EH组(P<0.01)。
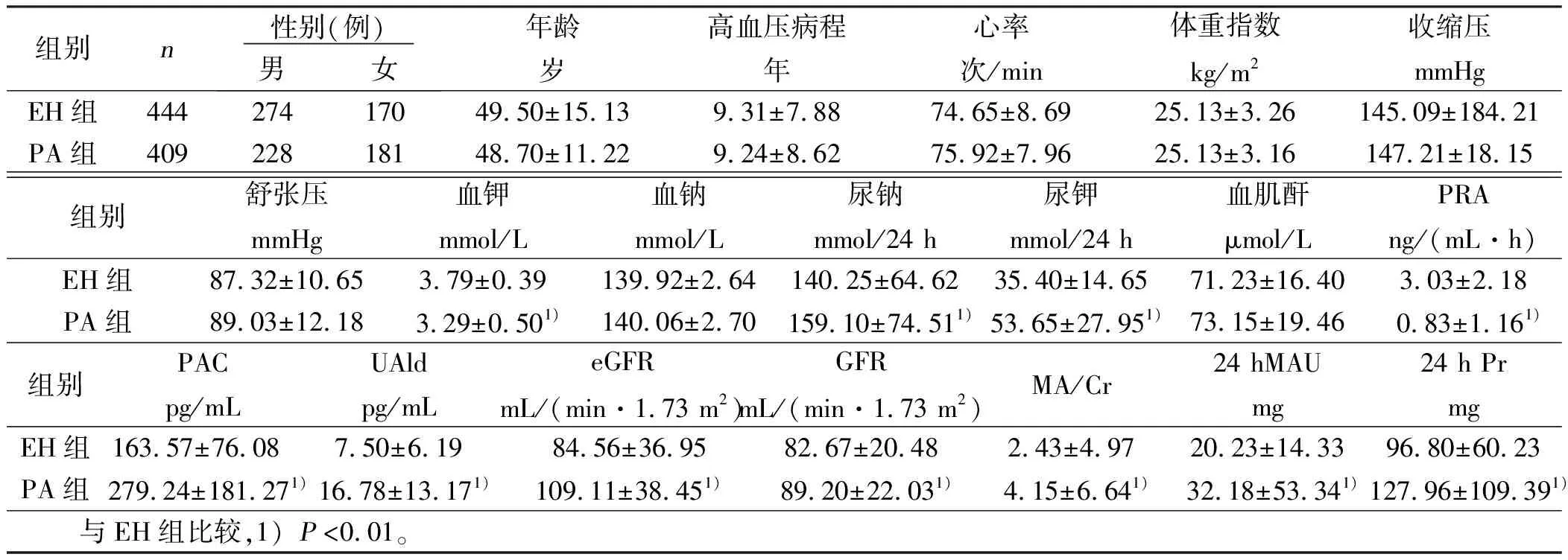
表1 EH组与PA组一般临床资料及生化指标比较
2.2 两组肾脏损害和肾小球超滤过发生率比较 PA组肾脏损害发生率与EH组相比差异无统计学意义(χ2=0.853,P>0.05);而PA组肾小球超滤过发生率高于EH组[25.67%与18.02%,χ2=7.344,P=0.008]。详见表2。
2.3 EH组与PA组肾脏损害、肾小球超滤过率特征 PA组肾脏损害病人血钠、PAC、UAld、MA/Cr、24 hPr显著高于EH组(P<0.05);PRA、血钾水平显著低于EH肾脏损害组(P<0.05)。详见表3。PA组肾小球超滤过病人尿钾、尿钠、PAC、UAld、MA/Cr高于EH组(P<0.05);PRA、血钾、血肌酐水平显著低于EH组(P<0.05)。详见表4。

表2 两组肾脏损害和肾小球超滤过发生率比较 例(%)

表3 EH组与PA组肾脏损害特征
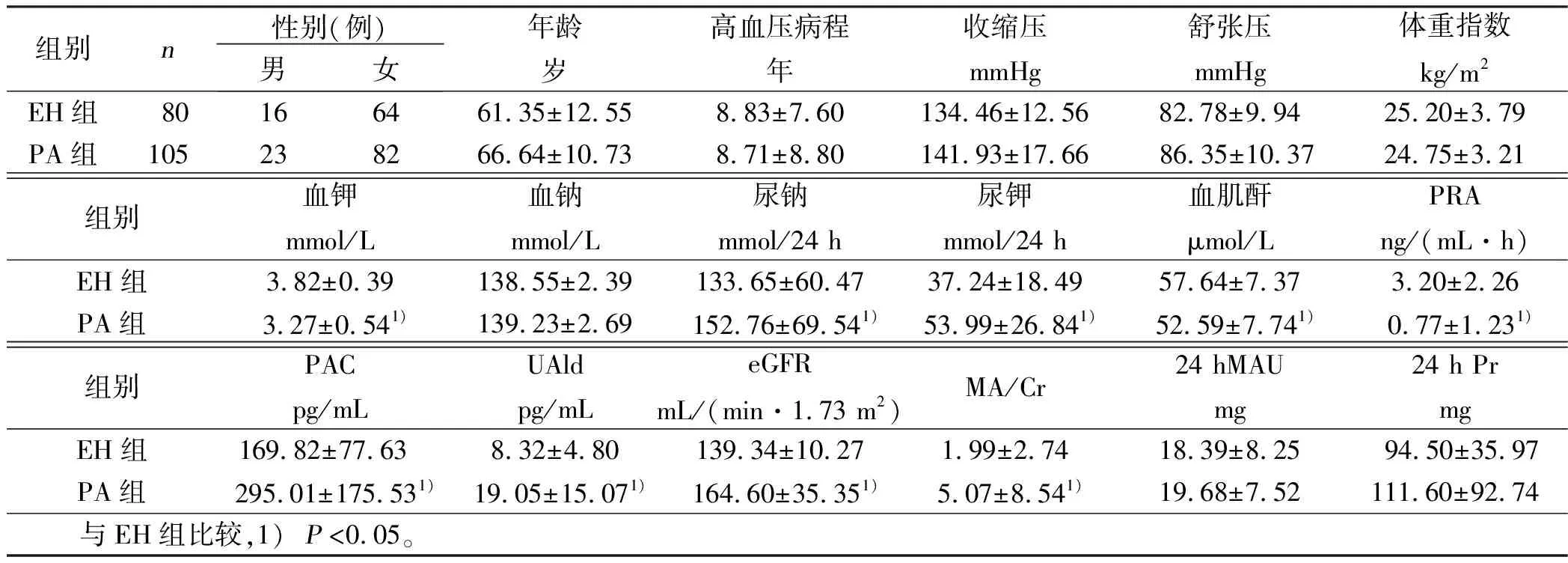
表4 EH组与PA组肾小球超滤过率特征
2.4 相关性分析 以性别、年龄、高血压病程、收缩压、舒张压、心率、体重指数、血钠、血钾、血肌酐、尿钠、尿钾、PAC、PRA、24 hUAld、MA/Cr、24 hMAU、24 hPr为自变量,eGFR作为应变量,进行相关性分析,结果显示:PA组eGFR与年龄、体重指数、血肾素活性呈负相关(P<0.01),EH组eGFR与年龄、体重指数呈负相关(P<0.01)。详见表5。
2.5 Logistic回归分析 利用SPSS统计软件建立PA肾脏损害模型行回归分析,校正性别、年龄、体重指数、高血压病程、血压水平后发现:PA组肾脏损害与PRA(r=0.800,P<0.001)呈正相关,与血钾水平呈负相关(r=-1.822,P=0.001)。回归方程:Y=0.80×PRA-1.822×血钾+3.568。详见表6。

表5 eGFR影响因素分析

表6 校正性别及高血压病程后PA组肾脏损害危险因素分析(n=409)
3 讨 论
本研究发现,PA组与EH组相比,具有更高的eGFR、GFR、24 hMAU、MA/Cr(P<0.01),且PA组肾小球超滤过病人MA/Cr高于EH组(P<0.05),表明PA与EH相比表现出更高的肾小球滤过率和尿微量蛋白排泄率,提示PA肾功能紊乱的特点可能是可逆性的肾小球超滤过导致了微量尿蛋白丢失的增加。肾小球超滤过和尿微量蛋白排泄增加可能是PA的特征性表现[2]。我国台湾的一项荟萃分析结果显示肾小球超滤过及尿蛋白排泄增加是PA继高血压后的特征,是PA肾脏损害的重要表现形式[12]。另一项临床研究则显示PA病人行单侧肾上腺切除术后,在术后3 d、2周、6个月肾小球滤过率明显下降,且发现术前肾小球高滤过率的PA病人是术后引起肾脏损害的主要危险因素[13]。
目前肾小球超滤过的进展和PA肾脏损害的关系也存在争议。Ribstein等[14]报道了25例肾上腺腺瘤病人,腺瘤切除术后随访6个月后,发现尿微量蛋白排泄率有显著降低。认为PA病人的肾小球超滤过和尿微量蛋白排泄增加是可逆性的肾功能紊乱,从某种程度上说,是肾脏功能上的改变而非肾脏结构的改变,是肾脏血流动力学的缺陷。Palatini等[15]对502例1级高血压病人随访7.8年后发现,肾小球超滤过能增加病人微量白蛋白尿的风险。微量白蛋白尿是肾脏衰竭和心血管事件的危险因素,尽管治疗后可很大程度被逆转,但不可否认的是,微量白蛋白尿是持续性肾小球超滤过的早期信号,最终可能导致肾脏结构的改变,和慢性肾脏疾病相关[5]。另一项临床研究结果显示,213例PA病人分别接受药物或手术治疗,最初具有较高的肾小球滤过率和尿微量白蛋白的PA病人,治疗后经随访1年,表现出更低的肾小球滤过率,进而发展为 慢性肾脏疾病[16]。 PA病人治疗前后肾小球滤过率变化的Meta分析结果也显示,PA病人无论是经手术治疗切除肾上腺组还是口服药物:安体舒通组治疗后肾小球滤过率都显著下降,提示PA病人治疗前高醛固酮血症相关的肾小球高滤过率可能掩盖了这类病人肾脏功能和结构的损害,由此更加要重视初诊PA病人的肾功能评估[17]。本研究中PA肾小球超滤过组显示较高尿微量蛋白的排泄,平均高血压病程9年,更要加强今后肾脏靶器官损害的监测及干预。
研究认为肾小球超滤过产生的机制可能为:PA病人自主高分泌醛固酮导致邻近肾小管钠的重吸收增加、肾小球内压的升高,钠潴留相关的高血压状态产生肾小球内血流动力学改变,破坏了肾脏的自我调节功能,包括:管球反射和肌源性自身调节[18],引起了肾小球超滤过;高血压诱导肾单位损失,残余肾单位的入球小动脉较出球小动脉扩张更加导致肾小球超滤过,从而使尿微量蛋白排泄增加,而长期的尿蛋白存在可能与不可逆性的肾结构损害相共存。
本研究发现,PA组血钾低于EH组,尿钾及尿钠高于EH组(P<0.01),提示PA病人与EH病人相比具有更严重的电解质紊乱。目前大量的临床研究证实,PA以自主高分泌醛固酮为特征,醛固酮的主要作用是在远端肾单位促进钠的重吸收从而维持钠和血容量平衡。醛固酮过度分泌可通过上皮钠通道和Na+-K+-ATP酶促进远曲小管和集合管排出H+及K+,而加强Na+、HCO3-的重吸收,引起低血钾和高尿钾[19]。慢性低血钾病理改变为特征性的肾小管间质损伤如上皮管状细胞空泡变性和间质纤维化,可诱导慢性肾衰竭。低钾血症时因细胞内酸中毒可刺激氨生成,引起补体旁路途径的激活,继之发生免疫细胞向基质浸润,进行性肾小管间质损害,持续数月后可出现不可逆的间质纤维化,最后导致肾小球硬化和肾小管间质纤维化并萎缩[20]。
本研究利用SPSS统计软件建立PA肾脏损害模型行回归分析结果显示,PA组肾脏损害与PRA(r=0.800,P<0.001,OR=2.225)呈正相关。有临床研究显示,PA病程早期可表现为肾素被抑制、肾小球超滤过,随着疾病的进展,持续尿蛋白,可呈现肾小球低滤过、高肾素状态,最后可导致不可逆性的肾结构损害[5]。本研究从PA肾脏损害模型行回归分析结果证实PA肾脏损害与肾素活性呈正相关。所以可以推测,PA病人从典型的临床特征:高醛固酮、低肾素逐渐转变为高肾素状态,将预示此类PA病人肾功能的进一步损害,需要及早治疗和干预。
研究PA病人靶器官损害情况对治疗及预后非常重要。在临床中,PA病人除了需要改善生活方式,控制体重,降低体重指数以及纠正电解质紊乱,还需要注意改善肾素-血管紧张素-醛固酮系统(RAAS)激活状态,尤其需关注高肾素状态的PA病人,预防慢性肾脏病进展。本研究为回顾性分析,存在一定局限性,未评估治疗后PA病人肾功能的改善情况和相关危险因素的特征,缺少肾活检对肾脏结构变化的病理诊断,有待于进一步前瞻性临床研究。
