十味芪黄益肾方对慢性肾衰竭大鼠肾纤维化的干预作用
2018-12-10张艳楠曹恩泽
吕 勇,张艳楠,金 华,王 东,曹恩泽
(安徽中医药大学第一附属医院肾内科,安徽 合肥 230031)
慢性肾衰竭(chronic renal failure,CRF)是慢性肾脏病(chronic kidney disease,CKD)进行性进展的共同结局,肾脏纤维化是其基本病理特征,探究CRF发病机制及延缓其病程进展是目前研究的热点。中医药在保护CRF患者残存肾功能,改善肾纤维化等方面具有确切疗效。依据曹恩泽辨治CRF的临床验案,结合现代电脑数据挖掘分析而总结出的辨治CRF的核心组方—— 十味芪黄益肾方[1],临床研究结果已显示其具有良好的疗效[2]。本实验通过腺嘌呤灌胃[3]建立肾纤维化CRF大鼠模型,观察该方对肾组织中转化生长因子-β1(transforming growth factor-β1,TGF-β1)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、肝细胞生长因子(hepatocyte growth factor,HGF)、纤维连接蛋白(fibronectin,FN)的影响,探究其抗肾纤维化的作用机制。
1 材料
1.1 动物 普通级SD雄性大鼠60只,均购自安徽省实验动物中心[生产许可证号:SCXK(皖)2011-002],体质量190~200 g,在安徽中医药大学实验室动物房适应性喂养1周。
1.2 药物与试剂 十味芪黄益肾方由生黄芪、槐米、煅龙骨、煅牡蛎各30 g,土茯苓15 g,生大黄、苍术、地龙、僵蚕各10 g,全蝎2 g组成,购于安徽中医药大学第一附属医院草药房,配制成2.4 g/mL水溶液。缬沙坦胶囊(国药准字H20040217,规格为每粒80 mg):由北京诺华制药公司生产,配制成0.002 g/mL的混悬液。腺嘌呤(批号A8626):由安徽欣乐生物技术有限公司提供。免疫组化法试剂TGF-β1(批号AD112007)、HGF(批号150420)和FN抗体(批号AE011910):均购自北京博奥森生物科技有限公司。α-SMA抗体(批号GR212262-3):购自上海源叶生物技术有限公司。
2 方法
2.1 动物模型复制及分组 适应性饲养1周后,将60只SD大鼠按照随机数字表[4]分为正常组15只,另45只用于复制模型(模型复制组),采用腺嘌呤灌胃[3]复制肾纤维化大鼠模型。操作步骤:第1~14天,按每千克体质量给予浓度为2.5%腺嘌呤混悬液200 mg灌胃,每日1次;第14~28天,按每千克体质量给予浓度为2.5%腺嘌呤混悬液200 mg灌胃,隔日1次。腺嘌呤灌胃累计总剂量每只不超过1.5 g。正常组用等量蒸馏水灌胃。大鼠在模型复制后第28天晚禁食12 h,第29天在大鼠目内眦采血2 mL,测血清肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)。模型组大鼠的SCr、BUN显著高于正常组,提示肾纤维化模型复制成功。模型复制过程中死亡2只大鼠,剩余43只大鼠被随机分为模型组13只、缬沙垣组15只和益肾方组15只
2.2 给药方法 模型复制后次日开始给各组大鼠灌胃,每日1次。益肾方组将十味芪黄益肾方中药水煎剂浓缩成每毫升含药量为2.4 g的混悬液,按每千克体质量10 mL的剂量灌胃;缬沙坦组将缬沙坦胶囊溶于温水中制成每毫升含药量为0.002 g的混悬液,按每千克体质量10 mL的剂量灌胃;正常组和模型组给予等量蒸馏水,按每千克体质量10 mL的剂量灌胃。疗程均为8周。
2.3 观察指标 研究期间每日各组大鼠称质量,记录并观察大鼠精神状态、活动情况、毛发光泽度、进食饮水量和二便情况。模型复制28 d后,各组大鼠目内眦采血2 mL,检测BUN、SCr,同时测定24 h尿蛋白(24-hour urinary protein,24hUPro)。各组大鼠于给药治疗8周后处死,处死前1天检测24hUPro;腹主动脉取血,采用生化法检测BUN、SCr;采用免疫组织化学法检测肾脏组织中TGF-β1、HGF、α-SMA、FN蛋白表达情况,采用ImagePro Plus多媒体彩色病理图像分析软件进行分析,检测染色部位蛋白阳性表达的平均光密度(mean optical density,MOD);采用苏木精-伊红(hematoxylin-eosin,HE)染色及Masson染色观察肾脏的组织形态学变化。

3 结果
3.1 一般情况比较 模型组大鼠于5~7 d后逐渐出现个体蜷卧,活动减少,皮毛欠光泽,食欲下降,尿量增加,尾巴湿冷,耳廓颜色变淡;14 d后出现成群蜷卧、眯眼、眼睑浮肿、目内眦颜色发白、皮毛干涩、脱毛、体质量减轻等现象。正常组大鼠状态无明显变化。经给药8周后,益肾方组和缬沙坦组大鼠上述状态改善,表现为食量及体质量较给药前增加,皮毛润泽度改善,活动度增加,目内眦及耳廓较给药前红润。益肾方组情况改善较缬沙坦组明显。而模型组上述表现明显加重,饮食量降低,体质量明显下降,目眦及耳廓苍白,皮毛干枯无光泽。因灌胃和过量应用麻醉药等原因,5只大鼠死亡,最后剩下55只大鼠,即正常组15只、模型组12只、缬沙坦组14只和益肾方组14只。
3.2 模型复制情况分析 模型复制28 d后,模型复制组大鼠SCr、BUN、24hUPro与正常组比较,差异有统计学意义(P<0.05),提示模型复制成功。见表1。

表1 造模28天后大鼠BUN、Scr和24hUPro比较
注:与正常组比较,#P<0.05
3.3 各组大鼠BUN、SCr、24hUPro水平比较 给药8周后,模型组、缬沙坦组、益肾方组BUN、SCr、24hUPro水平均高于正常组(P<0.05);与模型组比较,缬沙坦组和益肾方组BUN、SCr、24hUPro水平明显降低(P<0.05);与缬沙坦组比较,益肾方组BUN、SCr、24hUPro水平明显降低(P<0.05)。见表2。

表2 各组大鼠BUN、SCr、24hUPro水平比较
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05;与缬沙坦组比较,△P<0.05
3.4 各组大鼠肾组织TGF-β1、HGF、α-SMA、FN蛋白表达水平比较 TGF-β1、α-SMA、FN蛋白在正常组有少量表达,模型组、缬沙坦组和益肾方组表达水平均高于正常组(P<0.05);与模型组比较,缬沙坦组和益肾方组TGF-β1、α-SMA、FN蛋白表达水平均显著降低(P<0.05);与缬沙坦组比较,益肾方组TGF-β1、α-SMA、FN蛋白表达水平显著降低(P<0.05)。HGF在正常组基本不表达,模型组、缬沙坦组和益肾方组HGF蛋白表达水平均升高(P<0.05);与模型组比较,缬沙坦组与益肾方组均显著升高(P<0.05);与缬沙坦组比较,益肾方组HGF蛋白表达水平明显升高(P<0.05)。见图1、表3。
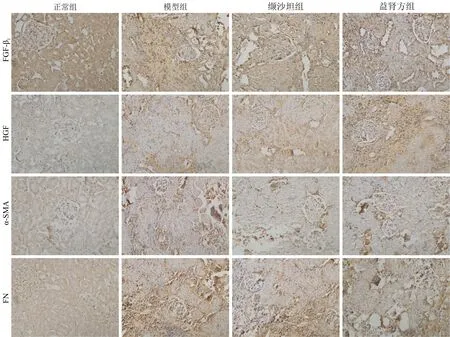
图1 各组大鼠肾组织TGF-β1、HGF、α-SMA、FN蛋白表达水平比较(免疫组织化学染色,10×40倍)

组 别nTGF-β1/MOD值HGF/MOD值α-SMA/MOD值FN/MOD值正 常150.150±0.0090.011±0.0020.068±0.0070.092±0.042模 型120.245±0.034#0.073±0.026#0.224±0.076#0.139±0.003#缬沙坦140.198±0.023*0.297±0.005*0.169±0.008*0.123±0.003*益肾方140.172±0.014*△0.322±0.066*△0.152±0.007*△0.103±0.002*△
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05;与缬沙坦组比较,△P<0.05
3.5 各组大鼠肾脏的组织形态学变化 正常组:肾脏组织结构(肾小管、肾小球和肾间质)无病理改变。模型组:肾间质内可见大量炎性细胞浸润及纤维增生,间质与小管分界不清;肾组织中可见肾小管萎缩、坏死与扩张明显,部分上皮细胞坏死;肾小球萎缩硬化、代偿性扩张及球囊壁粘连,小球数量减少。缬沙坦组:可见肾小管和部分肾小球中度扩张、粘连,肾组织中炎性细胞浸润和纤维组织中度增生。益肾方组:可见肾组织内少量炎性细胞浸润,肾间质轻度纤维化,肾小管管腔轻度扩张、部分萎缩坏死,肾小球轻度扩张、部分粘连。见图2。
4 讨论
肾脏进行性纤维化是CKD进展至CRF的特征性病理过程。肾脏在各种致病因子(如炎症、高血糖、高血压、脂代谢紊乱)作用下,肾脏固有组织细胞结构受到损害,产生细胞外基质(extracellular matrix,ECM)并逐渐大量积聚[5],导致肾小球硬化、肾小管间质纤维化和肾内血管硬化,取代正常肾脏结构,造成肾脏丧失功能。延缓CRF进展的关键是防止肾纤维化。腺嘌呤诱导的CRF模型是CRF的公认模型,本研究显示,模型组大鼠BUN、SCr显著高于正常组,提示肾纤维化模型复制成功。
正常肾组织无FN表达,当肾间质出现病变时FN表达增强,其变化与ECM变化趋势保持一致[6],在ECM产生与沉积中发挥重要介导作用。α-SMA被认为是肌成纤维细胞表达的特征蛋白,参与肾脏纤维化形成[7]。在人肾组织研究中,发现肾小管间质纤维化程度及肾功能恶化程度与肾小管间质内α-SMA表达水平呈正相关[8]。TGF-β是一种重要的促纤维化因子,在人体内只有TGF-β1,主要在肾脏组织中表达,在肾纤维化中发挥着重要作用[9-10]。HGF是一种纤维化负性调节因子,它在肾小球系膜细胞、小管间质细胞和内皮细胞均有表达,以多种方式作用于肾小管上皮细胞,发挥保护肾脏功效[11]。HGF还可以减少肾组织ECM沉积,减轻肾小管与间质纤维化[12]。
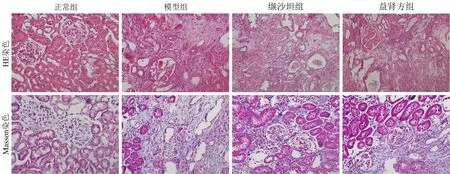
图2 各组大鼠肾脏的组织形态学变化(10×40倍)
CRF病因病机复杂多变,脾肾亏虚为本、瘀浊蕴结为标[13]。曹恩泽认为CRF的基本病机是以脾肾亏虚为本,湿浊壅阻为标,瘀血贯穿病程始终,依此立“清降”“清补”和“活血通络”法辨治CRF[14]。应用计算机数据挖掘技术对曹恩泽诊治CRF的临床医案予以辨证分型和处方用药分析,总结出其运用“清降补益通络法”辨治CRF的基本方药——十味芪黄益肾方[2]。方中生大黄清热解毒、泻下攻积,可使湿浊毒邪从大便而去,为君药。研究表明其有效成分大黄素可以通过促进骨形态发生蛋白-7的表达来发挥其抗肾间质纤维化进程的作用[15]。黄芪为补气要药,可补脾、肺、肾之气,研究显示黄芪多糖可以抑制大鼠肾间质纤维化的形成,保护肾脏[16]。虫类药物地龙、全蝎、僵蚕功专于活血通络、搜剔驱邪,与黄芪共为臣药。土茯苓解毒祛湿,槐米清热凉血与土茯苓相须为用,苍术燥湿健脾,三药共为佐药,助大黄清热、降浊、解毒。煅龙骨与煅牡蛎为矿石类药物,可以纠正患者的低钙血症和补充微量元素,且二药煅制后收敛功效增强,增加其对肠道毒素的吸附作用,助君药驱除毒邪而为佐使。
本研究结果显示,十味芪黄益肾方可有效改善腺嘌呤肾纤维化CRF模型大鼠的肾功能,降低尿蛋白水平,减轻其肾脏病理损害;该方能减少模型大鼠肾间质内炎性细胞浸润,改善肾间质纤维化和肾小球硬化程度。其作用机制可能与该方能下调肾纤维化过程中重要因子TGF-β1、α-SMA和FN水平,上调肾纤维化负性调节因子HGF的水平有关。
