LAMP实时浊度法快速检测食品中产志贺毒素大肠埃希氏菌
2018-12-07,,,,,,,
,,,,,, ,
(珠海出入境检验检疫局检验检疫技术中心,广东珠海 519000)
产志贺毒素大肠埃希氏菌(Shiga toxin-producingEscherichiacoli,STEC)是一种重要的食源性致病菌,能够分泌志贺毒素、引起宿主肠黏膜上皮细胞黏附及擦拭性损伤,有些STEC在临床上引起人类出血性结肠炎或血性腹泻,并可进一步发展为溶血性尿毒综合征(hemolytic uremic syndrome,HUS),这部分STEC被称为肠道出血性大肠埃希氏菌(enterohemorrhagicEscherichiacoli,EHEC)[1]。1982年美国首次报道分离出STEC O157∶H7,STEC在世界上许多国家引起了大规模暴发和流行,已成为危及全球性公共卫生的问题之一。2011 年5月至7月德国发生的STEC O104∶H4感染暴发疫情,波及部分欧洲其他国家及美国、加拿大等国家,HUS 报告病例数表明,这也是迄今为止全球范围内规模最大的EHEC食源性疾病暴发事件[2]。
志贺毒素是STEC引发疾病的关键毒力因子,包括志贺毒素1(Stx1)和志贺毒素2(Stx2)两类毒素,分别由stx1基因和stx2基因编码。志贺毒素基因是STEC的共有特征,使得通过核酸扩增试验检测志贺毒素基因对STEC进行快速筛检成为行之有效的方法[1]。STEC的检测可用以下3种方法分别为:检测样品对Vero细胞的毒性;通过抗原抗体反应进行免疫检测测定志贺毒素;核酸扩增试验检测stx1和stx2基因。Vero细胞毒性试验可以准确判定菌株产志贺毒素生物学活性的强弱,是检测STEC是否具有志贺毒素生物学活性的金标准方法,白莉等[3]对核酸扩增检测毒素基因的方法(stx-PCR)、Vero细胞毒性试验和酶联免疫试剂盒这3种方法在检测产志贺毒素大肠埃希菌的特异性和敏感性的差异进行了比较研究,结果表明3种方法都具有很好的特异性,stx-PCR方法和Vero细胞毒性试验较酶联免疫试剂盒敏感性更高,由于PCR方法可以弥补Vero细胞毒性试验周期长的缺点,推荐PCR方法作为实验室常规快速检测方法。
STEC的传统培养方法包括增菌、分离、生化与血清学鉴定等步骤,工作量大、检测周期长、费用高,准确度、检出率、灵敏度不尽如人意,在实际应用中大大受限。以PCR技术为代表的现代分子生物学技术的发展克服了传统方法的不足,在应对食品安全重大爆发事件其优势充分体现,如2011年5月至7月德国发生的STEC O104∶H4暴发事件中德国负责疾病防控与公众健康的权威机构-罗伯特·科赫研究所(Robert Koch Institute,RKI)和我国疾病预防控制中心应对这一紧急事件均应用了PCR技术[4-5]。
环介导等温扩增(Loop Mediated Isothermal Amplification,LAMP)技术是日本学者Notomi[6]2000年等发明的一种新型等温核酸扩增法,为基因快速检测提供了一种新的技术途径。LAMP采用4条特异性引物结合6个靶目标区域,比PCR特异性更强,闭管反应、不需电泳分析,避免了气溶胶的产生、不易污染,检测效率高,通常60 min左右可完成。LAMP实时浊度法通过实时浊度仪实时监测反应过程中所产生的副产物白色磷酸镁沉淀,实现对扩增全过程的实时监控,比LAMP终点法(显色肉眼观察法)引物筛选的效率更高、结果判定的准确性更强[7]。本研究使用的日本荣研生物公司的LA-320C型LAMP实时浊度仪可在启动LAMP反应后每间隔6秒检测一次浊度,在仪器的Judgment模式下软件可按动态浊度平均值差异(即浊度增量)相对反应时间形成反应峰形曲线,可高效地用于LAMP检测反应的优化和选择[8-9]。本研究旨在针对STEC的stx1基因和stx2基因设计LAMP引物,建立LAMP实时浊度快速检测方法,并对方法的特异性、灵敏度及稳定性进行评估,并在实际样品检测中进行应用。
1 材料与方法
1.1 材料与仪器
实验所用菌株如表1所示;营养肉汤、李氏增菌肉汤、布氏肉汤 北京陆桥技术有限公司;Bst大片段DNA聚合酶 New England Biolabs公司;dNTPs、MgCl2宝生物工程(大连)有限公司;甜菜碱(Betaine) 广州威佳生物有限公司;DNA 提取试剂盒(离心柱型) 天根生化科技(北京)有限公司;畜产品192份、水产品67份、禽产品45份、可生食蔬菜59份、其它食品32份 部分购自珠海本地集贸市场、超市,部分为珠海出入境检验检疫局检验检疫技术中心受理的委托检验样品。

表1 试验用菌株Table 1 Strains used in the experiment
LA-320C型LAMP实时浊度仪 日本荣研生物公司;MB-102型振荡型恒温金属浴 杭州博日科技有限公司;Gel Doc EQ型凝胶成像系统 美国BIO-RAD公司;ND-1000型核酸浓度测定仪 美国NanoDrop科技有限公司;MARK II型智能厌氧系统 荷兰MART公司;1565-2E型恒温培养箱 美国SHELLAB公司。
1.2 实验方法
1.2.1 LAMP引物设计和合成根据LAMP 引物设计的原则,针对GenBank公布的STEC的stx1基因和stx2基因序列,使用在线设计软件LAMP Designer设计特异引物,经筛选分别获得一套特异性引物(见表2),由宝生物工程(大连)有限公司合成。

表2 STEC的stx1基因和stx2基因扩增用LAMP引物序列Table 2 Primer sequences used in LAMP for stx1 gene and stx2 gene of STEC
1.2.2 细菌DNA模板的制备、浓度和纯度测定 各菌株分别按下述培养方法获得指数生长期新鲜培养物:大肠埃希氏菌、金黄色葡萄球菌、宋内氏志贺氏菌、肠炎沙门氏菌、变形杆菌、肺炎克雷伯氏菌、铜绿假单胞菌、小肠结肠炎耶尔森氏菌接种营养肉汤,36 ℃培养24 h;单核细胞增生李斯特菌接种李氏增菌肉汤,30 ℃培养24 h、副溶血性弧菌接种3%氯化钠碱性蛋白胨水,36 ℃培养18 h;空肠弯曲菌于接种布氏肉汤,智能厌氧系统提供微需氧环境后于42 ℃培养48 h。用DNA提取试剂盒按其说明提取制备DNA模板。核酸浓度测定仪测定出DNA浓度与纯度,OD260/OD280比值在1.6~1.9之间表明DNA纯度较高,可用于LAMP扩增。
1.2.3 LAMP初始反应体系的反应条件 以STEC的stx1基因和stx2基因阳性对照菌株-大肠埃希氏菌ATCC 35150的DNA 作为模板,25 μL的LAMP反应体系包括:FIP和BIP各1.6 μmol/L,F3和B3各0.2 μmol/L,Tris-HCl(pH8.8)20 mmol/L,KCl 10 mmol/L,MgSO48 mmol/L,(NH4)2SO410 mmol/L,Tween200.1%,甜菜碱1 mol/L,MgSO46 mmol/L,dNTP 1.6 mmol/L,8U BstDNA聚合酶,2 μL DNA。参照LAMP浊度仪使用说明书,将混合物置于反应孔中,于65 ℃恒温反应90 min,最后80 ℃下保温5 min结束反应,扩增反应浊度增量曲线峰值超过 0.1 时判定为阳性。
1.2.4 LAMP 反应体系和反应条件的优化 分别对反应温度(60.0、61.0、62.0、63.0、64.0、65.0 ℃),Mg2+浓度(2.0、4.0、6.0、8.0、10.0 mmol/L),甜菜碱浓度(0.6、0.8、1.0、1.2、1.4、1.6 mol/L),dNTP浓度(0.8、1.0、1.2、1.4、1.6 mmol/L),外引物与内引物浓度比(1∶2、1∶4、1∶6、1∶8、1∶10)进行优化反应体系和反应条件优化实验。根据LAMP 浊度法中扩增反应浊度增量曲线的出峰时间、峰值及峰形作为评价指标,确定最优反应体系和反应条件。
1.2.5 LAMP特异性试验 将表1中所有菌株的各菌株指数生长期新鲜培养物分别制备DNA模板,按FIP 和BIP 各1.6 μmol/L、F3和B3各0.2 μmol/L、Tris-HCl(pH8.8)20 mmol/L、KCl 10 mmol/L、MgSO48 mmol/L、(NH4)2SO410 mmol/L、Tween20 0.1%、甜菜碱0.8 mol/L、dNTP 1.4 mmol/L、8U Bst DNA聚合酶、2 μL DNA的反应体系在63 ℃恒温反应90 min、80 ℃ 5 min 结束反应进行LAMP扩增,以验证STEC的stx1基因和stx2基因LAMP扩增方法的特异性。
1.2.6 LAMP灵敏度试验 将提取的大肠埃希氏菌ATCC 35150的DNA进行10倍连续递增稀释至10-7浓度,将各DNA核酸稀释液2 μL分别按FIP和BIP各1.6 μmol/L、F3和B3各0.2 μmol/L、Tris-HCl(pH8.8)20 mmol/L、KCl 10 mmol/L、MgSO48 mmol/L、(NH4)2SO410 mmol/L、Tween20 0.1%、甜菜碱0.8 mol/L、dNTP 1.4 mmol/L、8U Bst DNA聚合酶、2 μL DNA的反应体系在63 ℃恒温反应90 min、80 ℃ 5 min结束反应进行LAMP扩增,确定LAMP方法的灵敏度。
1.2.7 LAMP稳定性试验 大肠埃希氏菌ATCC 35150的DNA模板2 μL用于LAMP实验,以超纯水代替DNA模板作为空白对照,按FIP和BIP各1.6 μmol/L、F3和B3各0.2 μmol/L、Tris-HCl(pH8.8)20 mmol/L、KCl 10 mmol/L、MgSO48 mmol/L、(NH4)2SO410 mmol/L、Tween20 0.1%、甜菜碱0.8 mol/L、dNTP 1.4 mmol/L、8U Bst DNA聚合酶、2 μL DNA的反应体系在63 ℃恒温反应60 min、80 ℃ 5 min结束反应进行7次重复实验,验证该方法的稳定性。
1.2.8 食品样品检测 无菌称取食品样品25 g至带滤网无菌拍击式均质袋加入225 mL灭菌EC肉汤,拍击式均质器均质2 min,恒温培养箱36 ℃培养24 h。培养结束后,取带滤网拍击式均质袋中培养物滤过液按热裂解法提取核酸:1 mL培养物滤过液于1.5 mL离心管12000 r/min离心5 min,弃上清,加DNA裂解液50 μL,100 ℃金属浴裂解5 min,冷却后12000 r/min离心5 min,上清按照优化好的LAMP反应条件进行扩增。
2 结果与分析
2.1 LAMP实时浊度法反应体系的建立
在LAMP初始反应体系和反应条件下采用STEC的stx1基因和stx2基因阳性对照菌株--大肠埃希氏菌ATCC 35150进行LAMP实时浊度法扩增,LAMP法扩增的实时浊度增量图见图1。由图1可见,大肠埃希氏菌ATCC 35150的stx1基因、stx2基因扩增反应的浊度增量曲线均呈现显著峰形图,达到峰值超过 0.1的阳性判定标准,可判断2个靶基因均实现了有效扩增。
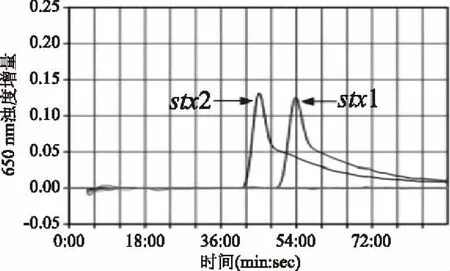
图1 大肠埃希氏菌ATCC 35150的stx1基因、stx2基因LAMP初始扩增图Fig.1 LAMP detection of stx1 gene and stx2 gene in E. coli ATCC 35150 in initial condition
2.2 LAMP反应体系和反应条件的优化
根据LAMP浊度法中扩增反应曲线的出峰时间、峰值及峰形作为评价指标,得到最佳反应体系和反应条件:FIP和BIP各1.6 μmol/L、F3和B3各0.2 μmol/L、Tris-HCl(pH8.8)20 mmol/L、KCl 10 mmol/L、MgSO48 mmol/L、(NH4)2SO410 mmol/L、Tween 20 0.1%、甜菜碱0.8 mol/L、dNTP 1.4 mmol/L、8U Bst DNA 聚合酶、2 μL DNA的反应体系在63 ℃恒温反应90 min、80 ℃ 5 min结束反应。在优化后的反应体系和反应条件下大肠埃希氏菌ATCC 35150的stx1基因、stx2基因扩增图见图2。与图1中初始扩增图相比,stx1基因、stx2基因出峰时间更早、峰值更高、峰形更集中,其中stx1基因出峰时间由54 min明显提前、缩短至40 min,2个靶基因经最佳反应体系和反应条件优化扩增效率均有所提高,恒温扩增步骤可在60 min内完成。

图2 大肠埃希氏菌ATCC 35150在优化条件下stx1基因、stx2基因LAMP扩增图Fig.2 LAMP detection of stx1 gene and stx2 gene in E. coli ATCC 35150 in the optimum condition
2.3 LAMP特异性试验
将表1中所有菌株的各菌株按优化出的反应体系和反应条件分别进行stx1基因和stx2基因的LAMP实时浊度法扩增。stx1基因的LAMP特异性试验仅大肠埃希氏菌ATCC 35150、CCTCC AB 20051和ECO157-stx1呈现阳性扩增,stx2基因的LAMP法仅大肠埃希氏菌ATCC 35150、CCTCC AB 20051和ECO157-stx2呈现阳性扩增;其余菌株扩增结果均为阴性。stx1基因和stx2基因LAMP实时浊度法扩增的特异性扩增图见图3、图4,由图可见stx1基因和stx2基因LAMP特异性均良好。

图3 stx1基因LAMP特异性试验Fig.3 Specificity test for LAMP detection of stx1 gene
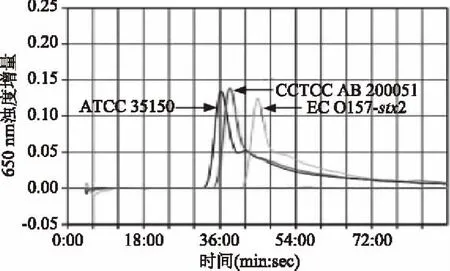
图4 stx2基因LAMP特异性试验Fig.4 Specificity test for LAMP detection of stx2 gene
2.4 LAMP灵敏度试验
菌株的DNA经核酸浓度测定仪测得其浓度为30 ng/μL,菌株DNA原液和7个连续10倍梯度的DNA稀释液各2 μL用于扩增,E.coli基因组大小为0.004 pg/copy,菌株DNA原液模板相当于15000000 copies,菌株DNA 7个连续10倍连续递增稀释的稀释液检测stx1基因和stx2基因的灵敏度试验浊度增量扩增曲线见图5和图6。由图5和图6可知,本方法的stx1基因和stx2基因检测灵敏度均可达150 copies/反应。

图5 stx1基因LAMP灵敏度试验Fig.5 Sensitivity test for LAMP detection of stx1 gene

图6 stx2基因LAMP灵敏度试验Fig.6 Sensitivity test for LAMP detection of stx2 gene
2.5 LAMP稳定性试验
大肠埃希氏菌ATCC 35150的DNA模板的7次LAMP扩增反应stx1基因、stx2基因的浊度增量扩增曲线见图7和图8,2个靶基因均出现阳性扩增,扩增浊度增量曲线峰形及重复性较好,且超纯水空白对照均无扩增,表明该方法用于STEC的stx1基因、stx2基因扩增的稳定性良好。
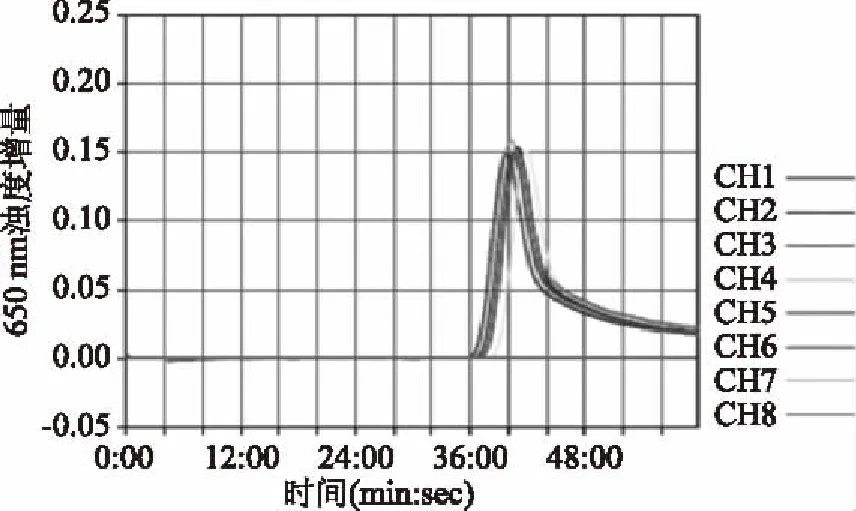
图7 stx1基因LAMP稳定性试验Fig.7 Stability test for LAMP detection of stx1 gene注:CH1~7 DNA模板-大肠埃希氏菌 ATCC 35150;CH8-超纯水空白对照;图8同。

图8 stx2基因LAMP稳定性试验Fig.8 Stability test for LAMP detection of stx2 gene
2.6 食品样品检测
所检395份食品样品STEC检测结果见表3。由表3可知,395份食品样品检出STEC阳性样品数68份,STEC检测阳性率为17.2%,阳性样品包括stx1基因阳性6份,stx2基因阳性54份,stx1基因、stx2基因同时阳性的样品8份,可见样品中STEC污染中以stx2基因阳性型为主。结合样品类型分析,所检畜产品共计192份,阳性率高达31.3%,为所有样品类别中阳性率最高者,禽产品、水产品和可生食蔬菜均有少量阳性样品检出,阳性率为3.0%~6.8%,其它食品32份包括腌制蔬菜、豆制品、调味品等未检出阳性样品。
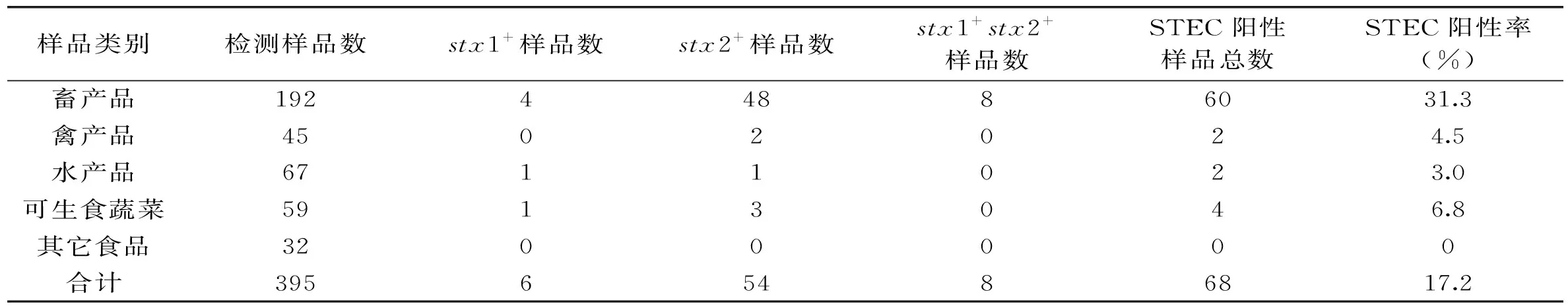
表3 食品样品STEC检测阳性结果统计Table 3 Statistics analysis for positive results of stx1 and stx2 gene in food samples
3 结论
本研究建立的LAMP实时荧光浊度法检测灵敏度高,对stx1基因、stx2基因均能检测到150 拷贝/反应。本检测方法对4株不同STEC菌株的stx1基因、stx2基因特异性扩增结果与各自基因型一致,未出现非特异性扩增,表明本研究的LAMP法对stx1基因、stx2基因扩增具有良好的特异性。
STEC是一类重要的人兽共患食源性致病菌,许多国家的生肉、肉制品、乳品、蔬菜水果等都存在不同程度的STEC污染,牛、羊、猪等被证明是STEC的主要宿主,食用被污染的食品尤其是动物性食品(肉类)是人感染STEC的重要途径[10-13]。本研究食品样品STEC检测结果表明,食品中STEC的污染较为普遍,其分布与食品基质存在一定关系,所检395份食品样品中以畜类产品的阳性率最高(达31.3%),禽产品、水产品和可生食蔬菜均有少量阳性样品检出,样品中STEC污染中以stx2基因阳性型为主,这与研究报道的携带stx2的STEC数量明显高于stx1较为一致[14-16]。
综上所述,本研究建立的LAMP实时荧光浊度法可快速、特异、灵敏地检测食品中的STEC,可满足对食品中STEC的快速筛查的需求,食品样品STEC污染检测结果为食品安全监控提供了有利依据。
