甘薯渣中去氢表雄酮抑菌活性研究
2018-12-07,,,,*,,
,,,,*,,
(1.河南科技学院食品学院,河南新乡 453003;2.东北农业大学食品学院,黑龙江哈尔滨 150030)
甘薯是我国主要的粮食作物之一,种植面积大总产量高,加工产品种类多数量大。甘薯渣是经提取淀粉或其他加工处理后的副产物,约占甘薯加工产量的20%~37%[1]。甘薯渣水分含量高,不易保存,既给生产带来负担,又给环境带来压力。甘薯渣除富含膳食纤维之外,还含有其他活性物质,比如多酚、果胶、低聚麦芽糖等。去氢表雄酮(dehydroepiandrosterone,DHEA)是甘薯和山药里特有的活性物质,其化学名为3β-羟基雄甾-5烯-17酮,化学结构以甾体为母体外接一个芳杂环[2],近年来国内外学者对其生理及药理作用进行了大量研究[3],表明其具有抗衰老[4]、抗肿瘤[5]、抗菌[6]、抑制肥胖[7-9]、增强记忆[10-11]、抗神经炎症[12]、调节人体激素[13-14]以及抑制卵细胞凋亡[15]的作用。人体血浆中含有DHEA,常以硫酸酯DHEAS的形式参与血液循环,在酶的作用下转化为雄性激素睾酮或雌酮[15],但人体DHEA水平随着年龄的增长而下降,目前市面已有含DHEA的保健品或食品[16]。
去氢表雄酮来源较少,多为化学合成,但有较大副作用和毒性,也可利用毛霉、白色链霉菌等经生物转化得到,但生物转化不仅过程复杂而且产物较多不易提纯,故不是最佳获得DHEA的途径。部分天然植物如山药、甘薯[16]中发现含有去氢表雄酮,因此可考虑从植物中获取天然的DHEA。目前关于去氢表雄酮对常见致病菌及物生物的抑菌活性的研究较少。
因此,本文以甘薯渣为原料,通过提取甘薯渣中去氢表雄酮,初步探讨去氢表雄酮对常见致病菌及其他微生物的抗菌活性,可为甘薯渣及去氢表雄酮的深度利用开发新途径。
1 材料与方法
1.1 材料与仪器
甘薯渣 由复元生物公司提供;硫酸、氯化钡、丙酮、二氯甲烷、无水硫酸钠、醋酸钠、碳酸钠等 均为国产分析纯;马克斯克鲁维酵母、酿酒酵母、大肠杆菌、枯草芽胞杆菌、炭疽杆菌、沙门氏菌、金黄葡萄球菌、鼠李糖乳杆菌 河南科技学院食品学院生物技术实验室;牛肉膏蛋白胨培养基[17](用于培养枯草芽孢杆菌、金黄色葡萄球菌):0.5%牛肉膏,1%蛋白胨,0.5%氯化钠,蒸馏水1000 mL,pH7.0~7.2,2%琼脂;LB培养基[18](用于培养炭疽杆菌、沙门氏菌、大肠杆菌):1%蛋白胨,0.5%酵母浸粉,1%氯化钠,蒸馏水1000 mL,pH7.0~7.2,2%琼脂;MRS培养基[19](用于培养鼠李糖乳杆菌):0.5%蛋白胨,0.5%牛肉膏,1%胰蛋白胨,0.5%酵母浸粉,1%葡萄糖,1 mL吐温80,0.2%磷酸氢二钾,0.5%乙酸钠;YPD培养基[20](用于培养马克斯克鲁维酵母、酿酒酵母):2%葡萄糖,2%蛋白胨,1%酵母浸粉,蒸馏水1000 mL,pH7.0~7.2,2%琼脂。
CW-2000型超声波-微波协同萃取仪 上海新拓分析仪器科技有限公司;TU-1810型紫外可见分光光度计 北京普析通用仪器有限责任公司;SHP-250型生化培养箱 上海三发科学仪器有限公司;立式压力蒸汽灭菌锅 上海博讯仪器有限公司;SW-CJ-1D型单人单面垂直净化工作台 苏州智华精密仪器有限公司;SIGMA3-30K型离心机 德国SIGMA公司;ALPHA 2-4 LSC型真空冷冻干燥箱 德国CHRIST公司;S-570型扫描电镜 日本日立公司;SW22.SW23型恒温振荡水浴锅 德国JULABO公司。
1.2 实验方法
1.2.1 甘薯渣中DHEA的提取 DHEA的提取方法参照文献[21-23]的方法,略有修改,提取工艺如下:甘薯渣在45 ℃烘干磨粉后过200目筛备用,取100 g渣粉加3倍的水在37 ℃下预发酵24 h,用超声波-微波协同萃取仪萃取,萃取的微波功率为300 W,萃取温度为30 ℃,萃取时间为30 min;以6∶4的比例向萃取后的甘薯渣中加入30 mL甲醇-丙酮混合液,放置在45 ℃的水浴锅中水浴30 min后用孔径为80~120 μm,直径为D 15 cm的滤纸过滤,收集的滤液经真空冷冻干燥,收集干燥后的提取样,在20 ℃、300 W下用10 mL甲醇超声波洗脱30 min,向洗脱液里加100 mL醋酸钠缓冲溶液,再超声处理15 min,加入二氯甲烷萃取(萃取3次,每次间隔30 min,每次加入量为25 mL),收集萃取液并向其中加30 mL pH为6.8的碳酸钠缓冲溶液,去水层,用无水硫酸钠脱水,在-80 ℃经真空冷冻干燥,收集干燥品。
1.2.2 甘薯渣DHEA的纯化和高效液相分析 冷冻干燥膜分离:冷冻干燥品溶于色谱甲醇,依次用5、1.2和0.45 μm微滤膜除去DHEA提取液中的固形物来降低对超滤膜的污染,再依次通过分子量截留值为3000 Da的聚醚砜滤膜,之后浓缩、冷冻干燥后用色谱甲醇溶解,再利用制备液相进行单体纯化:色谱柱Diamonsil C18柱(5 μm,250 mm×4.6 mm);检测波长:218 nm;流动相配比:甲醇-水=80-20;柱温:30 ℃;流速:0.8 mL/min。配制DHEA标准液的浓度分别为0、0.2、0.4、0.6、0.8、1.0、1.2 mg/mL,进样量20 μL,绘制DHEA的标准曲线,横坐标为DHEA浓度,纵坐标为峰面积。收集纯化后的单体采用HPLC方法对甘薯渣中DHEA进行定性定量分析。具体检测方法为:Diamonsil C18柱(5 μm,250 mm×4.6 mm);检测波长 218 nm;流速0.6 mL/min;柱温25 ℃;进样量 20 μL;流动相A(100%色谱甲醇)和流动相B(超纯水)。样品峰保留时间与标准品保留时间进行对比,按照峰面积计算DHEA含量,结果以(μg/100 g)甘薯渣干粉计。甘薯渣中DHEA含量计算公式:
式中:X:样品中DHEA含量(μg/100 g);S1:样品峰面积;S2:标准峰面积;C:标准品溶液浓度(μg/mL);V:样品定容体积(μL);M:试样质量(g)。
1.2.3 供试菌菌种活化及菌悬液的制备 无菌条件下,用接种环分别挑取斜面培养基上的供试菌菌落,置于已灭菌的固体培养基上划线(牛肉膏蛋白胨培养基用于培养枯草芽孢杆菌、金黄色葡萄球菌;LB培养基用于培养炭疽杆菌、大肠杆菌、沙门氏菌;MRS培养基用于培养鼠李糖乳杆菌;YPD培养基用于培养马克斯克鲁维酵母、酿酒酵母),恒温培养箱培养24 h(37 ℃)后,用接种环挑取单菌落至相应的液体培养基中,置于37 ℃双层空气恒温振荡器扩大培养到对数期(37 ℃,150 r/min),即得到活化的供试菌。利用麦氏比浊法[24-25]将菌株制成一定浓度的菌悬液。
1.2.4 DHEA抑菌活性研究 用硫酸和氯化钡按一定的比例配制溶液,生成的硫酸钡沉淀用漩涡振荡器混合均匀后,在OD260 nm处测量吸光度值,用麦氏比浊法绘制菌悬液标准曲线。菌悬液的标准曲线的公式为:Y=4.1X-0.21338,相关系数R2为0.9946,标准曲线相关性较好,可以使用标准曲线公式进行计算。本试验所用供试菌标准菌悬液浓度约为2×108cfu/mL。取供试菌各100 μL涂布平板(牛肉膏蛋白胨培养基培养枯草芽孢杆菌、金黄色葡萄球菌;LB培养基培养炭疽杆菌、大肠杆菌、沙门氏菌;MRS培养基培养鼠李糖乳杆菌;YPD培养基培养马克斯克鲁维酵母、酿酒酵母),用直径为6 mm的打孔器打孔,每孔加浓度为100 mg/mL的 DHEA样品50 μL,37 ℃培养24 h后观察DHEA对不同菌的抑菌活性,并测量抑菌圈直径的大小。
1.2.5 DHEA的MIC及MBC的测定 用二倍稀释法[26]将DHEA样品稀释成128、64、32、16、8、4、2、1、0.5、0.25、0.125 mg/mL系列浓度稀释液,与供试菌振荡混合后,置于37 ℃培养箱内培养24 h观察结果。液体培养基(牛肉膏蛋白胨培养基用于培养枯草芽孢杆菌、金黄色葡萄球菌;LB培养基用于培养炭疽杆菌、大肠杆菌、沙门氏菌;MRS培养基用于培养鼠李糖乳杆菌;YPD培养基用于培养马克斯克鲁维酵母、酿酒酵母)中无浑浊为最低抑菌质量浓度(MIC)。取无浑浊的培养液接种于固体培养基平板上,37 ℃培养24 h后观察,没有细菌生长的为样品对供试菌的最低杀菌质量浓度(MBC)。
1.2.6 生长曲线的测定 抑菌物质加入到供试菌培养液中后,供试菌的耐受性不同,生长会受到不同程度的影响,表现出培养基中供试菌的浊度不同[27]。故根据不同时间测定的培养基中指示菌的吸光度[28]可测定抑菌物质DHEA对指示菌生长曲线的影响。在装有100 mL的液体培养基(牛肉膏蛋白胨培养基用于培养枯草芽孢杆菌、金黄色葡萄球菌;LB培养基用于培养炭疽杆菌、大肠杆菌、沙门氏菌;MRS培养基用于培养鼠李糖乳杆菌;YPD培养基用于培养马克斯克鲁维酵母、酿酒酵母)的带侧臂的培养瓶中接种供试菌并调整指示菌菌体浓度为2×108cfu/mL,加入DHEA浓度为最小抑菌浓度的一半,在37 ℃下培养,每隔2 h测定吸光值。以不加DHEA为对照,以培养时间为横坐标,吸光度(OD260 nm)为纵坐标,绘制供试菌的生长曲线。
1.2.7 指示菌的电镜观察菌体形态 采用扫描电镜(Scanning electron microscopy,SEM)对DHEA处理和未处理的细菌进行菌体形态扫描观察[29],浓度设定为EC50(半最大效应浓度)。扫描电镜样品的制备方法:取培养一定时间的供试菌,无菌超纯水清洗2~3次,离心洗去残余培养基,水洗后加入用体积含量为4%的戊二酸重悬菌体,固定细胞形态(4 ℃,2 h以上),用pH为6.8的磷酸缓冲液冲洗6次洗去残余戊二醛(20 min/次,4 ℃),用体积含量为30%、50%、70%、80%、90%和100%的乙醇梯度洗脱脱水(30 min/次,4 ℃),用100%丙酮脱水3次,用乙酸异戊酯进行置换2次(30 min/次,4 ℃),样品冷冻干燥,将样品粘台进行真空喷金,观察果胶的纵向表面和横截面的形状,并拍照。测定参数为:加速电压:30 kV;电流:20 mA;步长:0.05°/2θ;扫描速度:0.05°/min。在1000~3000放大倍数范围内观察菌体形态。
1.3 数据分析
实验中涉及的每组试验均重复3次,所得数据以平均值±标准差表示。所得试验数据使用SPSS 18.0软件统计分析,利用Orgin 8.0作图。
2 结果与分析
2.1 DHEA标准曲线绘制
如图1,横纵坐标为标准品的浓度X(mg/mL),纵坐标为峰面积值Y(mAU)绘制标准曲线,得出该色谱条件下的线性回归方程为Y=98.733X-874.89,R2=0.9992。

图1 DHEA标准曲线Fig.1 Standard curve of DHEA
2.2 HPLC测定甘薯中DHEA含量
由图2可得,标准品出峰时间为7.195 min,样品峰出峰时间为7.043 min,此外14.27 min时又出现一个峰,此种物质不明,可能是杂质,待进一步检测。经超声波微波协同提取甘薯渣中DHEA,提取量为117.25 μg/100 g。提取得到的DHEA在制备液相上进一步纯化,DHEA的纯度为90%~98%,收集样品备用。
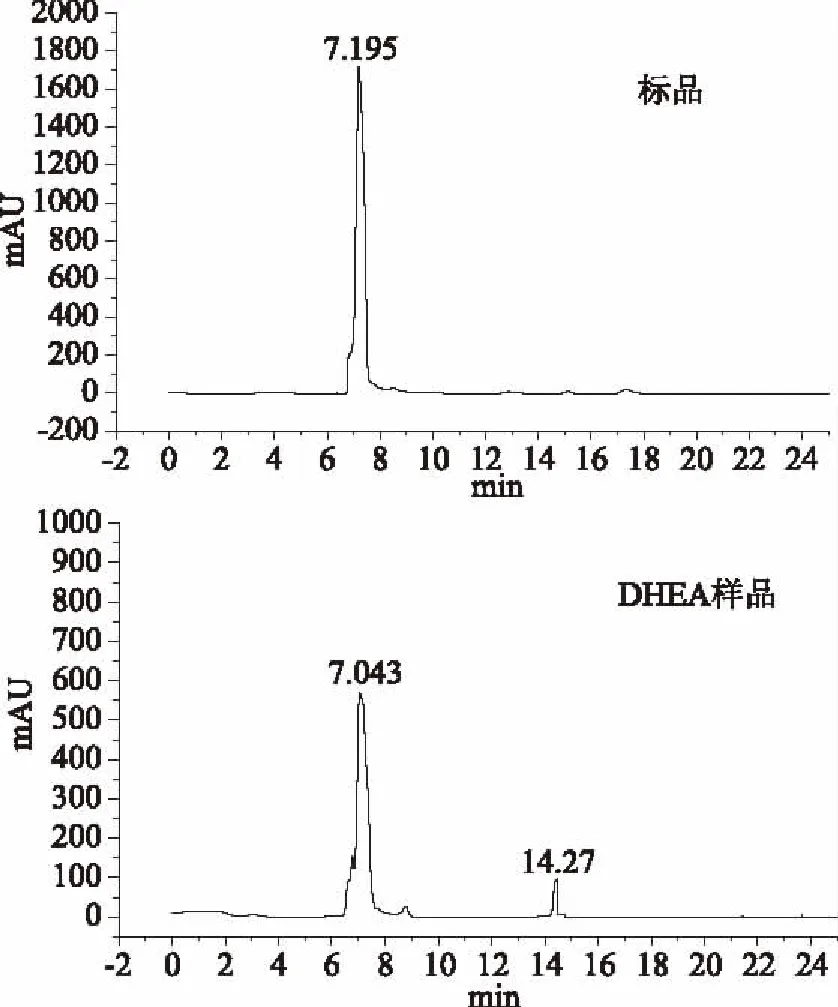
图2 DHEA标准品及甘薯渣中提取DHEA样品HPLC图Fig.2 HPLC chromatogram of DHEA contrast and from sweet potato residues
2.3 抑菌活性
由图3可知,去氢表雄酮对革兰氏阳性菌(金黄色葡萄球菌、炭疽杆菌、枯草芽孢杆菌、鼠李糖乳杆菌)、革兰氏阴性菌(大肠杆菌)、真菌(马克斯克鲁维酵母、酿酒酵母)均有抑制作用。对马克斯克鲁维酵母、大肠杆菌抑制最明显,对金黄色葡萄球菌、炭疽杆菌、沙门氏菌、酿酒酵母、枯草芽孢杆菌次之,但对鼠李糖乳杆菌抑制作用不明显。由表1可知,抑菌圈直径大小为:马克斯克鲁维酵母>大肠杆菌>金黄色葡萄球菌>炭疽杆菌>沙门氏菌>酿酒酵母>枯草芽孢杆菌>鼠李糖乳杆菌。
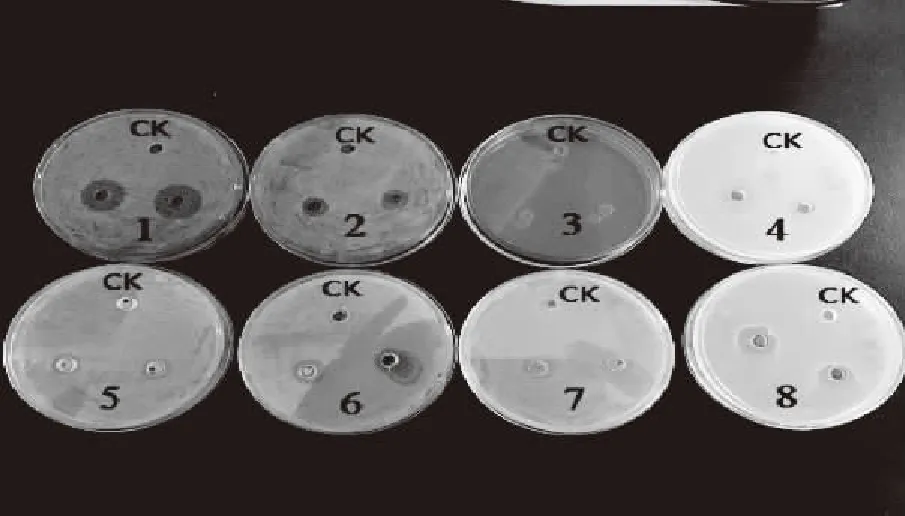
图3 DHEA的抑菌活性Fig.3 Antibacterial activity of DHEA 注:CK:对照;1:马克斯克鲁维酵母;2:酿酒酵母;3:鼠李糖乳杆菌;4:大肠杆菌5:枯草芽孢杆菌;6:炭疽杆菌;7:沙门氏菌;8:金黄色葡萄球菌。

表1 DHEA对供试菌的抑菌直径(mm)Table 1 DHEA for bacteriostatic diameter of tested bacteria(mm)
2.4 DHEA抗菌效力MIC、MBC的测定
样品的MIC和MBC越小,其抑菌作用越明显。由表2可知,DHEA对马克斯克鲁维酵母、大肠杆菌作用最为明显,其MIC分别为(5.67±0.21)、(9.82±0.35) mg/mL,MBC分别为(9.79±0.14)、(18.36±0.18) mg/mL。
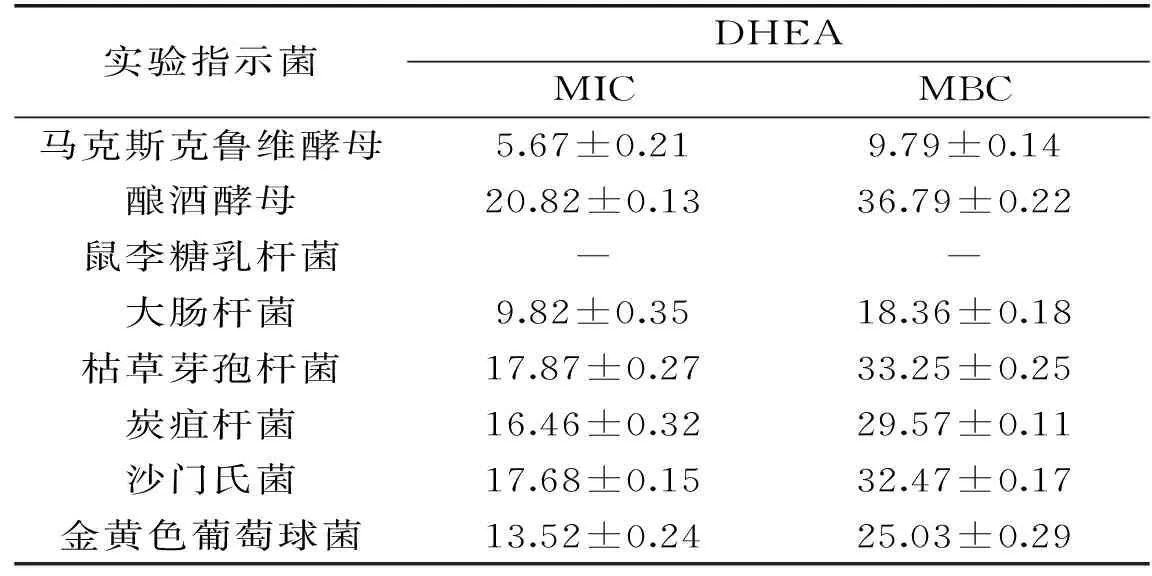
表2 DHEA对供试菌的MIC和MBC(mg/mL)Table 2 DHEA for MIC and MBC of tested bacteria(mg/mL)
研究中发现,在所选菌株中,除鼠李糖乳杆菌,DHEA对其他菌株具有抑制作用。DHEA对指示菌杀菌作用大小分别为:马克斯克鲁维酵母>大肠杆菌>金黄色葡萄球菌>炭疽杆菌>沙门氏菌>枯草芽孢杆菌>酿酒酵母>鼠李糖乳杆菌(-)。
2.5 DHEA对供示菌生长曲线的影响
由图4可知,DHEA对马克斯克鲁维酵母、酿酒酵母、大肠杆菌、枯草芽孢杆菌、炭疽杆菌、沙门氏菌、金黄色葡萄球菌生长曲线均有影响。由图4A、图4B可知,DHEA使马克斯克鲁维酵母、酿酒酵母生长曲线对数期缩短,稳定期延长。由图4C可知,DHEA对鼠李糖乳杆菌无抑制作用不明显,菌体生长曲线无明显变化。由图4D可知,DHEA使大肠杆菌对数期缩短稳定期延长,并使菌体浓度下降。由图4E可知DHEA对枯草芽孢杆菌生长也有影响。由图4F可知,DHEA对炭疽杆菌生长曲线有影响,对数期菌体浓度下降。由图4G可知,DHEA使沙门氏菌菌落总数下降,生长期延长,对数期缩短,随着时间延长菌体浓度整体下降。由图4H可知,DHEA对金黄色葡萄球菌有抑制作用,菌落总数下降,生长期延长,对数期缩短,随着时间延长菌体浓度整体下降。
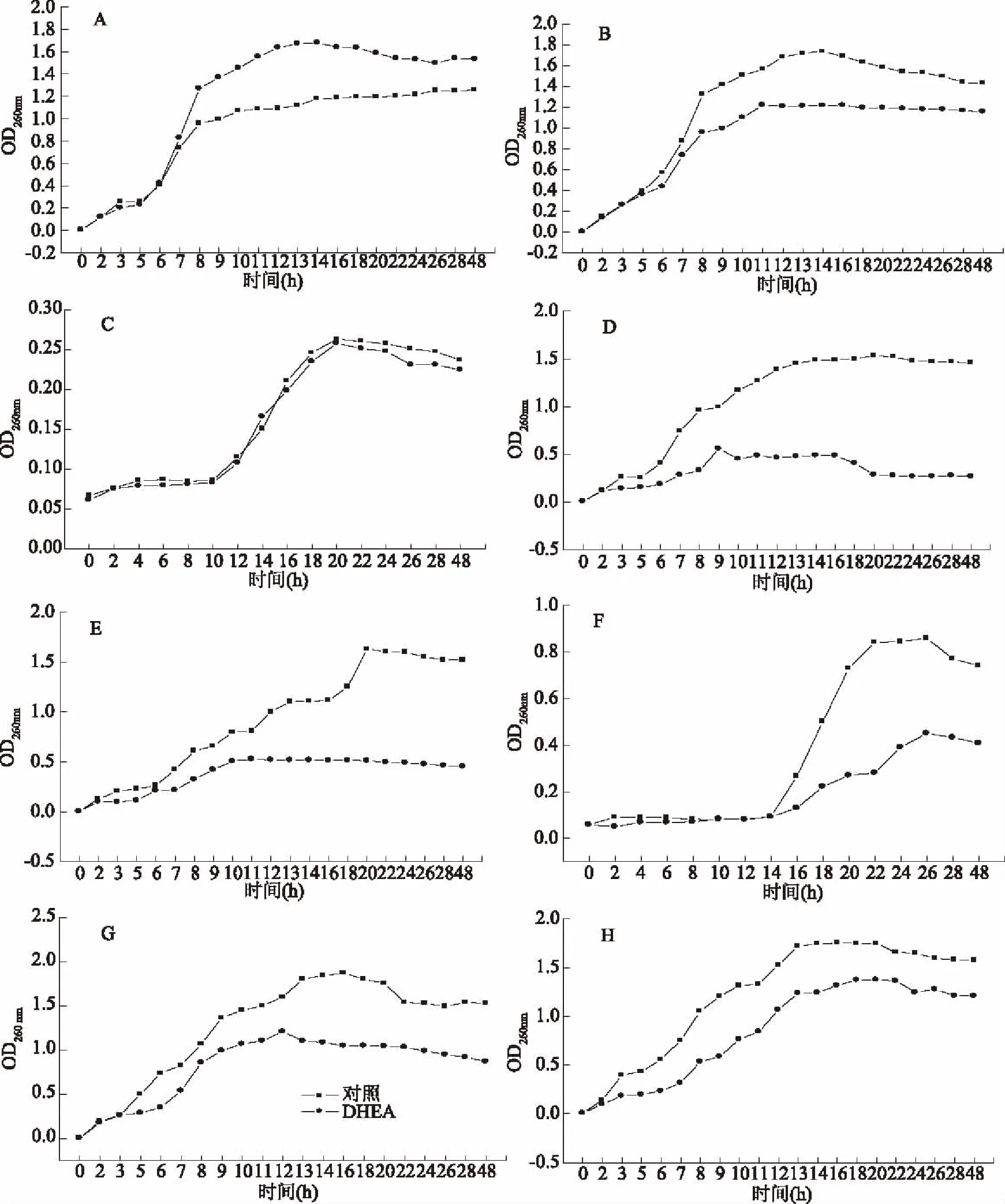
图4 DHEA对指示菌生长曲线的影响Fig.4 Effects of DHEA on the growth curve of indicator注:A:马克斯克鲁维酵母;B:酿酒酵母;C:鼠李糖乳杆菌;D:大肠杆菌;E:枯草芽孢杆菌;F:炭疽杆菌;G:沙门氏菌;H:金黄色葡萄球菌。
2.6 指示菌扫描电镜观察
以不加DHEA正常生长情况下的指示菌为对照,用扫描电镜观察DHEA对指示菌菌体形态的影响。由图5可知,DHEA对马克斯克鲁维酵母、酿酒酵母、大肠杆菌、枯草芽孢杆菌、炭疽杆菌、沙门氏菌、金黄色葡萄球菌细胞形态均有影响,空白对照下的以上指示菌菌体形态正常,细胞饱满,细胞内容物分布均匀,经DHEA处理后菌体形态一定程度上改变,菌体边缘有毛刺,细胞壁有破裂,细胞内容物有部分溶出。可见,DHEA对细菌的细胞壁有作用力,可通过破坏其细胞壁,使细胞内容物溶出致使菌体死亡。观察鼠李糖乳杆菌扫描电镜,发现对照和处理后形态无明显变化,这也从微观形态说明DHEA对其无影响。

图5 DHEA对供试菌细胞形态的影响Fig.5 Effect of DHEA on cell morphology of tested strains注:a:马克斯克鲁维酵母;b:酿酒酵母;c:鼠李糖乳杆菌;d:大肠杆菌;e:枯草芽孢杆菌;f:炭疽杆菌;g:沙门氏菌;h:金黄色葡萄球菌。
3 讨论
甘薯渣提取物DHEA具有抑菌作用,不同生物体其生物免疫系统不同[30],故对供试菌有不同的抑制作用,尤其对马克斯克鲁维酵母、大肠杆菌、枯草芽孢杆菌、沙门氏菌作用力敏感,对益生菌鼠李糖乳杆菌无抑制作用。这可能与去氢表雄酮本身的生物活性有关,其具体作用机制还不明确,有待进一步的研究论证。对甘薯渣中DHEA进行提取时,在提取后应用冷冻干燥,干燥后放入棕瓶中低温避光保存,以免失去活性。未经纯化的样品应及时进行纯化收集,避免放置时间久样品抑菌活性成分减弱。甘薯渣为农副产品加工副产物,从中提取活性物质成分能很好的提高甘薯的附加值[24-25]。从中提取DHEA,有利于甘薯渣的回收利用对拓宽其在食品领域的应用途径具有一定意义。
4 结论
DHEA对供试菌的抑菌效果依次为:马克斯克鲁维酵母>大肠杆菌>金黄色葡萄球菌>炭疽杆菌>沙门氏菌>枯草芽孢杆菌>酿酒酵母>鼠李糖乳杆菌。最低抑制浓度(MIC)结果为:马克斯克鲁维酵母5.67 mg/mL,大肠杆菌9.82 mg/mL,金黄色葡萄球菌13.52 mg/mL,炭疽杆菌16.46 mg/mL,沙门氏菌17.68 mg/mL,枯草芽孢杆菌17.87 mg/mL,酿酒酵母20.82 mg/mL,而对鼠李糖乳杆菌无明显抑制作用。DHEA使供试菌生长周期缩短,并降低了菌体浓度;扫描电镜显示DHEA处理后菌体形态改变,细胞壁破裂,细胞内容物有溶出。甘薯渣中DHEA抑菌作用的研究,为去氢表雄酮及农副产品的综合利用提供新的思路和途径。
