创伤弧菌FrsA蛋白的纯化及生化表征
2018-12-07鲍玲玲李至敏王小琴汤亚兰许文武李志敏
鲍玲玲,李至敏,王小琴,汤亚兰,许文武,李志敏*
(1.江西农业大学 生物科学与工程学院,江西 南昌 330045;2.江西农业大学 理学院,江西 南昌 330045)
创伤弧菌(Vibriovulnificus)是一种嗜盐革兰氏阴性细菌,多存在于温带沿海地区的软体贝类体内[1],该菌属于条件致病菌,在合适的条件下会感染鱼和人类[2]。人类感染创伤弧菌主要是通过生食带有该菌的海鲜或伤口接触了带菌的海水,从而导致肠胃炎、原发性败血症、慢性肝炎或肝硬化、软组织感染等疾病[3-4]。创伤弧菌的生物多样性复杂,可分为3大类型,其中生物类型Ⅰ普遍感染人类[5],生物类型Ⅱ主要感染鱼类贝类[6],生物类型Ⅲ于1996年首次在以色列被分离得到,是由来源于自然环境的类型Ⅰ和其他细菌通过基因重组进化而来[7-8]。
在大肠杆菌中, FrsA蛋白通过和去磷酸化的IIAGlc蛋白结合可以提高葡萄糖的发酵水平[9]。研究表明,当用葡萄糖作为碳源时,敲除FrsA基因会提高大肠杆菌的呼吸水平,而过表达FrsA基因会提高发酵导向的代谢水平[9]。尽管FrsA蛋白在葡萄糖代谢方面具有生理意义,但有关重组FrsA蛋白的体外生化功能的研究报道较少。2011年,Lee等[10]首次表达纯化了创伤弧菌的FrsA蛋白(VvFrsA),并研究了重组VvFrsA蛋白的体外生化功能,发现VvFrsA可在大肠杆菌表达系统中进行可溶性表达,同时VvFrsA是一种不依赖于焦磷酸硫胺素(TPP)辅因子的丙酮酸脱羧酶,在体外能够催化丙酮酸转化为乙醛和二氧化碳[10]。然而,Kellet等[11]指出,VvFrsA蛋白并不是一种丙酮酸脱羧酶,当以丙酮酸作为底物时,并未检测到乙醛和二氧化碳的产生。与此同时,计算化学的研究也证明,重组VvFrsA蛋白不具备丙酮酸脱羧功能[11]。目前,仅有乳清苷5′-单磷酸脱羧酶和2-氧-4-羟基-4-羧基-5-脲基咪唑啉脱羧酶等两类不依赖辅因子的脱羧酶被报道[12-13]。因此,重组VvFrsA蛋白的体外生化功能依然存在争议。
通过氨基酸序列同源比对发现,在NCBI数据库中和VvFrsA的氨基酸序列同源的蛋白质大多数被标注为酯酶。此外,已有的重组VvFrsA蛋白的晶体结构数据表明,VvFrsA中存在α/β水解酶结构域[10-11]。因此,笔者猜测重组VvFrsA蛋白可能具有催化某些酯类水解功能。为了验证这一假设,本研究通过分子生物学手段将化学法合成的VvFrsA基因连接到pET-28a载体上,构建了pET28a-VvFrsA表达质粒,探究了VvFrsA蛋白的表达条件及纯化步骤,并初步阐明了其作为酯酶的催化特性,为进一步探索VvFrsA蛋白的体外生化特征奠定基础。
1 材料和方法
1.1 试验材料
创伤弧菌的FrsA基因(VvFrsA)由上海祥音生物技术有限公司合成;大肠杆菌DH5α、BL21(DE3)感受态细胞、表达载体pET-28a由江西农业大学生物化学与分子生物学实验室保存;限制性内切酶NdeⅠ和XhoⅠ、T4 DNA连接酶、5k核酸Marker购自北京全式金生物技术有限公司;蛋白质Marker购自Thermo Scientific公司;对硝基苯酚乙酸酯(pNPA)、对硝基苯酚丁酸酯(pNPB)和对硝基苯酚棕榈酸酯(pNPP)均为分析纯,购自上海阿拉丁生化科技股份有限公司。
1.2 方法
1.2.1 pET28a-VvFrsA质粒构建 化学法合成包含NdeⅠ和XhoⅠ酶切位点的VvFrsA基因。该基因经限制性内切酶NdeⅠ和XhoⅠ酶切后,利用琼脂糖凝胶回收片段,将该片段与同样酶切的pET-28a载体用T4连接酶在16 ℃下过夜连接。然后将连接产物转化到大肠杆菌感受态细胞DH5α中,用含有50 μg/mL卡那霉素的LB固体平板培养基筛选阳性克隆。将阳性克隆提取质粒后用NdeⅠ和XhoⅠ双酶切,验证阳性克隆并送检测序。
1.2.2 重组VvFrsA蛋白的诱导表达与纯化 将测序正确的pET28a-VvFrsA质粒重新转化到大肠杆菌表达菌株BL21(DE3)中,挑取阳性单克隆点接种于含卡那霉素终质量浓度为50 μg/mL的LB液体培养基中进行扩大培养,次日按1%的接种量接种于新鲜LB液体培养基,37 ℃、180 r/min条件下继续培养至OD600约为0.6时,立即冰水浴30 min,加入终浓度为0.2 mmol/L的IPTG诱导剂,于25 ℃、180 r/min的培养箱中诱导表达24 h。然后于4 ℃、5 000 r/min离心15 min收集菌体。将菌体用10倍体积的20 mmol/L PBS缓冲液重悬后于冰水浴中超声破碎,然后于4 ℃、12 000 r/min离心破碎后的细胞全菌液2 h。将经0.45 μm滤膜过滤后的上清液样品流穿事先用结合缓冲液(20 mmol/L Tris-HCl,pH值7.5)平衡好的Ni-NTA柱,随后用含20~200 mmol/L咪唑的缓冲液进行浓度梯度洗脱,分别收集每个浓度的洗脱液进行SDS-PAGE检测目的蛋白。合并含有重组VvFrsA蛋白的洗脱液,浓缩脱盐处理,最终得到的VvFrsA蛋白用Bradford方法进行定量。
1.2.3 重组VvFrsA蛋白底物特异性测定 重组VvFrsA蛋白对pNPA、pNPB和pNPP 3种对硝基苯酚脂肪酸酯底物的催化活性根据Vorderwülbecke等[14]提出的酯酶检测方法适当修改后测定。首先将上述3种底物分别溶解于异丙醇中构成溶液1,底物浓度均为1 mmol/L。同时配置含有0.4%Triton X-100的50 mmol/L磷酸盐缓冲液(pH值为7.5)构成溶液2。测定前将溶液1和2均置于37 ℃恒温水浴。测定时将溶液1和溶液2按1∶9的比例混合后加入终浓度为20 μmol/L的重组VvFrsA蛋白,于37 ℃开始反应,使用紫外分光光度计连续监测410 nm处吸收值。根据对硝基苯酚在410 nm处的摩尔消光系数计算生成的产物量。
2 结果与分析
2.1 pET28a-VvFrsA表达质粒的构建与鉴定
将从阳性单克隆菌落中提取的重组质粒经NdeⅠ和XhoⅠ双酶切后,经琼脂糖凝胶电泳出现2个条带,如图1所示,接近5 000 bp的大片段为pET-28a载体片段,小片段基因约为1 200 bp,与VvFrsA基因理论大小(1 248 bp)相符。基因测序发现该1 200 bp片段基因序列与GenBank数据库中登录号为HM172799的FrsA基因序列一致。可见,成功构建了pET28a-VvFrsA重组表达质粒。
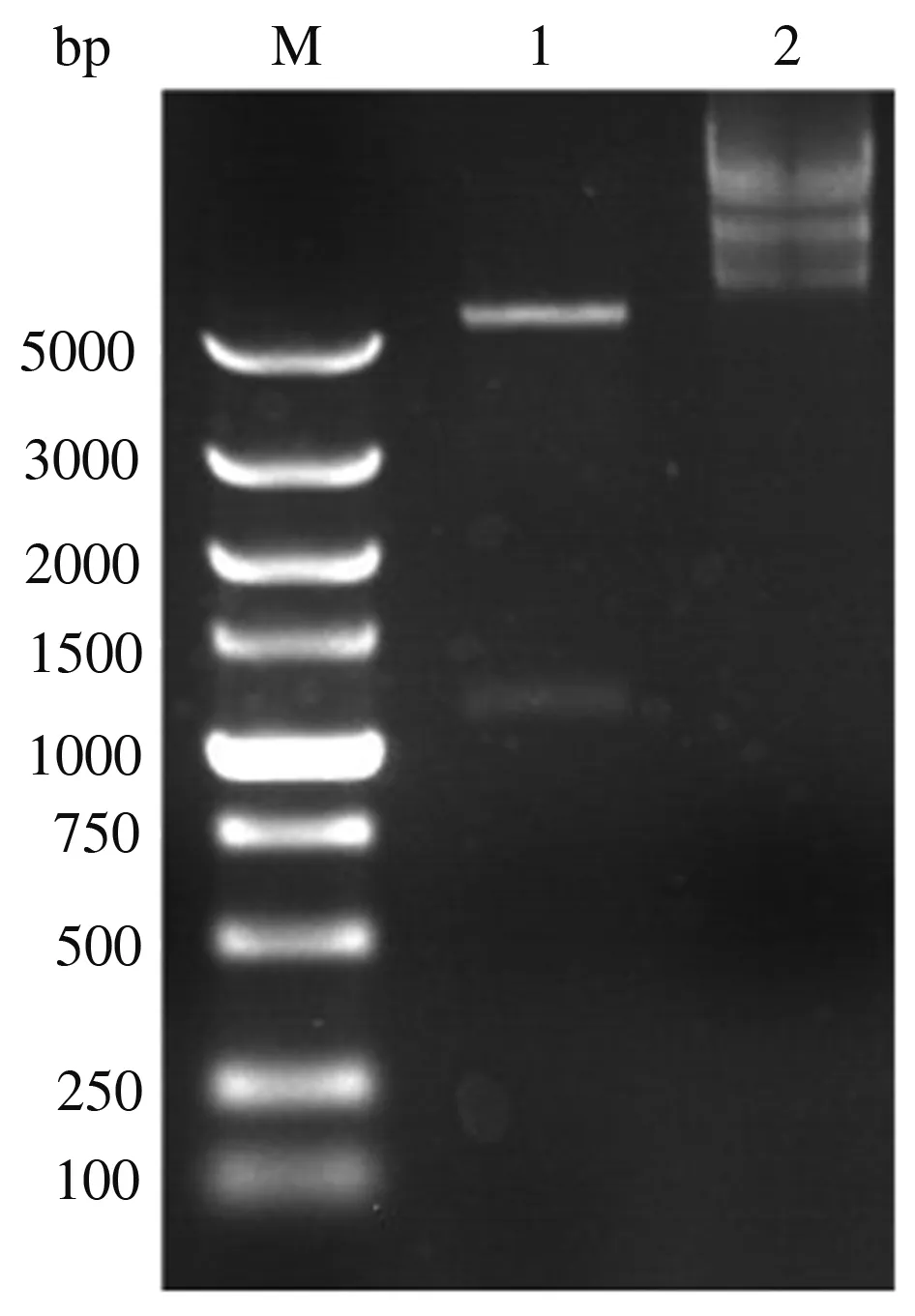
M:5k核酸Marker;1:pET28a-VvFrsA表达
2.2 重组VvFrsA蛋白的表达与纯化
VvFrsA基因的碱基数为1 248 bp,编码含有415个氨基酸残基的蛋白质,预测其分子质量为47.014 ku,与图2中泳道1、2、3中条带基本一致。由图2可知,重组VvFrsA蛋白的表达量较高,且在上述表达条件下重组蛋白的溶解性较好。
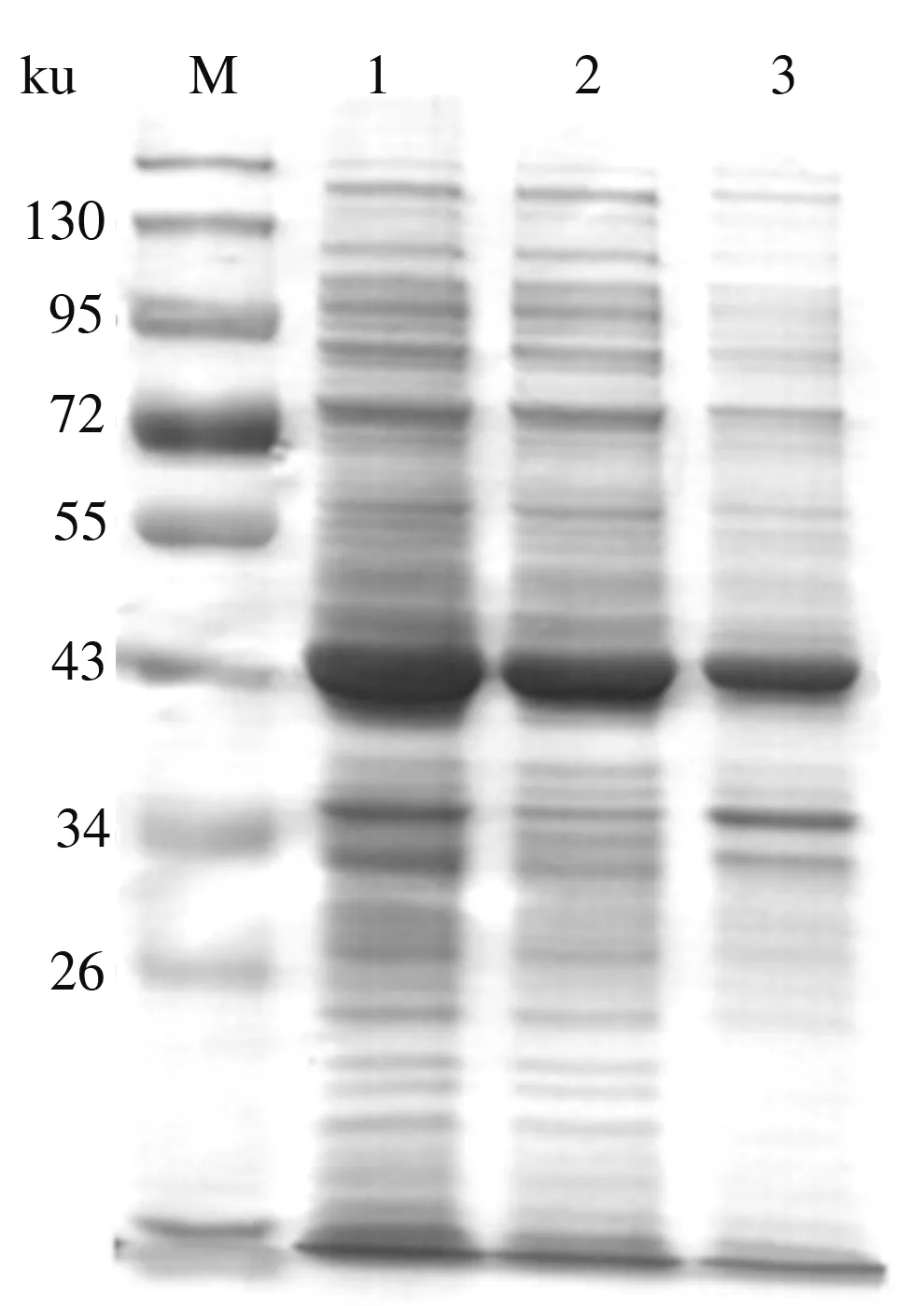
M:蛋白质Marker;1:细胞破碎液全菌;
将含有目的蛋白的上清液用Ni-NTA亲和层析柱纯化。用含有20~200 mmol/L咪唑的缓冲液(20 mmol/L Tris-HCl,pH值为7.5)进行洗脱(图3)。当咪唑浓度增加到80 mmol/L时,有少量重组VvFrsA蛋白被洗脱。然后用含200 mmol/L咪唑的缓冲液将重组VvFrsA蛋白全部洗脱。合并图3中泳道8—9的洗脱液后浓缩脱盐,得到纯度大于95%的重组VvFrsA蛋白。用Bradford方法对浓缩后的蛋白质质量浓度进行测定,最终得到蛋白质质量浓度为20 mg/mL,蛋白质回收率约为15 mg/g菌体。
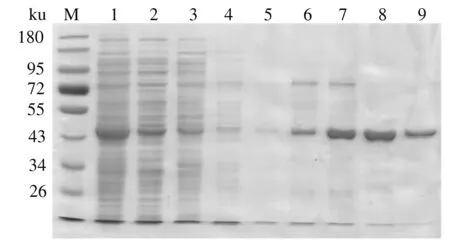
M:蛋白质Marker;1:离心后上清液;2:流穿液;
2.3 重组VvFrsA蛋白的底物特异性
按照上述测定方法,当分别用pNPA、pNPB和pNPP作为底物时,加入重组VvFrsA蛋白后,反应体系在410 nm处的吸收值逐渐增加。由此可知,重组VvFrsA蛋白可以催化pNPA、pNPB和pNPP 3种对硝基苯酚脂肪酸酯的水解反应,生成对硝基苯酚。由图4可知,当用pNPA作为底物时,重组VvFrsA蛋白的催化活性最高。重组VvFrsA蛋白催化pNPB、pNPP水解的活性分别是催化pNPA水解活性的75%、22%。可见,重组VvFrsA蛋白倾向于催化对硝基苯酚短链脂肪酸酯水解。
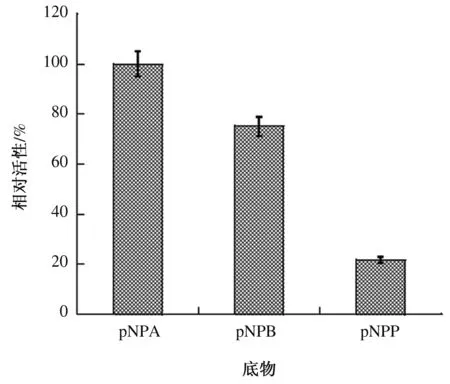
图4 重组VvFrsA蛋白催化不同底物的相对活性
3 结论与讨论
首个被报道的FrsA蛋白来自于大肠杆菌[9]。研究人员发现,在大肠杆菌中FrsA蛋白以1∶1的比例特异性地结合去磷酸化的IIAGlc蛋白形成复合物,从而调控细胞中葡萄糖的发酵水平[9]。尽管FrsA蛋白在大肠杆菌中的生理功能已被阐明,然而FrsA蛋白的体外生化功能依然不清楚。
本研究将构建的pET28a-VvFrsA重组质粒转化至大肠杆菌BL21(DE3)中进行诱导表达,成功实现了重组VvFrsA蛋白在大肠杆菌中的可溶性表达。通过Ni-NTA亲和层析法一步纯化得到纯度较高的重组VvFrsA蛋白。
一般认为,丙酮酸脱羧酶的催化活性依赖于TPP辅因子[15]。Lee等[10]研究表明,VvFrsA蛋白是一个不依赖TPP辅因子的丙酮酸脱羧酶。这一发现颠覆了传统的对于丙酮酸脱羧酶的认识。本研究以丙酮酸为反应底物时,没有检测到VvFrsA在体外具有催化丙酮酸脱羧生成乙醛和二氧化碳的活性。进一步的酶催化活性研究发现,VvFrsA蛋白是一个酯酶,可以催化对硝基苯酚脂肪酸酯的水解,其最适底物是对硝基苯酚短链脂肪酸酯。这一发现与VvFrsA蛋白的晶体结构特征及氨基酸序列比对结果相一致。研究表明,VvFrsA蛋白具有酯酶的催化三联体[16-18],并且pNPA可以在VvFrsA的活性中心稳定存在长达300 ns(未发表数据)。本研究结果为后续对重组VvFrsA蛋白进行生化表征和对硝基苯酚乙酸酯水解的酶动力学与催化机制奠定了基础。
