山葡萄类黄酮-3-O-葡萄糖基转移酶基因的表达分析
2018-12-07袁赫海杨铭慧刘海峰
陈 蒙,袁赫海,杨铭慧,张 宇,刘海峰
(延边大学 农学院,吉林 延吉 133002)
山葡萄(Vitisamurensis)为葡萄科葡萄属,主要分布在吉林、辽宁和内蒙古等地区[1-2],是栽培范围最广泛的果树种类之一,在生产中具有重要地位。
山葡萄果皮颜色的深浅,主要取决于花色苷的含量[3-4]。花色苷功能很多,除了使植物器官产生不同颜色,还作用于种子传播、授粉、抵抗病原物侵染、防紫外线损伤等方面[5-7]。类黄酮-3-O-葡萄糖基转移酶(3GT)是花色苷生物合成途径中的关键酶,主要作用是将不稳定的花色苷转变为稳定的花色苷[8]。有学者对多种植物的3GT进行了研究[9-15],成功克隆出了3GT基因但均未进行蛋白方面的表达研究。本试验根据刘海峰等[16]的方法从山葡萄上分离克隆得到类黄酮-3-O-葡萄糖基转移酶基因(VAm3GT,GenBank登录号:FJ169463),应用实时荧光定量PCR法对山葡萄果皮8个不同转色时期的VAm3GT表达量进行分析并进行原核表达载体的构建。针对VAm3GT基因进行表达分析,证实克隆所获得的目的基因的准确性,旨在为全面开展花色苷的降解机制、花色苷稳定性研究提供依据。
1 材料和方法
1.1 试验材料与试剂
1.1.1 试验材料 山葡萄品种双丰(VitisamurensisShuang Feng)采自延边大学农学院山葡萄种质资源圃。于果实成熟期采摘,取果皮作为供试材料,置于液氮中冷冻,-80 ℃冰箱保存。
1.1.2 试剂 选用试剂盒GoScriptTM(Promega公司)进行RNA反转录;选用SYBR®GreenⅠ试剂盒(QIAGEN公司)进行实时荧光定量PCR检测;大肠杆菌(Escherichiacoli)的菌株DH5α和BL21、原核表达质粒pET28a由延边大学农学院保存; pMD18-T载体、ExTaq-聚合酶(TaKaRa公司);胶回收试剂盒、限制性内切酶(Promega公司);T4连接酶、SDS-PAGE电泳凝胶试剂盒(上海生工生物公司);其他试剂为国产分析纯。
1.2 引物的设计与合成
根据已克隆出的VAm3GT的ORF序列[9],设计符合实时荧光定量PCR要求的引物为VAm3GT1s:5′-TCGGAAATCTAAACTCGCTCTT-3′,VAm3GT1a:
5′-ATCATTGGTTAGGGAATCGTC-3′,及含有EcoRⅠ和SmaⅠ酶切位点的特异性引物为VAm3GT2s: 5′-cgGAATTCatgtctcaaaccaccaccaaccc-3′(下划线为EcoRⅠ酶切位点),VAm3GT2a:5′tcCCGGGCtagacatcctttggttttgacact-3′(下划线为SmaⅠ酶切位点)。
1.3 实时荧光定量PCR分析
山葡萄双丰分为8个取样时期:转色前Ⅱ期(花后4周)、转色前、转色10%、转色30%、转色50%、转色80%、转色100%、完熟期。采用改良CTAB法[17]提取山葡萄8个取样时期的总RNA并进行反转录。根据设计的实时荧光定量PCR引物进行扩增,内参基因选用action(Accession No.AB073011)。从8个取样时期的cDNA 模板中任选其一,依次稀释1、5、25、125、625倍制备标准曲线,反应设3个重复,扩增体系:2×QuantiNova SYBR Green PCR Master Mix10μL,QN ROX Reference Dye1 μL、引物A 0.5 μL、引物B 0.5 μL、RNase-Free H2O 7μL、模板cDNA1μL、总体积20 μL。扩增程序:95 ℃预变性2 min,95 ℃变性5 s,60℃ 退火30 s,60 ℃延伸30 s,40个循环,4 ℃保存。扩增完毕后,对实时荧光定量PCR产物进行熔解曲线分析。利用MxPro软件进行数据处理。
1.4 原核表达载体的构建
以VAm3GT全长cDNA为模版,根据设计的带有酶切位点的引物扩增ORF序列。PCR扩增程序:94 ℃ 预变性3 min,94 ℃ 变性 30 s,58 ℃ 退火30 s,72 ℃ 延伸 2 min,35个循环,72 ℃终加延伸5 min。
将含有EcoR Ⅰ和SmaⅠ酶切位点的VAm3GTORF和pET28a原核表达载体同时用EcoR Ⅰ和SmaⅠ进行双酶切,回收原核表达载体大片段和目的基因片段并用T4 DNA 连接酶16℃ 连接过夜,体系如下:10×T4 Ligase 2.0 μL、酶切PCR产物1.5 μL、酶切pET28a 3.0 μL、T4连接酶0.5 μL、ddH2O13.0 μL。将连接产物转化到大肠杆菌DH5α感受态细胞,涂布于100 mg /L氨苄抗性固体LB培养基37 ℃恒温箱中过夜培养,挑取单克隆进行PCR和双酶切鉴定。
1.5 重组蛋白的诱导表达及SDS-PAGE检测
将构建成功的重组质粒pET28a-VAm3GT转化到大肠杆菌BL21感受态细胞,经PCR鉴定后挑取阳性单克隆菌落接种于5 mL含100 mg/L卡那霉素的LB液体培养基中37 ℃过夜培养。取过夜菌100 μL转入5 mL含100 mg/L卡那霉素的LB液体培养基中37℃振荡培养至OD600=0.4~0.6时,加入诱导剂IPTG至终浓度分别为0.8、1.0、1.2 mmol/L。置于28 ℃下振荡培养8 h,获得诱导菌液。
重组蛋白的SDS-PAGE检测:取1 mL诱导菌液和诱导前样品,12 000 r/min离心1 min,收集菌体,加入200 μL PBS缓冲液悬浮菌体并用枪头吹打重悬,用反复冻融法裂解细胞;收集混合液后4 ℃、12 000 r/min离心20 min,上清和沉淀样品中分别加入100 μL 5×上样缓冲液并混匀,100 ℃水浴处理8 min。吸取30 μL加样于10% SDS-PAGE电泳,凝胶用考马斯亮蓝染色。
2 结果与分析
2.1 VAm3GT基因的表达分析
2.1.1 山葡萄果皮8个不同转色时期的总RNA 采用改良CTAB法[17]提取山葡萄8个不同转色时期的总RNA,如图1所示。使用核酸检测仪和凝胶成像仪检测RNA浓度和质量,保证RNA完整、无杂质污染,进行反转录。
M:DL 2000Marker,1:转色前Ⅱ期RNA,2:转色前RNA,3:转色10%RNA,4:转色30%RNA,5:转色50%RNA,6:转色80%RNA,7:转色100%RNA,8:完熟期RNA
2.1.2 8个不同转色时期VAm3GT基因的表达分析 选任一时期为对照,以action为内参基因进行实时荧光定量PCR,探究VAm3GT基因在8个不同转色时期的表达规律。如图2所示,VAm3GT基因从转色前Ⅱ期(花后4周)到完熟期表达量逐次递增,呈递增趋势。
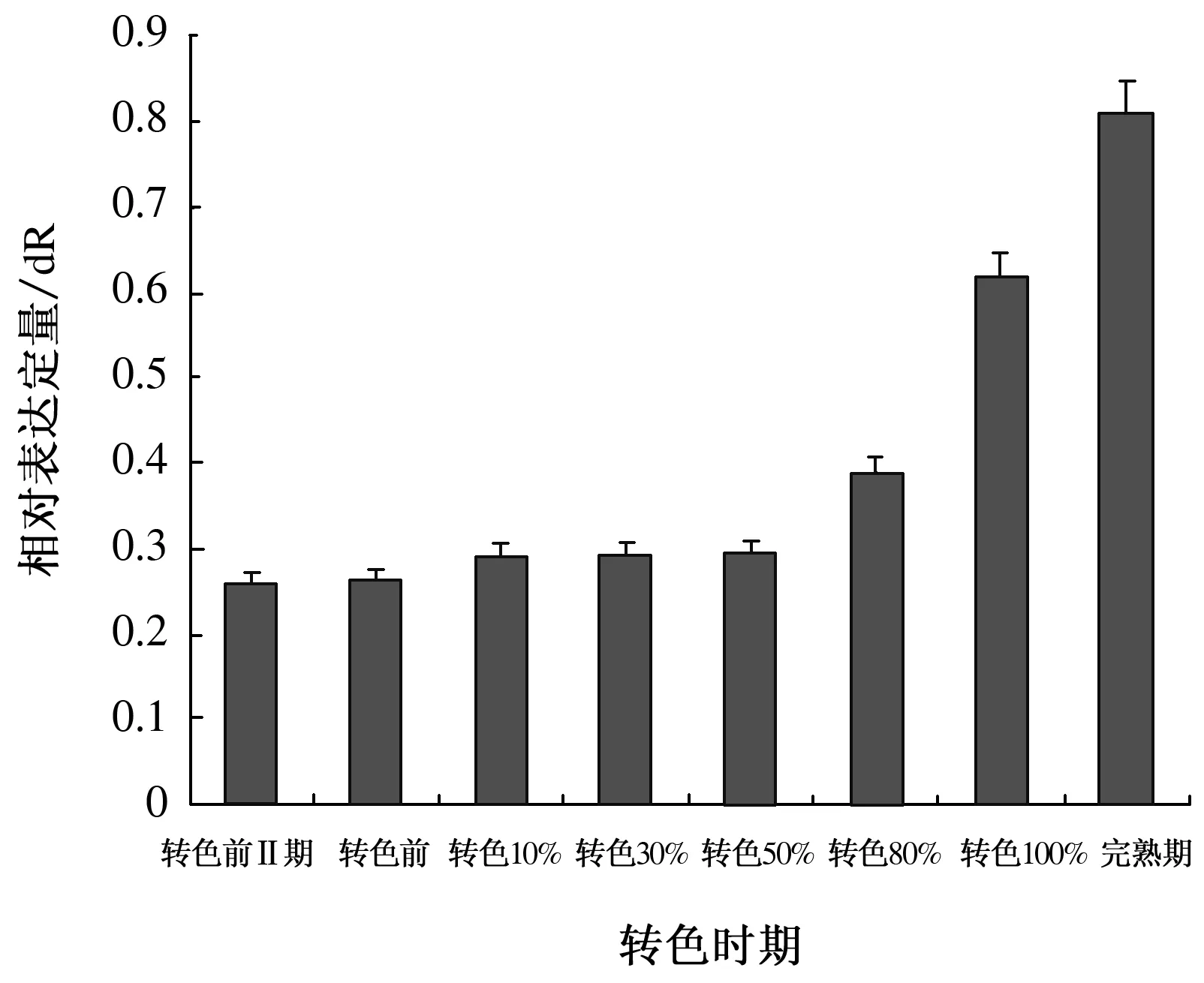
图2 VAm3GT基因在8个不同转色时期的表达
2.2 原核表达载体的构建
以VAm3GT全长cDNA为模版,PCR扩增含有EcoRⅠ和SmaⅠ酶切位点的VAm3GTORF序列,扩增产物在1 371 bp出现与预期相符的特异性条带(图3),回收进行测序鉴定正确后,用于表达载体的构建。将目的片段和表达载体pET28a进行双酶切,用T4 DNA连接酶连接后,获得重组质粒pET28a-VAm3GT原核表达载体,转化并进行PCR鉴定,结果表明,获得的目的条带与预期大小一致,且测序正确,原核表达载体已构建成功。

M:DL 2000Marker,1:目的基因,2:目的基因酶切片段,3:pET28a质粒双酶切,4:重组质粒VAm3GT特异扩增检验
2.3 重组蛋白的诱导表达
将重组质粒pET28a-VAm3GT转化感受态细胞BL21后,加入IPTG诱导菌体表达。在28 ℃培养条件下对IPTG浓度进行筛选,分别为0.8、1.0、1.2 mmol/L,并进行SDS-PAGE电泳检测。目的蛋白在上清中且IPTG诱导浓度为0.8 mmol/L(图4A),约50.19 ku处有一条与预测重组VAm3GT蛋白相对分子质量大小一致、较高浓度的诱导表达带,沉淀与对照组均未出现目的蛋白条带(图4B)。

M:分子质量标记,1:对照(未经IPTG诱导),2:0.8 mmol/L IPTG,3:1.0 mmol/L IPTG,4: 1.2 mmol/L IPTG
3 结论与讨论
3.1 VAm3GT基因的表达水平分析
8个不同转色时期VAm3GT基因的表达量呈递增趋势,这与彩色马铃薯中3GT基因表达规律相同[18]。黄春辉等[19]证实了花青苷的积累与3GT基因的含量增加具有相关性,因此推测山葡萄果皮逐渐由绿色转变为深红色是由于3GT基因的不断积累。
王惠聪等[7]对荔枝果皮花青苷的研究表明,3GT活性的变化与花青苷含量的变化趋势吻合,随着妃子笑果皮中3GT活性的增加花青苷含量上升。Owens[20]在红葡萄果皮中检测到3GT的表达,而在无花色素苷积累的白葡萄及红葡萄其他组织中没有检测到3GT的表达。3GT酶在山葡萄果皮发育期至全红期表达量缓慢增加,到果实完熟期表达量大幅度增加,催化花青素大量合成。果实在转色前期没有花青素的积累但3GT表达量仍然很高,由此推测山葡萄发育前期3GT酶参并催化合成了黄酮醇类物质[21]。综上所述,VAm3GT基因促进了花色苷的积累,而其含量的增高是否受其他因素如光照、调节酶等影响还有待进一步研究。
3.2 原核表达获得表达蛋白
外源基因能否成功在大肠杆菌中正确表达,受诸多因素影响。不同植物3GT基因的蛋白质分子质量均在50 ku左右。SDS-PAGE电泳检测分析表明,目的蛋白在上清中且IPTG诱导浓度为0.8 mmol/L处有一条与预测重组VAm3GT蛋白相对分子质量大小一致、较高浓度的诱导表达带,沉淀与对照组均未出现目的蛋白条带,这可能与原核表达目的蛋白通常以包涵体的形式表达有关。目的蛋白在IPTG浓度相对低时大量表达,这一结果与牟利等[22]对青稞F7-OMT基因的原核表达分析结果一致。VAm3GT基因在适宜的诱导条件下可得到稳定表达的可溶性目的蛋白。通过对该基因的原核表达,进一步证实了克隆所获得的目的基因的准确性。
本研究成功构建表达载体pET28a-VAm3GT,在28 ℃、8 h,IPTG诱导浓度为0.8 mmol/L条件下,目的蛋白在上清中有较高的表达量,获得了具有较高可溶性且能够高效表达的目的蛋白。为VAm3GT酶活分析、蛋白的纯化以及多克隆抗体的制备等后续试验奠定了基础。
