血睾屏障中支持细胞间紧密连接结构和功能的研究进展
2018-12-07陈楸蕗陈德宇
陈楸蕗 刘 明 陈德宇*
( 1.阜阳师范学院附属中学,安徽 阜阳 236041;2.阜阳师范学院生物与食品工程学院,安徽 阜阳 236037 )
在睾丸中,生精小管和血液之间存在着血睾屏障(bloodtestis barrier,BTB),其组成包括间质的毛细血管内皮及其基膜、结缔组织、生精上皮基膜和支持细胞间的紧密连接( tight junction,TJ),TJ是构成BTB的主要结构[1]。支持细胞紧密连接异常导致生精细胞在生精小管内的移行受阻可能是寡精症的病因之一[2]。精子发生是一个极其复杂的过程,在细胞、生物化学和分子水平上受到不同分子和不同通路的调节。因此,揭示BTB内TJ动力学过程及其在重建过程中的调节机制,有利于理清精子发生的机制。本综述重点分析血睾屏障中支持细胞间紧密连接的结构和功能。
1 支持细胞
1.1 支持细胞的结构
支持细胞(Sertoli cells)是为发育中的精子提供保护和营养的细胞,精子发育的各个阶段均发生在支持细胞之间。支持细胞呈锥体形,形状不规则,细胞基部紧贴基底膜,顶部可以到达生精小管的管腔,细胞侧面和腔面凹凸交错,相邻细胞间镶嵌着各级生精细胞,细胞侧面近基部的相邻细胞膜形成TJ,将生精上皮分成基底室和近腔室。基底室位于生精上皮基膜和支持细胞TJ之间,内有A型和B型精原细胞;近腔室靠近生精小管管腔,含有精子细胞和精子[3]。精子发生时B型精原干细胞分化到精母细胞需要跨越TJ进入近腔室,才能进一步的发育成成熟精子(结构示意图见图1)[4-5]。因此,精子发生时生殖细胞穿越生精上皮的运动同TJ的结构重建密切相关。
1.2 支持细胞的功能
支持细胞的功能主要包括:提供结构性支持;创建形成血睾屏障;参与生殖细胞的运动和排精;通过分泌产物滋养生殖细胞等[6]。

图1 精子发生时生精细胞穿越TJ模式图[4]
1.2.1 结构性支持 支持细胞有着丰富的细胞骨架。这些细胞骨架在维持支持细胞形状、细胞器定位、细胞连接的形成、定位锚定辅助生精细胞的运动以及精子的释放中起着重要作用[7]。它由肌动蛋白、中间丝和微管组成。肌动蛋白丝由相对分子质量为42 kDa的肌动蛋白单体组成,单体聚合成8 nm宽的螺旋线性链。有两种肌动蛋白单体,肌动蛋白G和肌动蛋白F。中间丝聚集于细胞外基质附着部位,参与桥粒连接和半桥粒连接。微管由微管蛋白构成,已经确定了至少6种微管蛋白,包括α、β、δ、ε、γ和ξ[8-12]。
1.2.2 形成血睾屏障 血睾屏障又称生精上皮屏障,位于生精上皮基底三分之一的支持细胞紧密连接处。血睾屏障将生精上皮划分成两个隔室,一个是基底室,内有精原细胞、细线前期细胞和细线期细胞。另一近腔室内含有精子细胞[13]。
血睾屏障有3个主要功能:创造一个专门的微环境;调节分子的通过;用作免疫屏障[14]。首先,血睾屏障创造的微环境有利于生殖细胞发育和运动。比如,生殖细胞位于管腔内无法获得血清铁,但支持细胞可以将其合成的转铁蛋白分泌至微环境内,供生精细胞生长发育。营养物质和废物进出生精上皮主要靠血睾屏障的调节。血睾屏障创建了一个免疫屏障,确保免疫系统不能识别存在于生殖细胞表面的特异性抗原。最近的研究表明,支持细胞和生殖细胞通过产生干扰素(interferon,IFN)、白介素(interleukins,ILs)和细胞因子来维持独特的防御系统。血睾屏障也阻止免疫球蛋白和淋巴细胞进入近腔室[15-17]。
与血脑屏障相比较,血睾屏障的不同之处在于它必须定期开启,以保证精子发生过程中生殖细胞的通过。例如,发育中的细线前期/细线期的精母细胞必须穿过血睾屏障。这个过程牵涉到紧密连接的解离和重组。但生殖细胞在血睾屏障内的运动机制未被充分解析。另外调节血睾屏障形成和维持其稳定的因素目前还不清楚。其主要原因是关于血睾屏障生物学信息的缺乏,以及缺乏适合用来研究支持细胞紧密连接动力学的体外和体内模型[18]。
1.2.3 协助生殖细胞移位 支持细胞直接参与生精细胞的运动,因为生精细胞缺乏迁移细胞的结构特征。生殖细胞运动的潜在机制可能涉及三磷酸鸟苷(guanosine triphosphate,GTP)酶超家族的成员。有研究表明伸长/延长的精子细胞跨生精上皮的易位主要是由胞外基质赋予的。微管连同几种运动相关蛋白,如动力蛋白、肌球蛋白VIIa、腺嘌呤核苷三磷酸酶和GTP酶协助精子细胞在生精上皮内迁移。不过仍有许多问题需进一步解答。比如,如果生殖细胞的运动必须与它们的发育状态相一致,那么什么信号决定了上皮周期中精细胞在上皮细胞中的适时运动?什么是调节外质特化重组的机制?当细胞需要向前移动时,如何向支持细胞发出信号?要回答这些问题,必须完全阐明胞外基质的生物化学结构。另外支持细胞也协助早期减数分裂的精母细胞从基底到腔室的移位。这一过程可能需要支持细胞间和支持-生殖细胞连接的分解与重新组装,是一个高度选择性的过程。比如A型精原干细胞必须保留在基底膜上,不能移动。这就需要一个高效的选择机制来确定哪些特定类型的细胞可以穿越生精上皮[19]。
1.2.4 排精 这个过程涉及一系列细胞生物学事件,包括:支持细胞细胞质包裹精细胞;从支持细胞近腔端驱离精子细胞;精细胞的释放。
1.2.5 吞噬 精子细胞变态成精子过程中释放出来的残余成分,以及在精子发生过程中退化的生殖细胞都由支持细胞负责吞噬清理[20]。
1.2.6 提供营养 支持细胞合成的氨基酸、碳水化合物、脂质、维生素和金属离子需要足量地递送到血睾屏障后面的精子细胞和精子中。营养物质从支持细胞转移到生殖细胞理论上是可能的。单独培养生殖细胞时,最多存活24 h,如果与支持细胞共培养,生殖细胞可以在体外存活达8 d左右。这一现象提示支持细胞可以给生精细胞提供养分[21]。
2 紧密连接
在睾丸中,紧密连接是由原纤维组成的相邻细胞的质膜(通常为50~100个)完全包围每个细胞的基底区域之间紧密接触的区域。其主要成分是occludin和claudin蛋白[22]。与在其他上皮细胞形成的紧密连接不同,睾丸中紧密连接的连接位置独特,因为它们最接近基底膜,基底膜是细胞外基质的修饰形式。
2.1 紧密连接的功能
紧密连接有两个主要功能:形成屏障以及形成相对封闭的空间。首先,紧密连接会产生一个半渗透的屏障,限制分子的通过。分子的通过在很大程度上取决于它们的相对分子质量和化学性质。实际上,为适应不同器官的生理需求,紧密连接的渗透性在不同组织中不一样,且可以调节。蛋白酪氨酸磷酸酶抑制剂原钒酸钠能够干扰MDCK细胞紧密连接的通透性,表明蛋白酪氨酸和丝氨酸/苏氨酸磷酸酶抑制剂可能干扰支持细胞紧密连接屏障的装配。其次,睾丸中紧密连接形成的边界将支持细胞分成基底和近腔两部分,这被称为紧密连接的围栏功能。该功能赋予上皮细胞的极性。紧密连接的栅栏功能阻止了两个区域之间的分子如蛋白质和脂质的混合[23]。
2.2 紧密连接相关的蛋白
2.2.1 ZO-1 ZO-1是一种210~225 kDa的外周膜蛋白,与上皮细胞和内皮细胞中的紧密连接相关。ZO-1与occludin的C末端相连,ZO-1与occludin的化学计量比为1∶1。ZO-1还与上皮细胞和非上皮细胞中的肌动蛋白和α-连环蛋白相关联,当上皮细胞的紧密连接受到损害时,ZO-1从紧密连接部位解离并返回胞内。这个过程是由肌动蛋白细胞骨架介导的。在睾丸中,ZO-1几乎完全定位于血睾屏障的支持细胞紧密连接处。研究表明[24], ZO-1有两种不同的异构体a-和 a+,它们分别是mRNA选择性剪接的不同产物。ZO-1a-和ZO-1a+分别在成年期和青春期表达,表明这些同种型对于紧密连接解体和组装至关重要。除occludin外,ZO-1还可与其他蛋白如F-actin、JAM、claudin-1、cingulin、spectrin、PAR-3和Rab8等相结合[25]。
2.2.2 ZO-2 ZO-2的相对分子质量为160 kDa,定位于睾丸内。ZO-2的3个MAGUK结构域与ZO-1有51%的同源性,但C端仅有25%的同源性。ZO-2可以被PKC-þ,-c,-h磷酸化,说明它可以被蛋白激酶激活。其他体外和体内研究已经证明ZO-2能够结合occludin和claudin蛋白[26]。一些报道还证实了ZO-2能够与F-肌动蛋白和α-连环蛋白的关联,提示该分子也可能参与黏附连接的调节[27]。
2.2.3 ZO-3 ZO-3首先被鉴定为MDCK细胞中的130 kDa多肽并命名为p130,随后的研究发现它与ZO-1及ZO-2有高度同源性,因此被重新命名为ZO-3。在MDCK细胞中,ZO-3与ZO-1和ZO-2一样,在丝氨酸和酪氨酸残基上都可以磷酸化。免疫荧光显微结果和免疫电镜显微结果均显示ZO-3与ZO-1共定位于紧密连接处。其他研究发现它与occludin、claudin、actin和Pals1相关的紧密连接蛋白相互作用,但与ZO-2不相关[28]。
2.2.4 occludin蛋白 occludin是装配紧密连接的重要蛋白质[29]。人的occludin基因定位于5q13.1,其相对分子质量为64 kDa,由504个氨基酸组成,共有4个跨膜结构域,其羧基端和氨基端都位于胞膜内的胞质区,细胞膜外有2个细胞外环,它们富含丝氨酸、苏氨酸和酪氨酸残基,分别叫Occ-1和Occ-2。Occ-1有由大约60%的酪氨酸和甘氨酸残基组成,能够形成疏水结构,相邻Sertoli’s细胞间的Occ-1外环交错形成封闭区域,参与细胞间黏附;Occ-2对紧密连接有特异性的调控功能,是组装进紧密连接的必需结构域,参与旁细胞屏障的形成(其分子结构见图2)。相邻支持细胞occludin的胞外环通过“亲吻式接触”,以拉链结构开启或关闭细胞的紧密连接[30](其结构见图3)。occludin蛋白与多种疾病相关:在肠上皮中,occludin 组装的TJ起着保护肠黏膜的作用,occludin表达异常会出现肠炎腹泻等症状[31];作为血脑屏障的组分,occludin表达异常会引起血-脑屏障的功能紊乱[32];作为上皮保护屏障,occludin与病毒感染相关[33-34];肿瘤细胞的浸润和转移与细胞间连接力的丧失有关,occludin下调或缺失会加速肿瘤细胞发生和转移[35];作为TJ的组分,occludin是生精上皮中支持细胞间形成TJ结构的基础,其程序性的开启与关闭保证了精子发生正常进行,若异常开放则会影响精子发生的正常进程。干扰睾丸支持细胞内occludin蛋白的功能状态,会导致不育[36-37]。BTB的TJ不同于血脑屏障及其他屏障的TJ,它关系到精原细胞在支持细胞间的运行及分化,牵涉到支持细胞间TJ的瓦解和重建,但其调控机制未见深入报道。因此研究和探讨TJ瓦解和重建的分子机制,特别是分析occludin在此过程中的动态进程,对进一步了解精子发生的分子机制及寡精症病因的解析具有重要意义。
2.2.5 claudin蛋白 claudin超家族至少有24种蛋白,是紧密连接的主要构件之一,它完全定位于紧密连接部位。claudin的拓扑结构与occludin相似,除了claudin的细胞质结构域和第二个细胞外环明显更小以外,不同的claudin蛋白与occludin并无任何显著的序列同源性。每种claudin的表达模式在不同的组织中差异很大。claudin 11主要表达于睾丸和大脑,在肾脏中也几乎检测不到。claudins是否磷酸化尚不清楚,但claudins的C末端含有蛋白激酶C(protein kinase C,PKC)、酪蛋白激酶2和cAMP依赖性蛋白激酶的磷酸化位点。事实上,各种claudins之间的最大差异在于它们的C端,这表明claudins的C末端是参与不同器官中紧密连接的关键位点。C末端的最后两个氨基酸残基Tyr-Val存在于大多数claudins中,是它们与PDZ结构域相互作用所必需的氨基酸。研究表明细胞在任何时候都可以表达两种以上的claudin蛋白,而且两种细胞之间不同claudin蛋白的组合决定了紧密连接的通透性和物理尺寸[38]。这决定了不同细胞和组织紧密连接的独特性质。睾丸内有7种不同的claudins,即claudins 1、3~5、7~8和11。claudin 11是睾丸中唯一被详细研究的紧密连接蛋白,仅定位于支持细胞的血睾屏障部位。在小鼠睾丸中,claudin 11表达模式与出生后第6~16天的血睾屏障的组装一致,并且在FSH和TNF-α的作用下其在支持细胞中的表达可被抑制。更重要的是,基因敲除实验证明缺乏claudins 11的小鼠是不育的[39],表明血睾屏障的完整性对于正常精子发生至关重要。
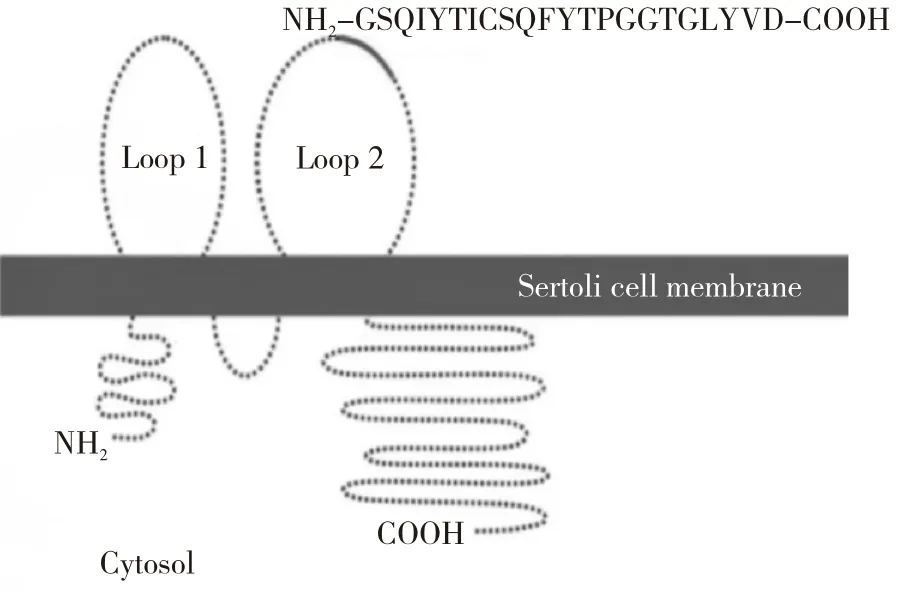
图2 occludin分子结构模式图[29]
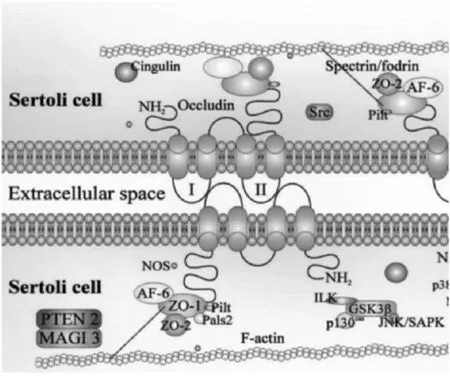
图3 相邻支持细胞occludin形成TJ模式图[29]
2.2.6 JAMs JAM是新近研究的免疫球蛋白超家族成员,主要定位于上皮细胞和内皮细胞紧密连接部位。不过尚无确切实验证明JAM是否是紧密连接的实际组成部分。到目前为止,已经确定了3个JAM成员,即JAM 1~3,Northern印迹证明了JAM1和2在睾丸中的表达[40]。JAM与occludin、ZO-1和cingulin共定位。其他报道[41]表明,JAM与AF-6、ASIP / PAR-3、MUPP1蛋白和钙/钙调蛋白依赖性丝氨酸蛋白激酶相关。使用抗JAM抗体后,白细胞通过内皮细胞的迁移被抑制;TNF-α和IFN-γ的掺入会导致JAM在细胞内的再分布,可以增强白细胞在脐静脉内皮细胞上的迁移[42]。这些结果提示JAM与细胞运动相关。但JAM如何调控生精细胞的迁移,有待进一步研究。
2.2.7 柯萨奇病毒和腺病毒受体(CAR)CAR是一种46 kDa的跨膜蛋白,具有跨膜、胞质区、胞外区域和两个免疫球蛋白样结构域。虽然现在推测CAR在紧密连接动力学中的功能还为时过早,但CAR能够介导病毒附着和感染。例如,柯萨奇病毒和腺病毒是两种肠道病毒,其在感染过程中穿过上皮(胃肠道或呼吸道)中的紧密连接处,导致紧密连接完整性的丧失,然后运行到心脏和大脑。其运行机制可能与JAM(最近被确定为哺乳动物呼肠孤病毒的受体)和claudin(也可以作为产气荚膜梭菌肠毒素的受体)类似。在非极化细胞中,CAR定位于细胞间接触处,说明CAR可促进细胞黏附。在极化的上皮细胞中,CAR和ZO-1共定位在紧密连接部位。CAR的过表达能够增强屏障功能。最近研究发现CAR在小鼠的生殖细胞中有表达,但其在支持细胞中的功能仍有待确定[43]。
2.2.8 其他蛋白 在紧密连接部位陆续发现了几个其他紧密连接相关蛋白:Cingulin、symplekin、血影蛋白/胞影蛋白、7H6、AF-6、PAR-6、非典型PKC、Sec 6、Sec 8、Rab13、ab3B、ZONAB、ASH1、19B1、ASIP、MAGI蛋白和WNK1激酶。
3 展 望
关于连接动力学的研究已经成熟,研究人员对确定连接处复合物是如何被组合成能紧密和黏附连接点感兴趣。有关紧密结合和生殖细胞运动之间的相互关系有几个问题仍不清楚。例如,一个典型的上皮细胞如何感知极性/方向,使得紧密和黏连连接可以被正确组装?细胞连接装配/拆卸与内吞之间是否有联系?底层肌动蛋白细胞骨架涉及到什么程度?大多数情况下,细胞连接以这样的方式组装,即它们可以固有区分上皮细胞的顶端区域和基底外侧区域。体外的紧密连接也需要在膜表面积上急剧增加,最终形成一个高的柱状上皮。此外,在紧密连接组装之前,功能性黏连连接必须首先被组装,相关蛋白如何顺序性执行功能仍有待深入探讨。这些问题的解答对于精子发生的阐释具有重要意义。
