不同表面修饰的氧化铁纳米颗粒对A549细胞的毒性及DNA损伤
2018-12-07文海若郭雅娟黄芝瑛王
文海若郭雅娟 # 黄芝瑛王 雪 * 淡 墨*
(1.中国食品药品检定研究院国家药物安全评价监测中心,药物非临床安全评价研究北京市重点实验室,北京 100176;2.中山大学药学院,广东 广州 510006)
纳米技术是21世纪最重要的科学技术成果之一,纳米材料独特的物理化学性质及其与生物体的相互作用为其应用于医药领域提供了广阔的前景。1995年美国FDA批准了第1个纳米药物Doxil上市[1],紧接着在1996年美国FDA又先后批准了两种静注磁性氧化铁纳米颗粒(iron oxide nanoparticle,IONP),分别为Ferumoxil和Ferumoxide,用于肝损伤和肿瘤的核磁共振造影(MRI)诊断[2-3]。IONP是常见的生物医用纳米材料,其生物相容性较好,且在诊断和杀伤神经胶质瘤方面效果尤为卓越[4-5]。然而不同表面修饰可导致纳米材料与细胞的相互作用产生明显差异,从而可能影响其体内成像效果和抗肿瘤疗效。
肺脏是人体纳米材料暴露的主要器官之一,文献中已有纳米氧化铁致肺脏损伤的报道。II型肺泡上皮细胞是肺脏功能单位肺泡的重要组成部分,人肺腺癌细胞A549细胞与II型肺泡上皮细胞具有相似的生理功能,可通过内吞作用吞噬纳米颗粒,且是肺脏毒性的常用体外评价模型[6-7]。
胺基(Amine)和聚乙二醇[poly(ethyleneglycol),PEG]是常见的纳米材料表面修饰基团,可赋予纳米颗粒不同的表面电荷及细胞作用特征。前者携带正电荷,与带有负电荷的PEG相比,经胺基修饰的纳米材料更易于与表面带负电荷的细胞相互作用。本研究首先通过比较相同粒径范围(约5 nm)的胺基表面修饰的纳米氧化铁颗粒(Amine-IONP)和聚乙二醇表面修饰的纳米氧化铁颗粒(PEG-IONP)对A549细胞存活率和细胞周期的影响;之后使用高内涵法评价经不同纳米氧化铁颗粒处理后胞内活性氧簇(reactive oxygen species,ROS)含量、线粒体膜电位(mitochondtial membrance potential,MMP)和内质网(endoplasmic reticulum,ER)状态 指标的变化;然后采用体外胞质分裂法微核试验和碱性彗星电泳评价其对DNA损伤的影响,从而综合比较不同表面修饰的氧化铁纳米颗粒对A549细胞的毒性及其作用机制的差异。研究联合使用氧自由基清除剂乙酰半胱氨酸(N-acetylcysteine,NAC)和叔丁基对羟基茴香醚(butylated hydroxyanisole,BHA)来进一步评价氧化应激作用与DNA及染色体断裂的关联。
1 材料与方法
1.1 主要试剂与仪器
主要化学试剂包括:平均粒径为5 nm的PEGIONP(生产批号MKBR4497V)和Amine-IONP(生产批号MKBR2641V),以及遗传毒性阳性剂丝裂霉素C(mitomycin C,MMC)和甲磺酸乙酯(ethyl methanesulfonate)均购自Sigma Aldrich公司;Cell Titer-Glo 2.0试剂盒购自Promega公司;PI/RNase染液、乙酰半胱氨酸(NAC) 和叔丁基对羟基茴香醚(BHA)购自Invitrogen公司;细胞核荧光探针Hoechst 33342、胞内活性氧检测荧光探针DCFH-DA、线粒体膜电位检测荧光探针Mito Tracker®Red CMXRos、内质网应激水平检测荧光探针ER-Tracker Red和SYBR Green I nuclei acid gel stain购自Life Technologies;Trevigen Comet Assay Kit彗星检测试剂盒购自Trevigen公司;anti-p21抗体、anti-p53抗体、anti-β-tubulin抗体购自SANTA CRUZ。
主要仪器包括:Zetasizer Nano ZS90纳米粒径电位分 析 仪(Malvern);FACS CaliburTM流 式 细 胞 仪(BD);Mini-PROTEAN®Tetra Cell 系 统 (BIO-RAD), SPECTR Amax-PLUS型酶标仪(Molecular Devices);5810R型离心机(Eppendorf);DYCP31F 型电泳仪(北京市六一仪器厂);Eclipse 80i荧光显微镜(Nikon);Komet 6.0图像分析系统(Andor Technology);IN Cell 2 000高内涵分析仪(GE Healthcare)。
1.2 细胞
人肺腺癌II型肺泡基底上皮细胞A549由中国医学科学院基础医学研究所基础医学细胞中心提供,液氮中保存。本研究所用细胞代数在第90~100代,细胞倍增时间约20~24 h,支原体检测结果为阴性。
1.3 氧化铁纳米颗粒的粒径分布和表面电性测定
Amine-IONP与PEG-IONP分别经RPMI 1640培养基稀释到一定浓度后,使用动态光散射法(dynamic light scattering,DLS)检测颗粒在细胞培养液中的颗粒分布和表面带电性。经测定两种不同表面修饰的5 nm氧化铁纳米颗粒在细胞培养液中均匀分布,无明显聚集。PEG-IONP颗粒平均分布为(5.6±0.4) nm,表面带电为-2 mV;Amine-IONP颗粒平均分布为(5.3±0.7)nm,表面带电为+13 mV[8]。
1.4 细胞存活率测定
使用RPMI 1640培养液(含10%热灭活小牛血清,青霉素100 U/mL、链霉素100 μg/mL)培养A549细胞,并分别更换无菌注射用水及不同浓度(20、40、80、160、 320 μg/mL)的 Amine-IONP和 PEG-IONP处 理 48 h,每浓度8个复孔。保留孔内原培养基,加入等量Cell Titer-Glo®2.0 Reagent,室温孵育10 min后立即检测生物发光强度。因各浓度条件下细胞存活抑制率均<20%,整个研究中Amine-IONP和PEG-IONP均使用上述浓度范围开展。
1.5 细胞周期检测
细胞经不同浓度处理24 h后在4 ℃预冷的70%乙醇溶液中固定,并在-20 ℃保存过夜处理。每样加入500 μL PI/RNase染液室温避光孵育30 min,并使用流式细胞仪检测,每组分析2×104个细胞计算细胞增殖指数(proliferation index,PI),分析软件为ModFit LT(Verity Software House)。
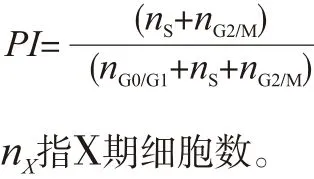
1.6 p21和p53蛋白表达水平测定
细胞经不同浓度PEG-IONP处理24 h后,经裂解液冰浴裂解20 min。细胞裂解经匀浆后备用。样本经BCA试剂盒定量后,每个样品取约20 μg总蛋白加至含4%浓缩胶和10%分离胶的SDS-PAGE电泳(浓缩胶50 V恒压电泳40 min,待样品进入分离胶后,更换电压至100 V恒压电泳直至克罗宁、溴酚蓝迁移至凝胶边缘),并转至PVDF膜(100 V电泳转移90 min)。转膜完毕后,将膜放入含5% BSA-TBS中,室温摇动1 h以封闭膜上的非特异结合位点。之后将膜用TBS/T洗3次,每次5 min。洗涤完毕后,将膜放入容器中,分别加入稀释 于 1% BSA-TBS/T中 的 anti-p21(1∶ 200)、 anti-p53(1∶200)和anti-β-tubulin(1∶5 000)抗体,4 ℃置于摇床上,平缓摇动过夜。一抗标记后取出膜,用TBS/T洗3次,将膜重新放入容器中,加入5 000倍稀释于1%BSA-TBS/T中的辣根酶标记二抗。室温平缓摇动1 h后,取出膜,用TBS/T洗3次。在膜上加入化学发光试剂后在暗室内显色曝光。试验重复3次。
1.7 氧化应激相关指标检测
1.7.1 胞内ROS含量测定 细胞接种及给药方法同上,每个试验条件每个浓度设复孔8个。孵育结束后弃去孔内原有培养基,每孔加入100 μL含Hoechst 33342 (终浓度2.5 μg/mL)和H2DCFDA(终浓度10 μmol/L)的培养基混合液,胞内ROS通过将H2DCFDA去乙酰化而使其在495 nm激发光下发射绿色荧光,根据荧光强度来反映胞内ROS的含量。
1.7.2 线粒体损伤水平的测定 每孔加入100 μL含Hoechst 33342(终 浓 度 2.5 μg/mL)和 MitoTracker®Red CMX Ros(终浓度100 nmol/L)的培养基混合液,探针进入细胞后在状态正常的线粒体内蓄积,固定过程可以去除膜电势下降的居于线粒体中的探针,因此可以根据荧光探针的数量来反映线粒体的状态。
1.7.3 内质网损伤水平的测定 每孔加入100 μL含Hoechst 33342(终浓度2.5 μg/mL)和ER-Tracker Red(终浓度1 μmol/L)的培养基混合液,内质网表面突出表达磺酰脲受体与ER-Tracker结合,因此根据结合的ERTracker的多少可以反映内质网的功能状态。分别加入上述染料后,细胞在37 ℃培养30 min,之后移除含染料的培养基,使用PBS 100 μL清洗2次,每孔加入50 μL含5%甲醇的PBS溶液固定,使用IN Cell 2000型高内涵系统进行检测。
1.8 彗星试验
彗星试验方法详见前期研究[9],简述如下。调整A549细胞达对数生长期后,更换不同浓度Amine-IONP和PEG-IONP和阳性对照(EMS,200 μg/mL)分别处理48 h,之后收获细胞并将密度调整为2×105/mL。1.5 mL试管37 ℃水浴预热,每管预先加入300 μL Comet LMAgarose(Trevigen Comet Assay Kit彗星检测试剂盒中琼脂糖凝胶制备试剂)。每孔取单细胞悬液30 μL,用移液头与预热的Comet LMAgarose迅速混合均匀1~2次后铺片,保证细胞均匀分布于每孔,每个样本平行2孔。铺片结束后将玻片置于4 ℃、避光、过夜裂解。之后将玻片码放在电泳槽内,缓缓添加预冷的碱性解旋液(pH>13),室温、避光解旋20 min。电泳条件为电压约0.7 V/cm,电流约300 mA,电泳时间20 min。玻片经中和、脱水处理后晾干。
染色时将稀释过的SYBR Green I(1∶10 000)加在每孔表面,4 ℃冰箱放置5 min,室温、避光晾干。使用Komet 6.0(Andor Technology)彗星图像分析软件进行分析。每个样品至少计数100个彗星细胞的尾部DNA百分率(percentage of tail DNA)和Olive尾矩(Olive tail moment)的中位数。
1.9 胞质分裂阻断法微核试验
A549细胞接种于6孔细胞培养板,每孔4×105个,培养约48 h,待细胞生长良好并达到对数生长期更换不同浓度培养液。在无代谢活化条件下,给予不同浓度的PEG-IONP和Amine-IONP处理48 h;另设灭菌注射用水溶媒对照组和MMC(0.1 μg/mL)阳性对照组处理24 h。每个处理条件设3个复孔。与细胞作用约24 h后更换含CytoB(3 μg/mL)的培养液继续培养至约24 h。细胞收获时,用胰酶-EDTA液消化细胞,将消化后的细胞悬液移至15 mL离心管,1 000 r/min离心5 min。用DPBS洗涤2次,加入用预温的0.075 mol/L KCl溶液2 mL于 37 ℃低渗处理5 min;加入固定液(甲醇∶冰醋酸体积比为3∶1)5 mL固定,1 000 r/min离心5 min,弃上清液,重复固定2次。滴片制备标本并编号。固定后的玻片标本浸入5% Giemsa应用液中,染色25~30 min;将染色后的标本先后置于自来水、超纯水中冲洗干净,室温下自然干燥。
显微镜下观察并计数每个剂量组的Giemsa染色玻片标本中:每2 000个双核细胞中微核(micronucleus,MN)和核质桥(nucleoplasmic bridge,NPB)出现率[10]。
1.10 氧自由基清除剂预处理
为评价氧化应激作用对细胞染色体和DNA断裂的影响,A549细胞经不同浓度Amine-IONP和PEG-IONP处理前,先给予氧自由基清除剂在BHA(100 μmol/L)或NAC(1 mmol/L)预处理30 min。之后分别如前开展ROS水平测定、微核试验和彗星试验测定。
1.11 结果分析
2 结 果
2.1 氧化铁纳米颗粒对A549细胞存活率的影响
320 μg/mL Amine-IONP和PEG-IONP与A549细胞作用24 h或48 h后,细胞的形态无明显改变且细胞表面无明显的颗粒团聚(图1)。处理浓度为160 μg/mL及以下时Amine-IONP和PEG-IONP对细胞存活率均无明显抑制作用。当处理浓度达到320 μg/mL时,与无菌注射用水溶媒对照组比较,仅PEG-IONP处理48 h后的细胞存活率明显降低(P<0.01,图2)。
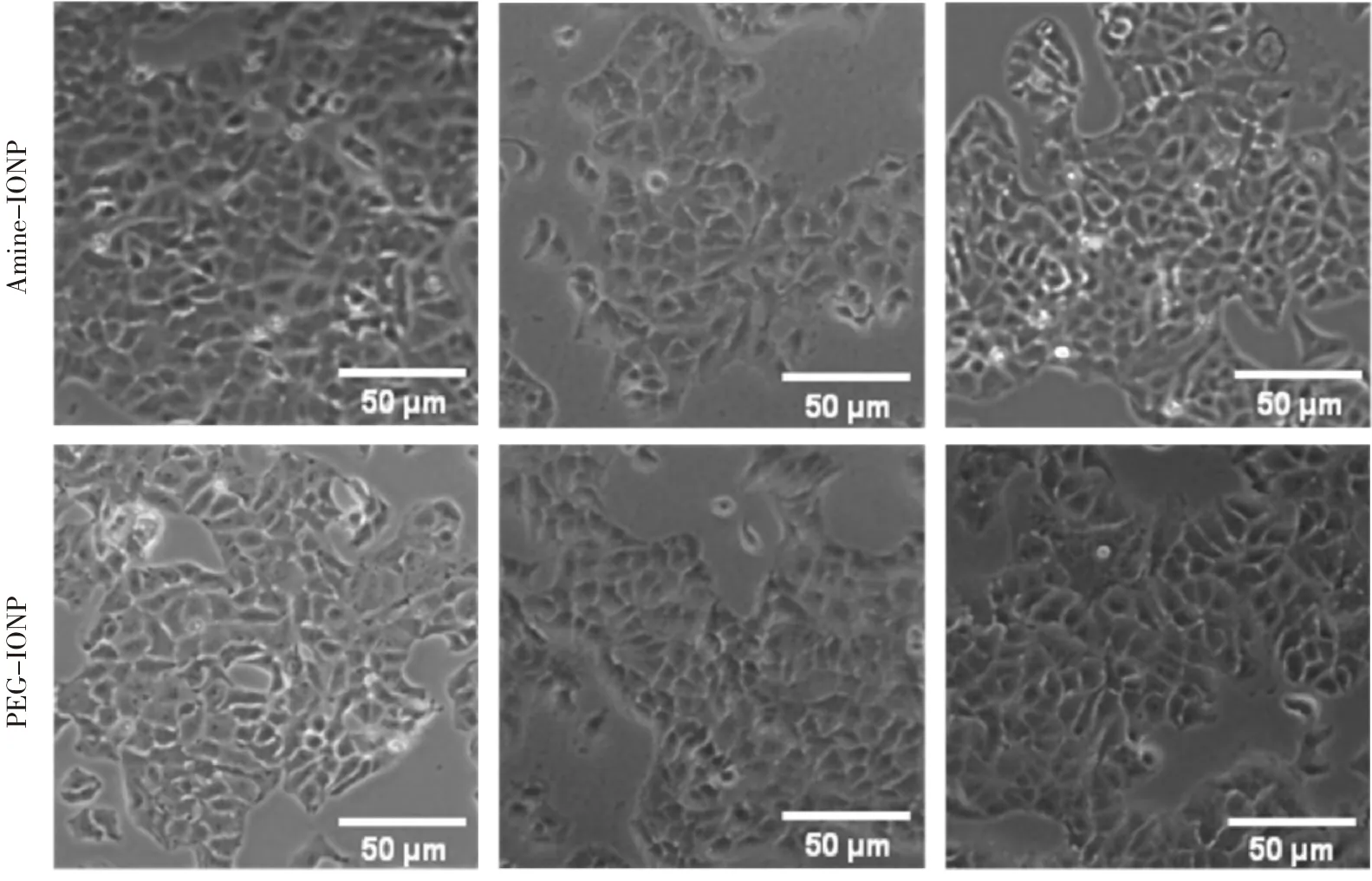
图1 A549细胞分别经Amine-IONP和PEG-IONP(320 µg/mL)处理24和48 h后形态学观察示例
2.2 氧化铁纳米颗粒对A549细胞增殖的影响
A549细胞经不同受试物处理后,通过染色细胞核来分析其细胞周期,结果发现两者均可降低处于S期的细胞比率(表1)。与对照组比较,320 μg/mL Amine-IONP处理后S期细胞比率显著降低(P<0.01),而PEGIONP 自20 μg/mL起即明显减少S期细胞比率(P<0.01),且均有浓度相关趋势。提示纳米氧化铁颗粒均可诱导G0/G1期细胞周期阻滞,且PEG-IONP可在较低浓度产生细胞阻滞效应。进一步对与细胞增殖相关的蛋白表达水平进行分析发现,PEG-IONP处理细胞24 h后可诱导p21与p53表达水平显著升高(图3,P<0.05)。
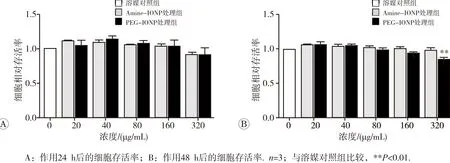
图2 A549细胞与不同浓度Amine-IONP和PEG-IONP分别作用后的细胞存活率变化
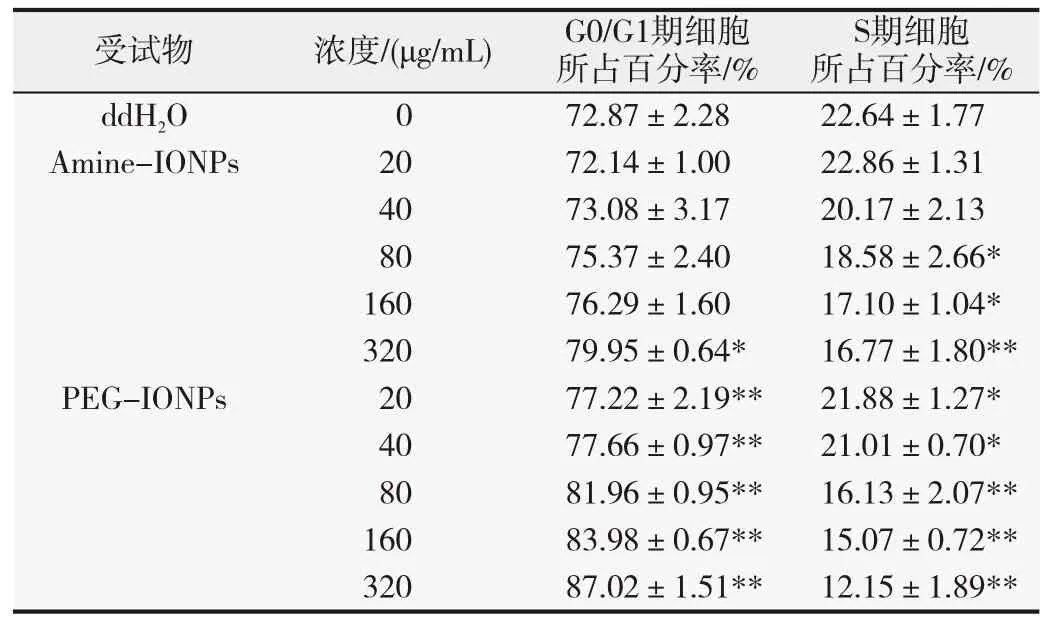
表1 Amine-IONP和PEG-IONP对A549细胞周期的影响(n=3)
2.3 氧化铁纳米颗粒潜在的氧化应激损伤评价
荧光探针标定结合高内涵检测结果提示,Amine-IONP作用24 h后即可诱导A549细胞ROS的过量生成,且存在浓度效应关系;而PEG-IONP在处理48 h后才诱导细胞ROS水平显著升高(图4)。给药48 h后,Amine-IONP和PEG-IONP诱导ROS水平显著升高的起始浓度分别为20和40 μg/mL。此外,分别检测不同细胞线粒体膜电位和内质网应激状态的变化,发现氧化铁纳米颗粒可对细胞亚结构线粒体、内质网等细胞器造成损伤(图5和图6)。Amine-IONP诱导MMP和ER损伤水平显著性改变的起始浓度均低于PEG-IONP,而相同浓度作用条件下,前者诱导的损伤更为显著。提示相同浓度作用下,Amine-IONP更易于诱导细胞内氧化应激 效应。
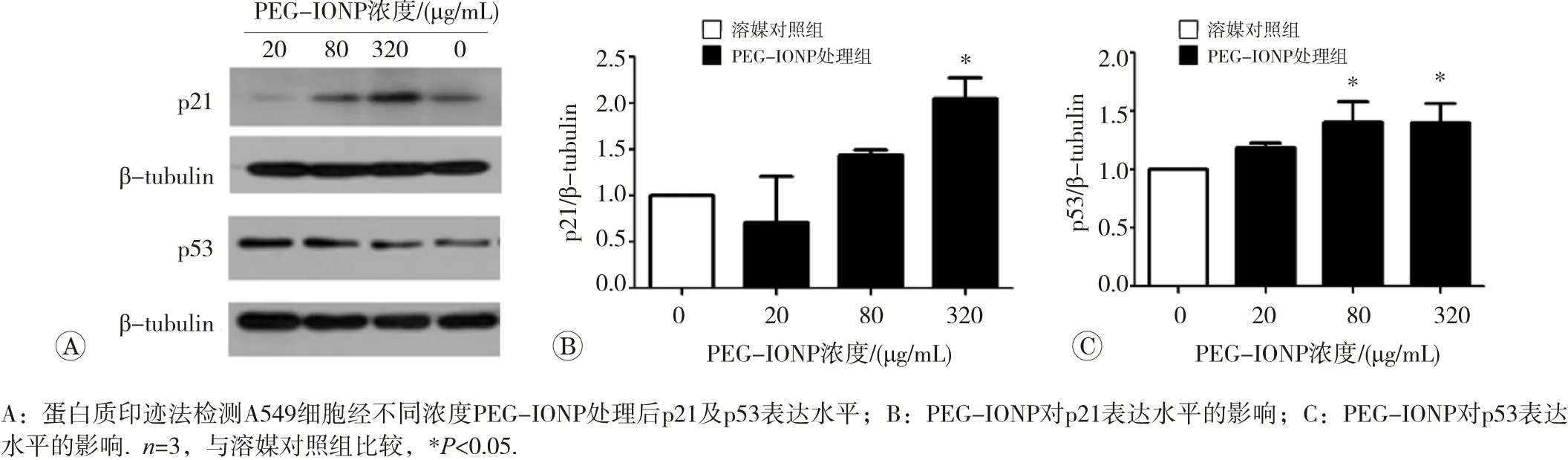
图3 PEG-IONP对A549细胞p21和p53蛋白表达水平的影响
2.4 氧化铁纳米颗粒致DNA断裂作用
碱性彗星电泳试验通常用于评价受试物潜在的细胞毒性和致DNA断裂性。不同浓度的两种氧化铁纳米颗粒与细胞分别作用48 h后,均可诱导A549细胞的尾部DNA百分率显著性升高(P<0.01)(图7A、B)。在染色体损伤层面,给予纳米氧化铁颗粒48 h后也可诱导A549细胞微核率显著升高(图7C)。相同浓度条件下Amine-IONP 诱导的尾部DNA百分率和微核率均高于PEG-IONP。核质桥发生率整体背景值较低,且仅PEG-IONP在160 μg/mL 以上浓度可显著诱导核质桥发生率的升高,而Amine-IONP则对核质桥发生率无影响(图7D)。
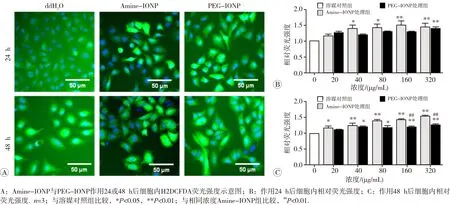
图4 Amine-IONP和PEG-IONP作用24或48 h后对A549细胞ROS相对水平的影响
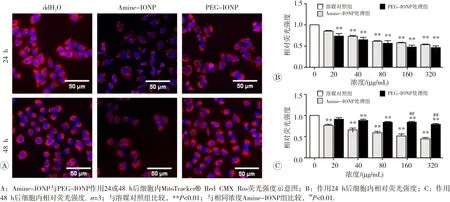
图5 Amine-IONP和PEG-IONP作用24或48 h后对A549细胞MMP相对水平的影响
为进一步确证氧化应激作用在IONPs诱导的遗传物质损伤中扮演的角色,分别使用自由基清除剂对细胞进行预处理后再将细胞与Amine-IONP和PEG-IONP作用48 h。细胞经NAC(1 mmol/L)或BHA(100 μmol/L)预处理后均可显著抑制Amine-IONP和PEG-IONP所诱导的ROS水平、尾部DNA百分率和微核百分率的升高(见图8)。
3 讨 论
IONP是常见的生物医用纳米材料,已有相关产品(如Ferumoxil和Ferumoxide)在临床用于临床医学造影诊断[2-3]。与其他含金属粒子的纳米材料比较,IONP的毒性较低但具有多种表面修饰,有助于我们研究纳米颗粒表面修饰对其毒性的影响。本研究从细胞存活率、细胞周期、氧化应激和DNA断裂等多角度,对粒径接近而表面修饰不同的两种IONPs (Fe3O4NP)的潜在细胞毒性进行了比较。Amine-IONP更易于诱导氧化应激损伤,细胞内自由基蓄积是两种IONPs造成DNA损伤的主要原因;而PEG-IONP除氧化应激损伤外,与Amine-IONP相比较更易于抑制细胞增殖,PEG诱导的DNA损伤较弱可能与其细胞周期阻滞作用有关。
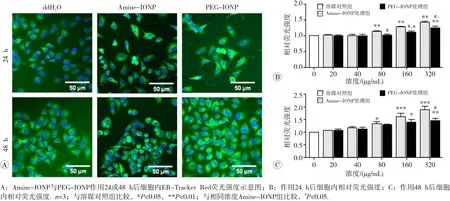
图6 Amine-IONP和PEG-IONP作用24或48 h后对A549细胞ER相对水平的影响
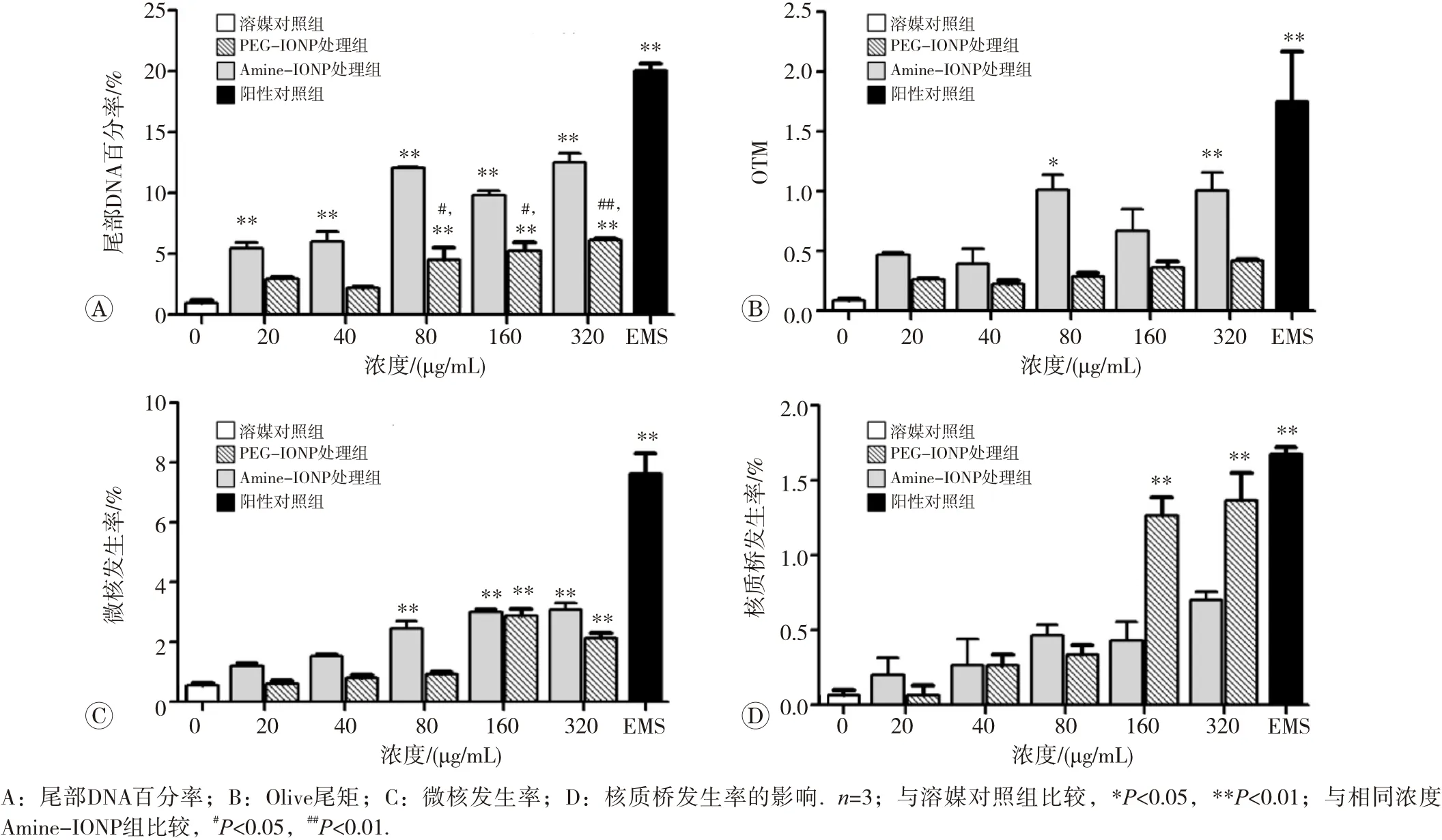
图7 Amine-IONP和PEG-IONP处理后A549细胞的彗星试验和微核试验结果
金属纳米颗粒在应用于生物医药领域前,通常需要通过不同分子对其进行表面修饰从而增强其稳定性与生物相容性。常用的纳米氧化铁颗粒表面修饰材料包括聚乙烯-乙酸乙烯酯[poly(ethylene-co-vinyl acetate)]、聚乙烯吡咯烷酮[poly(vinylpyrrolidone),PVP]、聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]、PEG等[11]。然而不同表面修饰可对其毒性产生一定影响,如IONP (Fe3O4NP)经PLGA包被后,与未经包被的颗粒对比,其DsRed-Rab7细胞摄取量有所下降且对细胞亚结构的损伤程度显著减轻,该结果也在NIH小鼠重复给药试验中得到验证[12]。Malvindi等[13]发现含有二氧化硅外壳的IONP对A549和HeLa细胞的氧化应激作用和细胞亚结构损伤均明显减轻。某些表面修饰可通过减毒有助于其生物应用。如表面经亚硝酸钠硝基化的IONP与人外周血淋巴细胞在体外条件下作用24 h后彗星试验结果为阴性,提示其可作为释放一氧化氮的纳米携带者在体内发挥抗炎功效[14]。而某些表面修饰则可增加纳米颗粒的毒性,如与无包被的IONP(Fe3O4NP)相比,油酸钠(sodium oleate)包被的IONP(Fe3O4NP)对Balb/3T3和COS-1的细胞毒性较大[15]。本研究对比了两种不同表面修饰且携带不同电荷的IONPs,结果显示Amine-IONP和PEG-IONP均可引起A549细胞总ROS水平升高以及线粒体和内质网损伤,且Amine-IONP诱导氧化应激效应的能力要强于PEGIONP。携带正电荷的颗粒可能更易于被表面带负电荷的细胞摄取,考虑带正电荷的Amine-IONP表现出的更为显著的氧化应激作用和DNA断裂效应可能与其细胞摄取水平较高有关[16]。
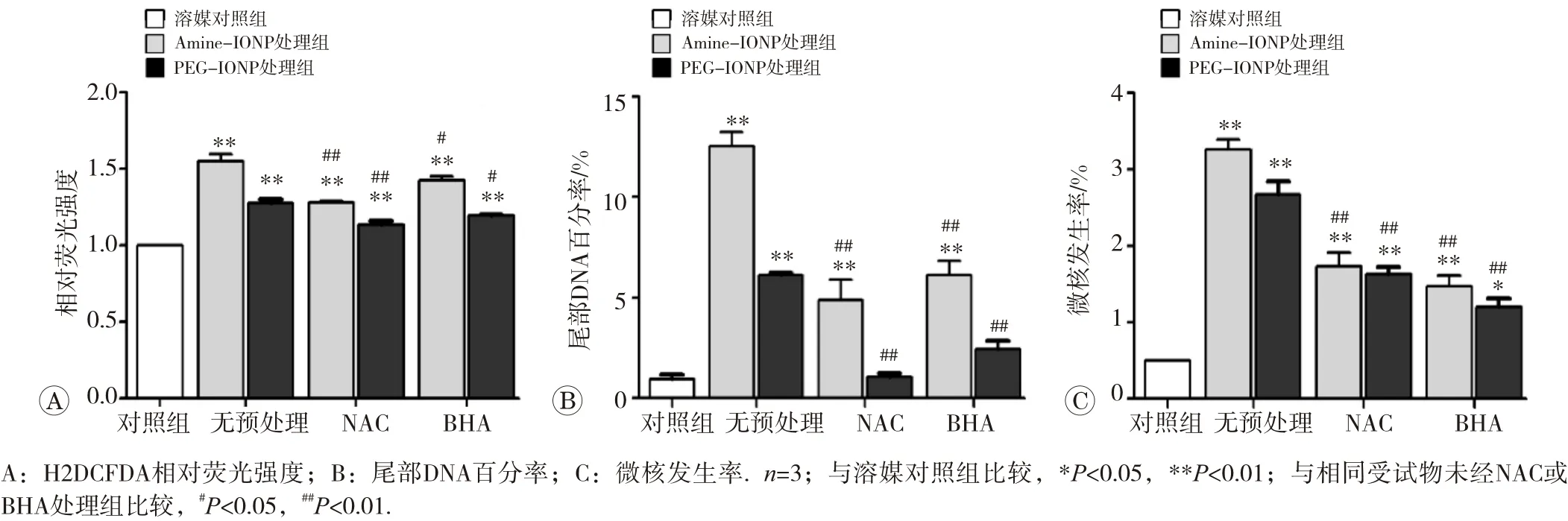
图8 NAC和BHA预处理对IONPs诱导的ROS水平、彗星拖尾和微核率的影响
大量研究提示IONP可诱导氧化损伤和DNA损伤,前者是后者的主要作用机制之一,也是IONP在人体杀伤肿瘤细胞和毒性作用的主要机制[17]。粒径约30~35 nm的IONPs(Fe2O3NP)可诱导大鼠外周血抗氧化酶出现显著抑制[18];粒径约5 nm的IONP可诱导小鼠心肌氧化应激生物标志物如ROS、脂质过氧化(LPO)和超氧化物歧化酶等水平显著升高,并造成心肌组织DNA损伤(彗星试验结果阳性)[19]。在体外研究中,10 μg/mL IONP(Fe2O3NP,<50 nm)即可诱导人乳腺癌细胞(MCF-7)的ROS、GSH、LPO、超氧化物歧化酶等指标和尾部DNA百分率显著性升高[20]。 Könczöl等[6]研究提示粒径约20~60 nm的IONP与A549细胞接触24 h后可通过内吞作用进入细胞,电镜下每个细胞含有约几十至几百个颗粒,在约1/100的细胞中可见颗粒位于细胞核。该IONP 可诱导微核率和尾部DNA百分率升高,但在自由基清除剂存在的情况下遗传毒性严重程度可显著性降低。此外,IONP(Fe3O4NP)也通过氧化应激作用诱导线粒体、内质网和溶酶体等细胞亚结构损伤[21]。上述文献结果与课题组前期研究[8]和本研究中发现的IONP诱导的氧化应激效应和遗传物质损伤结果基本相符。
纳米材料普遍可对细胞增殖产生抑制作用。如纳米银可诱导叙利亚仓鼠胚胎细胞发生G0/G1期细胞周期阻滞[22],而IONP可通过影响细胞周期素依赖性激酶和细胞周期调节蛋白的表达水平而诱导人间充质干细胞G0/G1期的细胞比例下调[23]。此外,纳米材料还可破坏人神经细胞的细胞骨架的稳定性,从而干预神经形成稳定性来干预有丝分裂的正常进行[24]。本研究中观察到PEG-IONP在较低浓度条件下(20 μg/mL)就可产生G0/G1期细胞周期阻滞效应,且与相同浓度的Amine-IONP相比抑制效应更为显著,并可诱导与细胞增殖有关的蛋白质p21和p53的表达量上调。PEG-IONP对A549细胞周期抑制作用是其最主要的毒性表现,与其诱导的NBP百分率升高有关。NBP百分率的显著性升高提示PEG-IONP可能通过抑制细胞周期进一步干预了处于G0/G1期的细胞中染色体附着于着丝粒的过程,从而形成细胞核分离不完全的双核细胞结构。上述结果可通过识别着丝粒的荧光原位杂交(fluorescence in situ hybridization,FISH)法微核试验进一步验证[25]。
综上所述,纳米颗粒的表面修饰、表面电荷分布等特性可使其细胞/组织摄取机制、毒性机制及毒性表现存在一定差异。就IONP而言,PEG表面修饰产生的细胞毒性和遗传毒性较低,但PEG-IONP作为异物进入细胞后更易于干扰细胞增殖,作为肿瘤诊断试剂具有一定优势。本研究结果为设计合理的纳米材料表面修饰结构,提高生物医用纳米材料的疗效及减毒,进而推动纳米材料产业发展提供了数据支持。
