HPV联合MNNG对Het-1A细胞恶性转化的影响
2018-12-07郑雨虹浦跃朴尹立红
马 月,郑雨虹,赵 超,刘 冉,浦跃朴,尹立红*
(东南大学公共卫生学院环境医学工程教育部重点实验室,江苏 南京 210009)
食管癌的发生发展是一个多因素作用、多基因参与、多阶段发展的复杂性过程[1-2]。1982年Syrjänen在食管癌组织中观察到类似人乳头状瘤病毒(human papilloma virus,HPV)感染的特征性改变,首次提出了食管癌可能与HPV感染有关的可能性[3]。在认识其复杂病因的过程中,越来越多证据表明HPV感染与食管癌的发生发展相关,但是HPV在细胞转化的过程中发挥着诱导细胞永生化的作用,作为独立因素致癌的证据不足,HPV更有可能在食管癌发生发展的过程中发挥着协同和促进作用。环境流行病学研究表明亚硝胺类化合物能够导致人胃癌、食管癌等多种肿瘤发生,N-甲 基 -N´-硝 基 -N-亚 硝 基 胍 (N-methyl-N´-nitro-N-nitrosoguanidine,MNNG)是一种N-亚硝基化合物,动物实验表明其可诱发胃癌、食管癌、结直肠癌等。本课题组前期研究结果显示,淮安食管癌高发区食管癌的发生与HPV感染具有一定关联,而高发区饮用水检测中也发现亚硝胺类物质暴露水平较高。因此,本研究通过慢病毒转染使正常人食管上皮细胞Het-1A稳定表达高危型HPV-18,联合MNNG染毒构建细胞恶性转化模型,探讨HPV对细胞恶性转化过程的影响。
1 材料与方法
1.1 实验材料
人正常食管上皮细胞Het-1A,由东南大学环境医学工程教育部重点实验室提供。课题组前期完成慢病毒介导HPV全长基因转染,通过嘌呤霉素筛选得到阳性克隆,扩增培养后,用荧光定量PCR检测HPV DNA的表达,获取稳定携带HPV基因组DNA的Het-1A细胞。主要试剂包括:胎牛血清(Genial),RPMI-1640(南京源之信生物技术有限公司),胰蛋白酶和青-链霉素混合液(南京生兴生物技术有限公司),CCK-8细胞活力检测试剂盒(上海七海复泰生物科技有限公司),细胞周期检测试剂盒(江苏凯基生物技术股份有限公司),BD Matrigel基质胶(Corning)。
1.2 方法
1.2.1 细胞培养 培养基采用PRIM-1640(含10%胎牛血清),MNNG染毒剂量2 μmol/L。细胞分组如下:对照组,转染空载体病毒的Het-1A细胞,常规培养;HPV-18单独处理组(HPV),HPV-18-Het-1A稳定转染株细胞,常规培养;MNNG单独处理组(MNNG),转染空载体病毒的Het-1A细胞用2 μmol/L MNNG染毒,每代1次,染毒24 h;MNNG与HPV联合处理组(HPV+MNNG),HPV-18-Het-1A稳定转染株细胞用2 μmol/L MNNG染毒,每代1次,染毒24 h。
1.2.2 细胞形态观察 观察细胞在持续慢性染毒过程中4组细胞的形态变化,对比染毒初期(第10代)及末期35代细胞形态,并拍照保存。
1.2.3 CCK-8检测细胞增殖 选取第10代、20代及35代细胞,各组细胞胰酶消化离心,收集对数生长期细胞,以每孔1万个细胞接种于96孔板,每组设5个平行孔,24 h后按照CCK-8试剂盒说明书每100 μL完全培养基加10 μL CCK-8试剂,于CO2体积分数为5%、37 ℃培养箱中作用2 h后,用酶标仪测定吸光度D(450)值。以对照组为基础,计算实验组细胞增殖率。
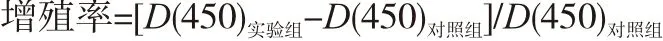
1.2.4 细胞周期检测 各组细胞胰酶消化离心收集后吹打成单细胞悬液加70%乙醇1 mL,4 ℃固定过夜,加200 μL RNase A于37 ℃孵育30 min以去除RNA,上机前加入500 μL PI染色液混匀后,4 ℃避光染色30 min,采用流式细胞仪检测。用增殖指数[(S+G2)/(G1+S+G2)×100%]表示细胞的增殖状况。
1.2.5 Annexin V-APC/PI双染法检测细胞凋亡 用不含EDTA胰酶消化4组细胞,各收集3×105个细胞,PBS 洗涤。300 μL结合缓冲液重悬细胞后,分别加入3 μL Annexin V-APC和3 μL PI标记,室温避光反应,1 h内上流式细胞仪检测。
1.2.6 检测细胞侵袭能力 将基质胶溶解到RPMI-1640 培养基后均匀平铺transwell小室置4 ℃冰箱过夜。将各组细胞制成单细胞悬液,按每孔5×105接种于小室上层,小室下层中加入含20% FBS的培养基,37 ℃、CO2体积分数为5%的细胞培养箱孵育27 h 后清洗小室,甲醇固定,结晶紫染色,洗净晾干,镜下拍照计数。
1.2.7 检测细胞迁移能力 将各组细胞制成单细胞悬液,按每孔2×105个细胞接种于Transwell上层小室,小室下层中加入含20% FBS的培养基,37 ℃、CO2体积分数为5%的细胞培养箱中孵育27 h,清洗小室,甲醇固定,结晶紫染色,洗净晾干,镜下拍照计数。
1.2.8 软琼脂集落形成试验 1.4%低熔点琼脂糖与2×培养基以1∶1的体积等比例混合,制备下层胶置于4 ℃待凝。取4组细胞,胰酶消化离心,接种细胞密度为100/cm2。0.7%低熔点琼脂糖与2×培养基以1∶1的体积等比例混合,制备上层琼脂。1 mL上层琼脂和细胞悬液充分混匀,加入10 cm皿中。37 ℃、CO2体积分数为5%的细胞培养箱中培养3周。倒置显微镜下观察集落的大小,并拍照保存。按下式计算集落形成率,实验重复3次。
集落形成率=集落数/接种细胞数×100%
1.2.9 裸鼠成瘤试验 选取4~6周龄裸鼠20只,随机分成4组,每组5只。结合细胞功能实验结果及恶性转化相关指标,将第35代的4组细胞消化后重悬成单细胞悬液,调整浓度为5×107/mL,取0.2 mL接种在裸鼠右侧腋下。观察裸鼠的成瘤情况,并用游标卡尺进行测量,记录长径和短径,按公式(体积=1/2长径×短径2)计算肿瘤体积。最后对肿瘤组织进行病理学检查。
1.3 统计学分析
应用SPSS 19.0软件对结果进行统计分析。采用方差分析进行比较,检验水准α=0.05。
2 结 果
2.1 细胞形态
随着染毒代数的增加,HPV+MNNG组和MNNG组细胞形态变化明显,由原来体积较小的圆形铺路石样紧密贴合的生长情况转变为体积增大,出现伪足、拉丝的不规则松散状态,出现了类间质性转化样改变。与HPV组和对照组有明显差异。细胞形态改变如图1所示。各组细胞不同代的改变说明MNNG暴露促进了细胞形态的改变,HPV+MNNG联合作用组与MNNG单独作用组有相同的变化趋势,且形态改变更明显。
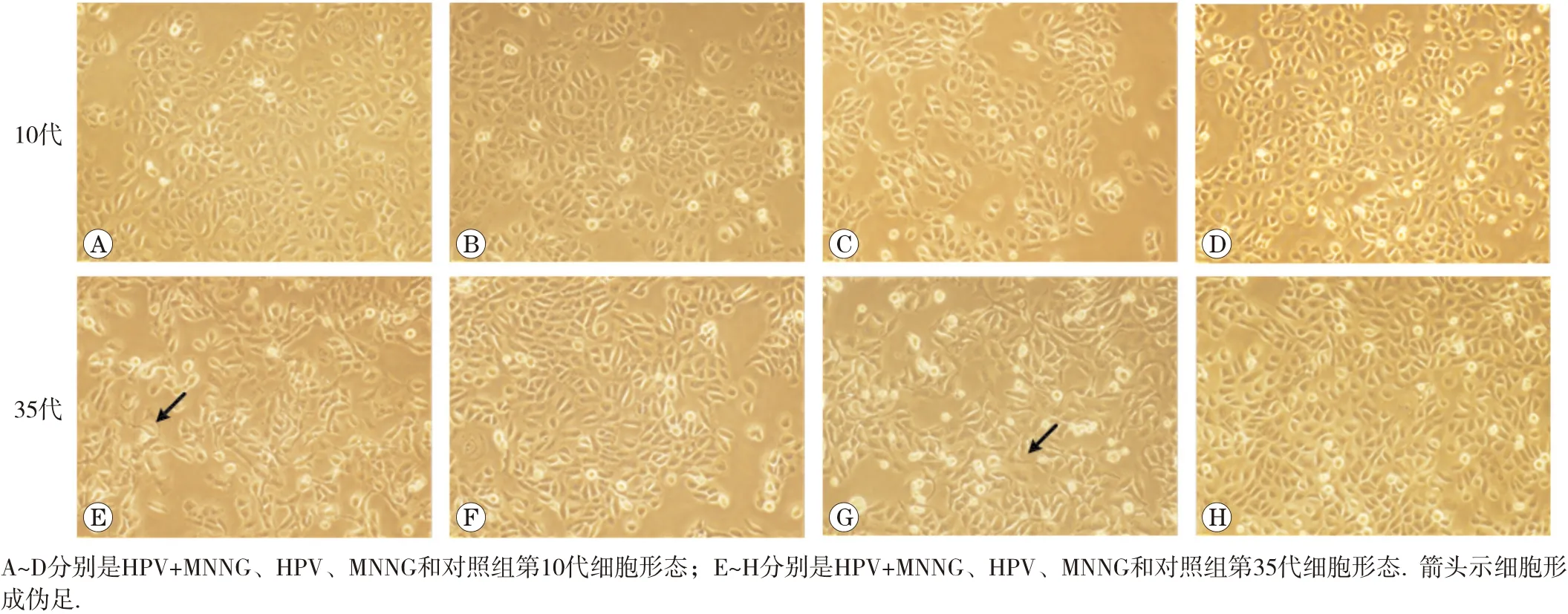
图1 各组细胞形态变化(×100)
2.2 CCK-8法检测细胞增殖活力
第10代,染毒初期MNNG单独染毒组、HPV转染组及HPV+MNNG联合作用组细胞增殖率较对照组均升高(P<0.05);第20代联合作用组、单独MNNG染毒组和HPV转染组增殖抑制率分别为(31.21±2.00)%、(20.10±2.14)%、(22.63±2.17)%,增殖活力较对照组(0)均降低(P<0.05);随着染毒代数的增加,第35代MNNG单独染毒组、HPV组及HPV+MNNG联合作用组细胞增殖率较对照组(0)明显增强(P<0.05),且联合作用组细胞增殖率[(23.32±2.76)%]高于MNNG染毒组[(12.88±1.93)%] (P<0.05)。MNNG作用下细胞的增殖活力经历了先升高后下降再升高的过程,在染毒第20和35代时HPV+ MNNG组在MNNG的毒性作用下增殖率改变较MNNG组更明显,说明在HPV的作用下,细胞对毒物的敏感程度提高,且在染毒35代时,联合组保持4组最高水平,提示HPV+MNNG联合作用下促进了细胞的增殖活力,如图2所示。
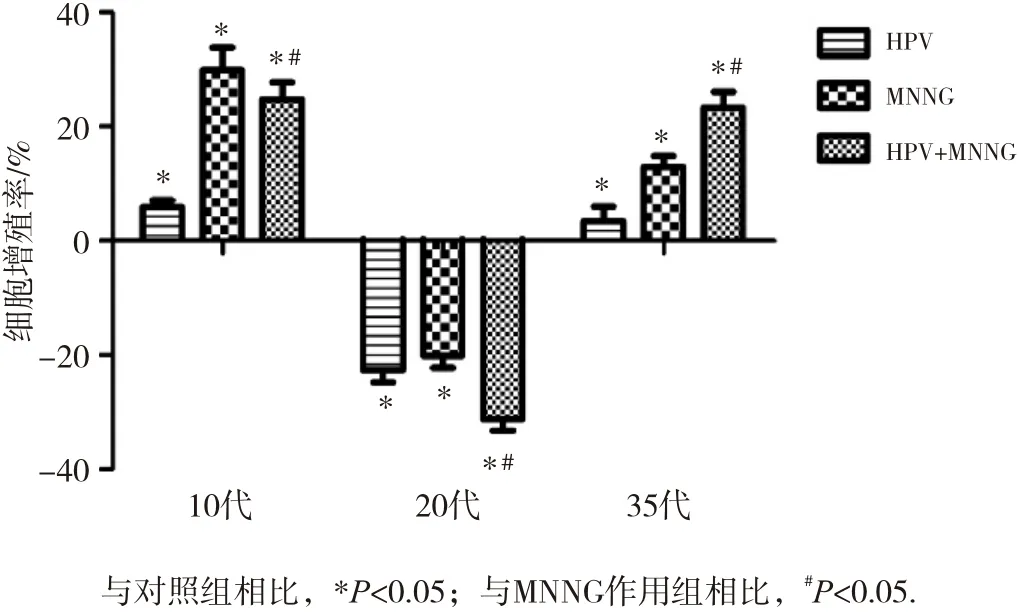
图2 不同代数各组细胞增殖率
2.3 流式细胞术检测细胞周期
各代细胞周期分布如图3所示。染毒初期(第10代),细胞受到毒作用刺激处于应激阶段,HPV+MNNG组与MNNG组较对照组S期和G2期均增加(P<0.05),且增殖指数HPV+MNNG组[(64.44±0.27)%]明显高于MNNG组[(61.35±0.03)%](P<0.05)。随着毒作用的累积,到染毒第20代,染毒组细胞周期发生了阻滞,HPV+MNNG和MNNG组细胞周期分别阻滞在G2期和S期,联合作用组增殖指数最低[(62.58±0.17)%],显著低于其他各组(P<0.05)。至染毒第35代,染毒组随着细胞自我修复的进行,细胞周期分布发生了变化,4组细胞增殖指数由高到低依次是HPV+MNNG组[(69.19±0.02)%]、MNNG组 [(64.92±0.05)%]、 HPV组 [(58.54±0.06) %]和对照组[(60.48±0.05)%],联合作用组与对照组相比,G1期降低(P<0.05),S期与G2期均增高(P<0.05),说明此阶段,HPV+MNNG联合作用及MNNG单独作用均对细胞的增殖起促进作用,且联合作用下细胞的增殖活性最强。此结果提示,HPV可能通过对细胞的周期调控,促进DNA的合成及有丝分裂,促进细胞的增殖,从而促进恶性转化的发生与发展。
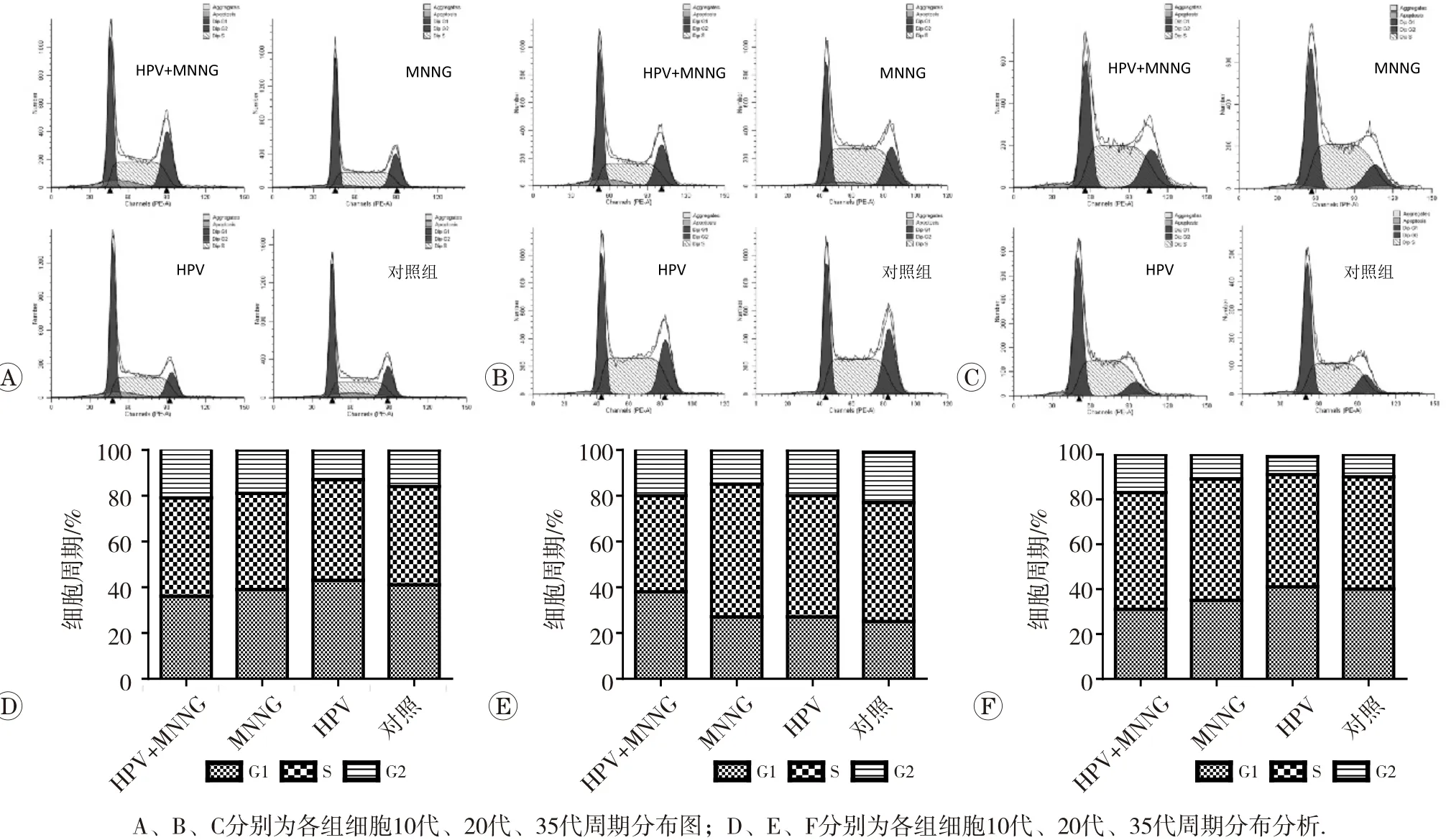
图3 不同代各组细胞周期分布
2.4 细胞凋亡
MNNG和HPV作用于正常上皮细胞后,细胞凋亡率随着染毒的代数增加发生了明显变化。染毒初期(第10代),MNNG组总凋亡率高于其他各组(P<0.05),如表1所示。随着毒作用累积,第20代HPV+MNNG、MNNG组凋亡率均高于HPV和对照组(P<0.05),如表2所示。染毒至第35代,HPV+MNNG组、HPV组早期凋亡率高于对照组,差异有统计学意义(P<0.05)。4组的总凋亡率由高到低依次为MNNG、HPV+MNNG、HPV和对照组,如表3所示。MNNG组的总凋亡率高于HPV+MNNG组(P<0.05),并且高于HPV组与对照组(P<0.05),说明MNNG+HPV联合作用下,相比于MNNG单独作用的细胞凋亡减少。结果表明,HPV作为生物因素对细胞产生的影响是个复杂的过程,在细胞的恶性转化过程中可能存在不同于单一化学物质的调控途径,HPV与MNNG的联合减少了MNNG单独作用下细胞的凋亡率,同时也说明HPV促进了细胞的增殖,在某种程度上加速了恶性转化的进程。
表1 第10代各组细胞凋亡率(%,
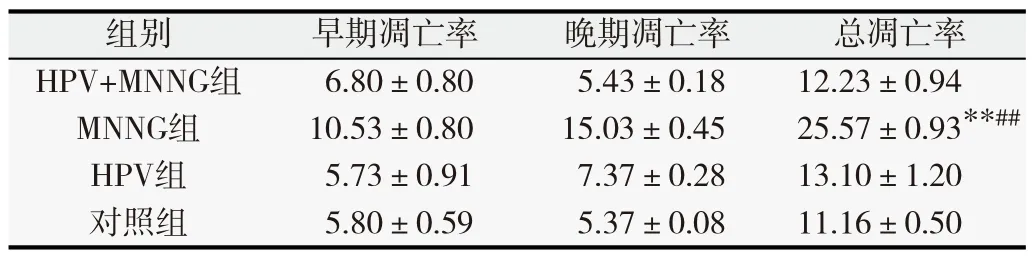
表1 第10代各组细胞凋亡率(%,
与对照组相比,**P<0.01;与联合作用组比较,# #P<0.01.
总凋亡率12.23±0.94**25.57±0.93##13.10±1.2011.16±0.50
表2 第20代各组细胞凋亡率(%,
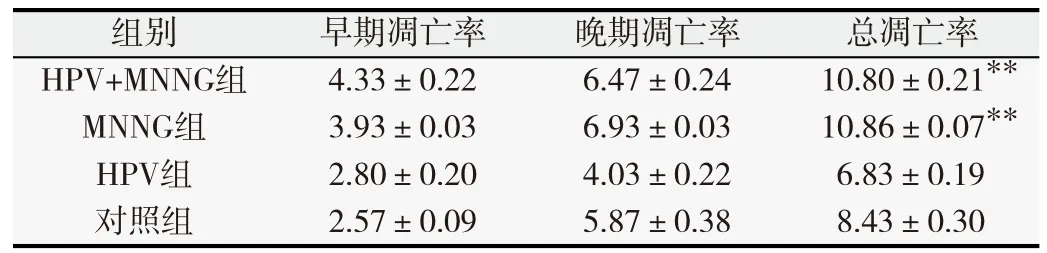
表2 第20代各组细胞凋亡率(%,
与对照组比较,*P<0.05,**P<0.01.
总凋亡率**10.80±0.21**10.86±0.076.83±0.19对照组2.57±0.09 5.87±0.38 8.43±0.30
2.5 细胞侵袭与迁移
细胞的侵袭迁移能力是反映细胞恶性转化的重要指标。染毒初期(第10代),4组细胞侵袭试验穿膜数均较少,染毒至第20代,穿膜数均增多,但组间差异均不明显(P>0.05)。如图4和图5所示。细胞染毒至35代,侵袭结果显示,HPV+MNNG联合作用组穿膜细胞数(353.4±0.2)明显高于MNNG组(220.7±0.0)(P<0.01), 而MNNG组与HPV作用组(220.2±0.2)差异不大(P> 0.05),对照组穿膜数最少(162.4±0.7)。细胞迁移试验显示,4组细胞穿膜数均有显著性差异,细胞迁移能力由强到弱依次是HPV+MNNG、HPV、MNNG和对照组(各组细胞穿膜数依次为268.1±0.4、113.3±0.3、111.6±0.5、101.1±0.2)。联合作用组的迁移能力与MNNG组有显著性差异(P<0.01),迁移试验结果如图6和图7所示。结果显示,结合细胞侵袭迁移能力与细胞的形态改变,HPV+MNNG联合作用可能促进了上皮间质性转化,后者在肿瘤形成和侵袭转移中起着重要作用,是引发恶性肿瘤的关键因素,提示HPV在肿瘤形成的过程中可能发挥着重要的作用。
表3 第35代各组细胞凋亡率(%,
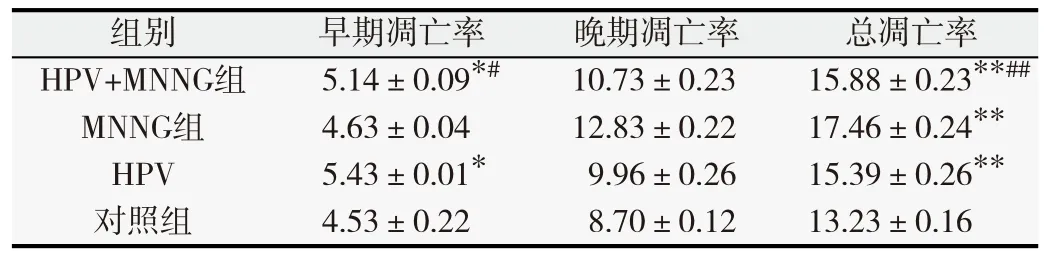
表3 第35代各组细胞凋亡率(%,
与对照组比较,*P<0.05,**P<0.01;与MNNG单独作用组比较,#P<0.05,##P<0.01.
对照组4.53±0.22 8.70±0.12 13.23±0.16
2.6 软琼脂集落形成试验
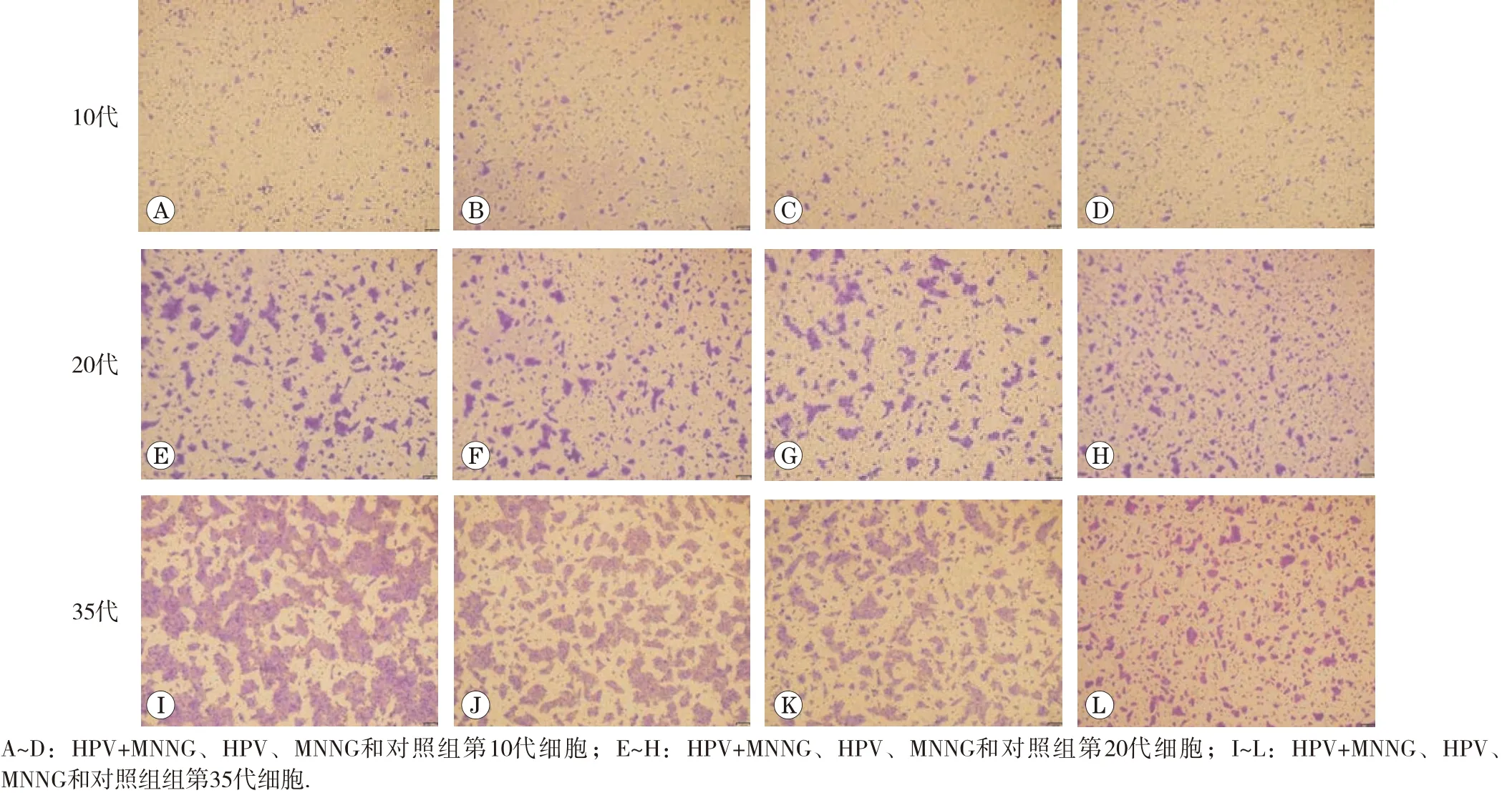
图4 各组第10、20、35代细胞侵袭试验结果(×200)
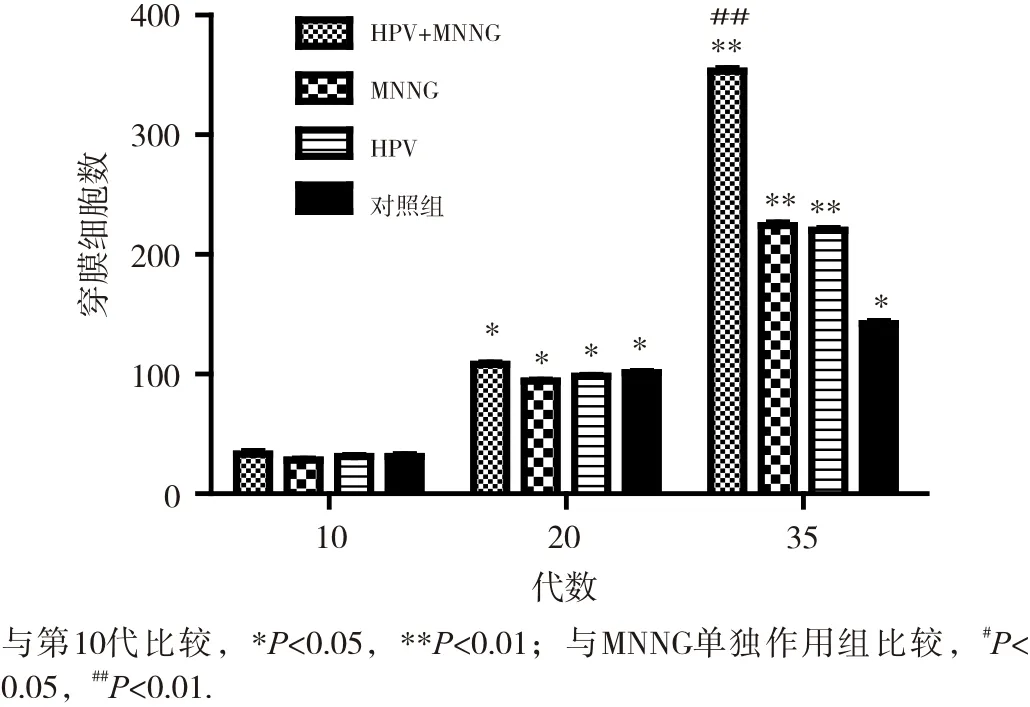
图5 不同代数的各组细胞侵袭能力变化
各组细胞在第10代及20代时无集落形成,HPV与MNNG联合作用组细胞在染毒第30代在软琼脂上可见较小集落(每个集落细胞数<50个)。至第35代,HPV+MNNG组可形成明显集落,集落形态典型,如图8所示。且HPV+MNNG、MNNG、HPV组集落形成率分别为(30.8±0.2)%、(27.1±0.3)%、(18.6±0.1)%,对照组集落形成数量较少,集落较小,且HPV+MNNG组在软琼脂的集落形成率明显高于其他各组(P<0.05),如图9。显示HPV+MNNG联合作用诱导的细胞具有非锚定独立性生长能力,具有恶性转化的表征。
2.7 裸鼠成瘤实验及病理组织学检查
图6 第35代各组细胞迁移试验结果(×200)
实验过程中裸鼠生存状态良好,未出现不良反应。将第35代各组细胞接种于裸鼠,HPV组、对照组未成瘤,HPV+MNNG组与MNNG组接种2 d后注射局部均出可触及肿物,瘤体逐渐增大,两周左右两组瘤体平均直径分别达6.6和6.9 mm,两周后各组瘤体体积不再有增大的趋势。HPV+MNNG与MNNG组成瘤率均为100%,且两组瘤体大小无显著差异(P>0.05)。瘤体血供较为丰富,切面光滑平整。瘤体HE染色均发现类似肿瘤样特征,细胞结构散乱,排列不规则,核大深染,如图10。结果提示联合作用组与MNNG单独作用组细胞发生了恶性转化,具备裸鼠体内致瘤能力。
3 讨 论
人乳头状瘤病毒(HPV)是一类嗜鳞状上皮环状DNA病毒,可引起增生性病变[4-5]、乳头瘤、鳞状细胞疣状病变[6-8]。HPV的传播与周围环境的直接或者间接接触都可能有关,如空气、土壤、食物、衣物等,除此之外人与人之间的皮肤接触等也是HPV的主要传播方式。研究已经证实,特定类型的高危型HPV 在宫颈的感染是导致宫颈癌的主要原因,此外HPV在口腔癌的发生发展中也发挥着重要作用[3]。 Zou等[9]运用PCR方法检测HPV得出高危型HPV的感染显著提高了食管癌发病风险的结论;Cao等[10]通过免疫组化和原位杂交检测食管癌组织中HPV感染情况,发现在食管癌组织中HPV感染率显著高于正常对照。有分子流行病学研究[11]发现50%~80%食管癌组织均有HPV不同亚型的感染,其中HPV-16/18型占60%左右,80%的肿瘤细胞发现有HPV DNA整合入宿主细胞DNA。越来越多的研究表明HPV感染在食管癌发生发展过程中扮演重要角色。
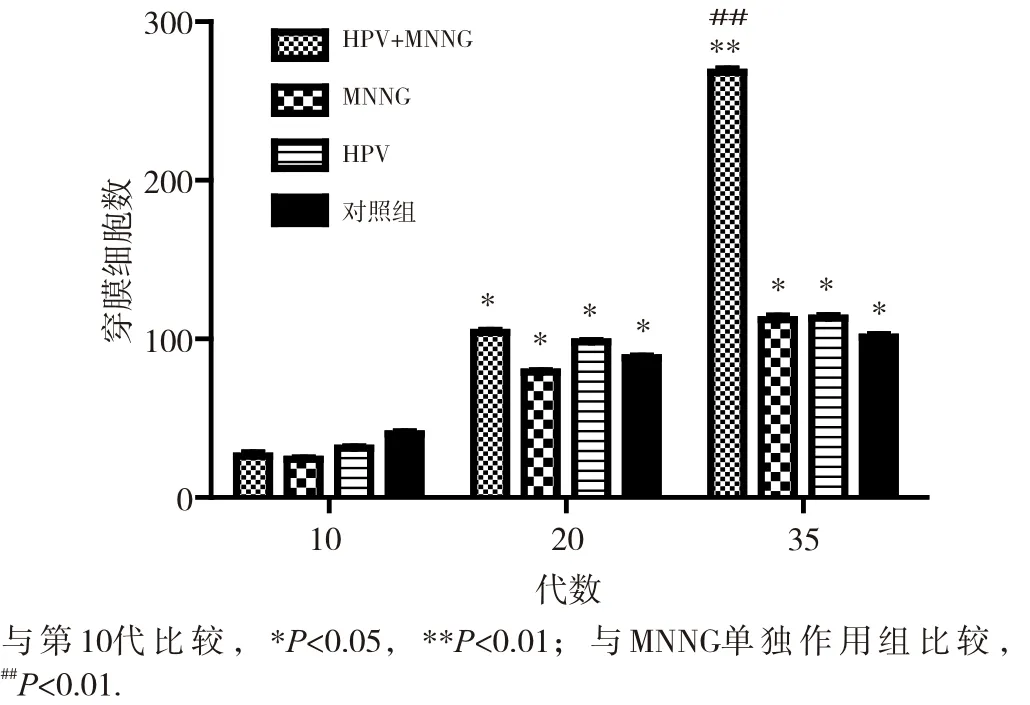
图7 不同代数各组细胞迁移能力的变化
高危型HPV E6蛋白和多种蛋白相互作用,其中p53与细胞周期凋亡等功能紧密相关,E6蛋白与抑癌蛋白p53作用可将p53蛋白通过泛素蛋白酶体途径降 解[12-13],使DNA损伤的细胞不能正常修复也不会发生凋亡,损伤累积增加最终可能导致正常细胞的恶性转化[14-15],E6蛋白还能改变端粒酶活性。端粒酶是一种使染色体稳定并能增加分裂增殖能力的一类酶,正常情况下随着分裂增加,端粒变短,细胞最终丧失分裂能力[16-18]。同样被广泛研究的E7蛋白,能与细胞周期中G1/S阶段发挥重要作用的Rb家族蛋白结合并通过泛素-26S蛋白酶体途径将其降解[19]。E7蛋白能够下调p21蛋白及p27蛋白的表达,他们均是Rb蛋白通路中对细胞周期调控发挥重要作用的蛋白,同时,p21与抑癌作用密切相关,p27同样可通过影响细胞周期使细胞过度增生,进而诱导肿瘤的发生[14-20]。除此之外,E6、E7作为主要癌蛋白与细胞的凋亡、免疫调节、细胞黏附、增殖等紧密相关。本实验中高危型HPV的稳定表达对细胞的增殖、周期等多种功能产生影响。
图8 第35代各组细胞软琼脂集落形成试验结果(×100)
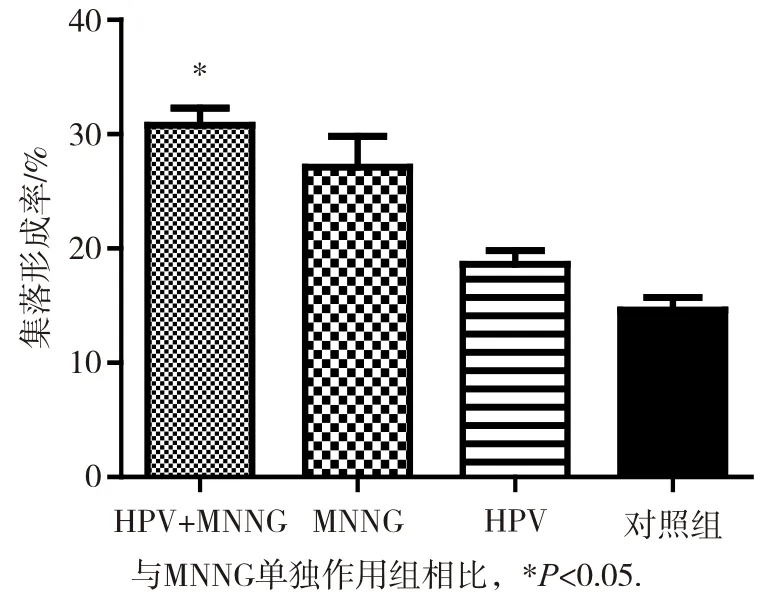
图9 第35代各组细胞集落形成率
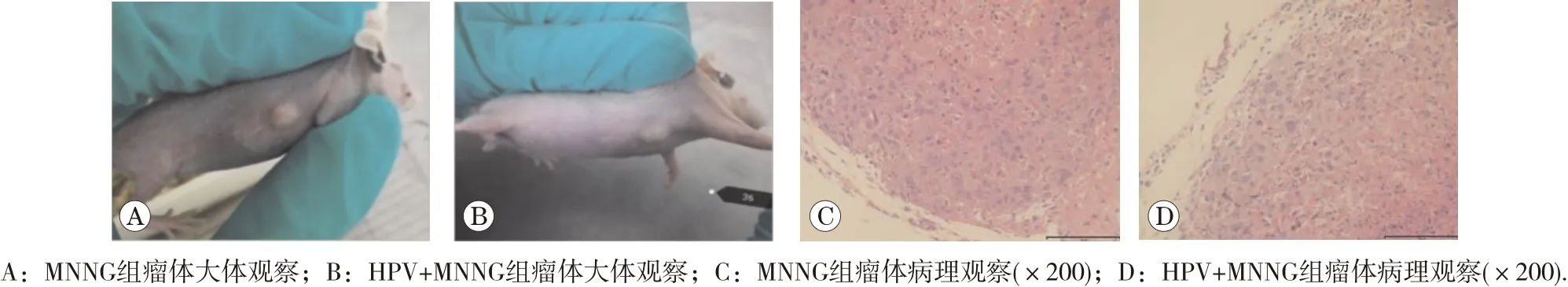
图10 裸鼠成瘤实验的大体与病理观察
本实验中食管正常上皮细胞Het-1A在慢性MNNG 染毒过程中,HPV联合MNNG发挥的作用在毒性刺激过程中比单因素作用更为敏感,二者在染毒初期增殖活性增高,可能是轻微毒作用下的应激反应。随着毒作用累积,MNNG对细胞生长出现抑制效应,HPV与MNNG联合作用组对细胞增殖周期抑制的程度高于单因素作用组。MNNG作为直接致癌物,能直接损伤DNA诱发癌变。细胞受到毒性累积作用之后引起DNA 损伤,并不断进行损伤后的自我修复,在反复损伤与修复的过程中,细胞的高分裂速度导致DNA复制的稳定性降低,一旦发生错误修复,并且固定下来会引起不可逆的改变,标志着DNA发生突变。随着DNA损伤修复的进行,实验中联合作用组细胞的增殖活力高于单独作用组,在4组中处于最高水平,MNNG单独作用组次之。随着染毒代数的增加,HPV与MNNG联合作用组的总凋亡率低于MNNG单独作用组,而HPV单独作用组总凋亡率高于空载体对照组,联合作用下,HPV在染毒过程中对细胞的凋亡发挥着一定的抑制作用,而HPV单因素处理下,促进了细胞的凋亡。相比于MNNG单独作用,HPV与MNNG联合作用使Het-1A细胞更早出现了促进增殖及抗凋亡的功能表现,HPV可能在致Het-1A细胞的恶性转化中发挥着协同与促进作用。
在肿瘤发生发展的过程中,经常伴随上皮细胞间质性转化的发生,食管癌作为具有侵袭迁移特性的恶性肿瘤,在其发生发展过程中,越来越多的研究证实EMT在其中扮演重要的角色。在肿瘤发生过程中,正常上皮细胞发生EMT,进而发生原位癌,肿瘤细胞可通过EMT形成局部扩散。研究证实,肝癌、结肠癌、宫颈癌,乳腺癌等多种肿瘤侵袭转移的过程中存在EMT的发生,其严重程度与EMT相关[12],为改善恶性肿瘤的预后,EMT在肿瘤发生发展过程中的机制研究成为热点。本实验中HPV与MNNG联合作用组、MNNG单独作用组形态随着染毒次数的增加发生明显变化,细胞失去规则的形状,变细变长,出现伪足,有类似上皮间质转化的表征。此外,细胞的侵袭迁移试验结果显示,HPV与MNNG联合作用的穿膜细胞数均明显高于MNNG单独作用组,染毒组细胞穿膜数明显高于对照组。HPV与MNNG联合作用具备更强的侵袭和迁移能力,提示HPV在这个过程中可能促进了上皮间质性转化,从而促进恶性转化的进程,同时为后续研究提供了思路。
HPV与MNNG联合作用和MNNG单独作用相比,虽然裸鼠成瘤试验中瘤体大小及生长速度差异不大,但是在恶性转化的过程当中,联合作用组的软琼脂非锚定独立生长能力明显高于MNNG单独作用组。联合作用组在染毒30代时就已经可以形成较小集落,而MNNG单独作用组并无集落形成;染毒至35代,MNNG单独作用组可形成阳性集落,而HPV与MNNG联合作用下形成的阳性集落更多且更大,说明HPV促进了细胞的非锚定独立生长能力,使细胞更早的具备恶性表征。
综上所述,在Het-1A细胞恶性转化过程中,HPV与MNNG联合作用显示出细胞增殖能力、抗凋亡能力、侵袭迁移能力及非锚定独立生长能力均强于MNNG单独作用组的毒性作用特征,更早的具备了恶性转化的表征。HPV联合MNNG致Het-1A细胞恶性转化模型的成功构建说明,HPV在细胞恶性转化的过程中发挥着促进与协同的作用,加快了细胞恶性转化的进程。
