透骨草总生物碱对乳腺癌骨转移的抑制作用及其机制
2018-12-07胡向阳
杜 娟,胡向阳,刘 丹,胡 卫,陈 涛,*
(1. 三 峡大学医学院,湖北 宜昌 443002;2. 恩施土家族苗族自治州中心医院,湖北恩施 445000)
乳腺癌是女性最常见的恶性肿瘤,中国乳腺癌发病率增速居全球首位[1-2]。骨是乳腺癌转移最常见的部位,70%的晚期乳腺癌发生骨转移[3-5],对于大多数乳腺癌患者来说,骨转移主要是溶骨性的,可导致严重疼痛和骨折[6]。此类患者常常选择化疗,但此方法毒副作用较大,预后较差,因此亟需一种能减轻患者痛苦、提高生活质量的治疗药物。
近年来,中医药治疗乳腺癌取得了显著成效,在改善患者的生存质量、延长生存期、控制病情发展等方面发挥了重要作用[7]。补肾壮骨方剂三骨汤由补骨脂、骨碎补、透骨草按一定比例组成,已有研究证明其能控制恶性肿瘤骨转移的发生[8],其中透骨草所含生物碱成分在抗炎镇痛、抗癌等方面证实有一定的功效[9]。但其对乳腺癌骨转移的作用机制尚未见报道,本研究旨在探讨透骨草总生物碱(the total alkaloids of tougucao,TTAT)对人乳腺癌细胞所致溶骨性病变的影响,并对其相关机制进行初步探讨。
1 材料与方法
1.1 TTAT的提取与鉴定
透骨草,购于湖北天济中药饮片公司,国药准字H45871202,批号20175687-541,每袋10 g。取透骨草500 g,粉碎得全草粉末后用80%乙醇回流提取3次,蒸发浓缩成浸膏,用1%盐酸水溶液调节pH为2~3,抽滤,用氨水调节滤液pH至11~12,抽滤。得到的滤液用乙酸乙酯萃取3次,收集乙酸乙酯液,浓缩,得到透骨草总生物碱提取物。将提取物与配好的显色剂(碘化铋钾试剂或改良碘化铋钾与碘化汞钾试剂)反应,观察颜色结果[10-11]。
1.2 动物及裸鼠乳腺癌胫骨骨转移模型的建立
成年健康BALB/c-nu雌性裸鼠,购于北京维通利华实验动物技术有限公司,实验动物使用经营许可证号为SCXK(京)2012-0001。造模前1周复苏冻存在液氮中的乳腺癌MDA-MB-231细胞(来源于武汉大学中国典型培养物保藏中心),并进行培养和传代。用0.4%台盼蓝染色后,在显微镜下观察细胞活性,计数活细胞率>95%时收集细胞,用无菌PBS将细胞密度调整至1×107/mL,用10 μL微量进样器从裸鼠右后肢胫骨平台刺入,向胫骨腔内注射细胞悬液10 μL,用手轻捏进针口2 min至针口闭合。
1.3 分组给药及取材
盐酸多柔比星粉剂(doxorubicin,DOX),海正辉瑞制药有限公司(中国),国药准字H33021980,批号2017 482-4,每瓶10 mg;DOX是一种抗肿瘤抗生素,在临床上常用于乳腺癌的化疗,主要用来观察透骨草总生物碱的抗肿瘤能力是否与常规化疗药效果一致[12]。唑来膦酸注射液(zoledronic acid,ZOL),正大天晴药业集团股份有限公司(中国),国药准字H20041346,批号845125-9875,每支5 mL,含4 mg;ZOL是一种作用于骨的特异性二磷酸化合物,它能抑制因破骨细胞活性增加而导致的骨吸收,主要用来观察透骨草总生物碱抗乳腺癌骨质破坏的能力[13]。
将42只裸鼠分为正常组(不予任何处理)、模型组(仅造模,不予其他处理)、TTAT低浓度组(100 mg/kg TTAT腹腔注射)、TTAT高浓度组(500 mg/kg TTAT腹腔注射)、DOX组(5 mg/kg DOX腹腔注射)、ZOL组(0.4 mg/kg ZOL颈后皮下注射),每组7只。除正常组和模型组外,其余组造模1周成瘤后开始给药,隔日1次。给药期间,每周定期(1~2 d)观察裸鼠生存状态,并称体质量,计算肿瘤体积,用游标卡尺测量肿瘤长、短径,算出每组平均值。处死裸鼠后,剥离肿瘤组织,经电子天平称量瘤质量,计算各组平均瘤质量和平均肿瘤体积,最后计算抑瘤率。连续给药6周。采用颈椎脱臼法处死各组裸鼠,以右侧髋关节为界切除右后肢,取右后肢肿瘤组织放入-80 ℃冰箱保存待检。

1.4 影像学技术及评分标准
以右侧髋关节为界切除右后患肢,运用TUC-4653P医用X光诊断系统进行X线摄片并评分,分析标准[14]如下:0分,正常骨性结构,即无任何骨质破坏征象;1分,胫骨注射部位附近见小的骨质缺损灶(≤3个);2分,髓质骨缺损,病灶增多(>3个);3分,髓质骨缺失,同时皮质骨受侵;4分,单面骨皮质完全缺损;5分,双面骨皮质缺失,移位性骨折。由2位研究者分别计分,并计算平均值。
1.5 HE染色
胫骨标本固定后转入不同浓度的酒精进行组织脱水,再将组织块置于二甲苯中透明,常规石蜡包埋切片,切片包括骨组织及骨旁肿瘤组织。HE染色后在光镜下观察,每张切片随机选取5个视野拍照。
1.6 破骨细胞计数(TRAP染色)
胫骨标本固定约24 h后转入脱钙液(10%甲醛+EDTA过饱和溶液)脱钙8周,石蜡包埋切片,切片包括骨组织及骨旁肿瘤组织。抗酒石酸酸性磷酸酶(tartaric acid phosphatase staining,TRAP)染色后在光镜下观察,每张切片随机选取5个视野拍照,计数,取平均值表示其破骨细胞数。
1.7 Western blot检测裸鼠肿瘤组织中RANKL、OPG、p-ERK、ERK、p-JNK以及JNK的表达
取裸鼠骨转移部位肿瘤组织,加裂解液提取组织蛋白质,超声裂解得蛋白上清液并记录体积,BCA蛋白定量试剂盒进行组织蛋白定量。取30 μg蛋白样品进行SDS-聚丙烯酰氨凝胶电泳,转至硝酸纤维素(nitrocellulose filter membrane,NC)膜后用5%脱脂奶粉封闭2 h,分别加入一抗:鼠抗β-actin(武汉博士德生物工程有限公司)稀释比例为1∶500;兔多抗骨保护素(osteoprotegerin, OPG)和 兔 多 抗 核 因 子 -κB配 体(receptor activator of NF-κB ligand,RANKL)(上海艾博抗贸易有限公司),稀释比例均为1∶200;兔单抗细胞外信号调节激酶(extracelluar signal-regulated kinase,ERK)、p-ERK、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p-JNK(美国CST公司),稀释比例均为1∶400,4 ℃过夜,TBST洗膜3次。加入相应HRP标记羊抗小鼠二抗、HRP标记羊抗兔二抗(武汉博士德生物工程有限公司,稀释比例为1∶500),室温作用2 h,TBST洗膜3次。用ECL Western blot化学发光试剂盒显色检测,以β-actin为内参。
1.8 统计学方法
统计分析采用SPSS 19.0软件,计量资料采用x±s表示,组间比较采用LSD法分析,应用方差分析和t检验。α=0.05为检验水准。
2 结 果
2.1 TTAT的提取和测定结果
提取得到透骨草总生物碱3.28 g,加入碘化铋钾试剂或改良碘化铋钾均产生橘红色沉淀,加入碘化汞钾试剂产生类白色沉淀,证明提取物中含有生物碱。
2.2 TTAT对裸鼠肿瘤生物学行为的影响
2.2.1 各组裸鼠肿瘤质量及体积变化情况和抑瘤率与模型组比较,100和500 mg/kg TTAT处理组均可显著抑制肿瘤生长(P<0.05);与DOX 组比较,100 mg/kg TTAT剂量组肿瘤体积和瘤质量增加即肿瘤抑瘤率降低(P<0.05);500 mg/kg TTAT组上述指标间的差异均无统计学意义(P>0.05);与ZOL组比较,上述2个TTAT剂量组的肿瘤体积和瘤质量均下降即肿瘤抑瘤率明显增加(P<0.05),见表1。
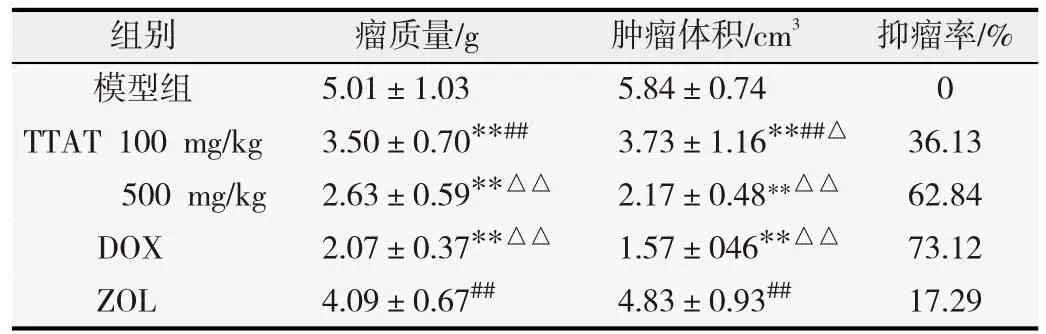
表1 各组裸鼠肿瘤质量及体积变化情况和抑瘤率对比(-x±s,n=7)
2.2.2 TTAT对乳腺癌骨转移裸鼠骨质破坏的影像学检测 影像学评分显示,与模型组比较,100和500 mg/kg TTAT均能够明显降低乳腺癌骨转移裸鼠右下肢骨质破坏情况和影像学评分(P<0.05)。与DOX组比较,TTAT 500 mg/kg组能够明显降低乳腺癌骨转移裸鼠右下肢骨质破坏况和影像学评分(P<0.05)。但100和500 mg/kg TTAT组对骨质破坏及影像学评分的影响较ZOL组弱(P<0.05),见图1和表2。
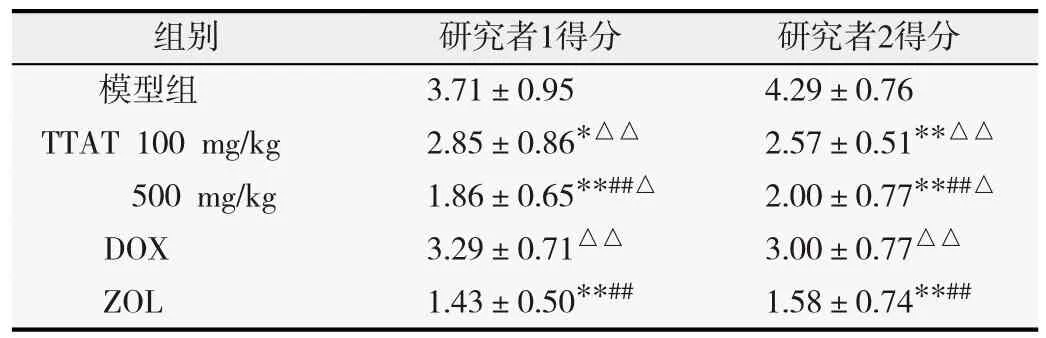
表2 各 组裸鼠影像学评分 (-x±s,n=7)

图1 TTAT对乳腺癌骨转移裸鼠骨质破坏的影像学检测
2.2.3 各组乳腺癌骨转移裸鼠右下肢HE染色 HE染色结果显示,模型组中肿瘤细胞密度高,核大深染,见病理核分裂像,异型性明显,骨质破坏明显,呈溶骨性破坏。与模型组比较,100和500 mg/kg TTAT组中肿瘤细胞弥漫分布,排列较紧密,间质增多,部分肿瘤细胞形态不规则。与DOX组比较,500 mg/kg TTAT组中肿瘤细胞与之呈相同形态,异型性减轻,体积缩小,排列较松散,间质增多,出现较多变性和坏死,但骨质破坏比DOX组明显减轻。与ZOL组比较,500 mg/kg TTAT组肿瘤细胞异型性明显降低,弥漫分布,排列较紧密,间质增多,部分肿瘤细胞形态不规则,而骨质破坏情况与之相当,均较模型组明显减轻。见图2。

图2 各组乳腺癌骨转移裸鼠右下肢HE染色
2.2.4 各组乳腺癌骨转移裸鼠右下肢TRAP染色及破骨细胞计数 TRAP染色结果显示,骨组织及骨小梁呈淡黄色,细胞核呈蓝色,破骨细胞呈酒红色,模型组可见明显的骨破坏,且破骨细胞数量明显多于其他各组(P<0.05)。与模型组比较,100和500 mg/kg TTAT组均能够降低破骨细胞的数量(P<0.05)。与DOX组比较,500 mg/kg TTAT组能明显降低破骨细胞的数量(P<0.05)。500 mg/kg TTAT组降低破骨细胞数量的能力与与ZOL组相比,差异无统计学意义(P>0.05)。如图3所示。
2.3 TTAT对OPG/RANKL/RANK信号通路的影响
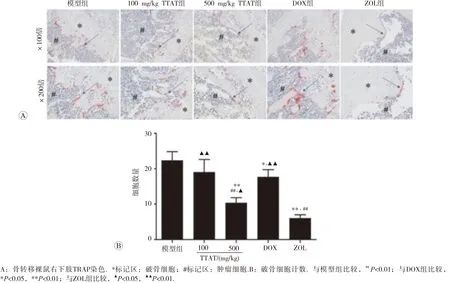
图3 各组乳腺癌骨转移裸鼠右下肢TRAP染色及破骨细胞计数
与模型组比较,100和500 mg/kg TTAT组均上调了OPG的表达,OPG/RANKL的比值升高(P<0.01)。与DOX比较,500 mg/kg TTAT组降低了RANKL的表达,OPG/RANKL的比值亦升高(P<0.05)。与ZOL比较,100和500 mg/kg组上调了RANKL的表达,OPG/RANKL的比值降低(P<0.05),如图4所示。
与模型组比较,100和500 mg/kg TTAT组均能降低ERK、JNK蛋白的磷酸化水平(P<0.05)。与DOX组比较,上述2个TTAT剂量组中p-ERK表达量的差异无统计学意义(P>0.05),500 m g/kg T TAT组中p-JNK的表达量明显降低(P<0.05)。与ZOL组比较,500 m g/kg T TAT组中p-ERK、p-JNK的表达量显著降低(P<0.05),如图5所示。
3 讨 论
正常的骨代谢依靠破骨细胞介导的骨吸收和成骨细胞介导的骨形成之间的动态平衡来维持。乳腺癌转移至骨组织,可激活破骨细胞的活性,导致骨代谢失衡,骨组织被分解,致使骨质吸收。有研究发现OPG、RANKL和RANK是调节破骨细胞和骨吸收的重要因子[15-16]。
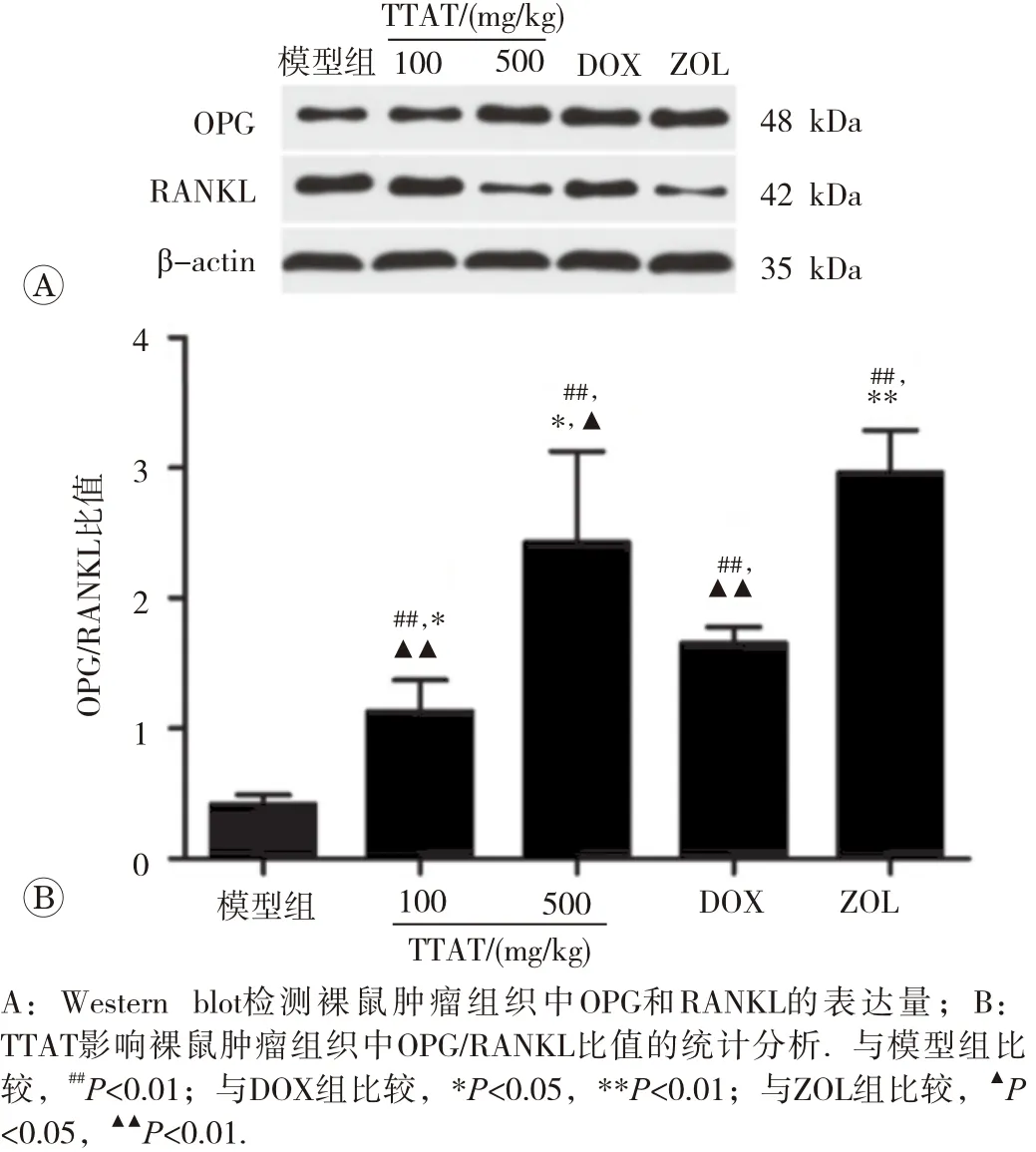
图4 TTAT对乳腺癌骨转移裸鼠OPG/RANKL比值的影响
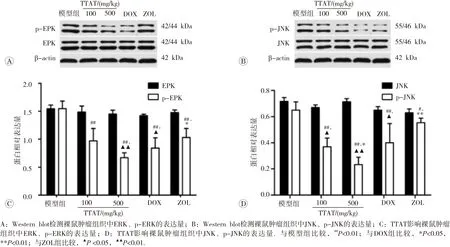
图5 TTAT对乳腺癌骨转移裸鼠肿瘤转移ERK、p-ERK、JNK和p-JNK蛋白表达的影响
RANKL能直接启动破骨细胞前体细胞或破骨细胞内信号传导过程,维持破骨细胞活性[17]。破骨细胞表面的RANK是RANKL刺激破骨细胞分化、成熟的唯一靶受体[18-19]。巨噬细胞集落刺激因子(macrophagecolony stimulating factor,M-CSF)能够促使破骨细胞与骨髓基质细胞接触,使 RANK/RANKL经细胞内信号传导途径刺激破骨细胞活化[20]。OPG是一种分泌性可溶性蛋白[21], 是RANKL诱骗受体[22],可与RANKL竞争性结合,阻断RANKL/RANK间的相互作用,使RANKL失去功能,从而抑制体内及体外破骨细胞的分化,抑制成熟破骨细胞的活性,并诱导成熟破骨细胞的凋亡,从而起到减少骨吸收的作用[23-25]。因此,在破骨细胞分化成熟过程中OPG/RANKL比值起主要的调节作用[26-27],也就是说OPG/RANKL系统在乳腺癌骨转移骨吸收和重建中起关键作用[28]。
RANKL主要由骨髓间质细胞和成骨细胞分泌,破骨细胞不分泌RANKL[29]。有研究发现RANK能够诱导RANK阳性的前列腺癌细胞发生转移,证明RANKL具有趋化因子活性[30-32]。RANKL诱导的转移与特殊的信号有关,特别是MAPKs通路(JNK和ERK)的激活,ERK和JNK是MAPK信号传导通路中经典的信号蛋白分子,MAPK是一类由脯氨酸介导的丝氨酸/苏氨酸蛋白激酶,通过Ⅷ区域苏氨酸、酪氨酸双位点磷酸化活化,激活的MAPK通过磷酸化多种转录因子、细胞骨架蛋白、其他酶类等不同底物来调节多种细胞生理过程,其中ERK主要通过Ras→Raf→MAPK/ERK激酶(MAPK/ERK kinase,MEK) 被激活,可能与生理性信号传导有关,促进细胞的增殖,有利于损伤的修复和细胞的再生,对破骨细胞的形成、生存、分化及刺激骨吸收有重要作用[33]。
本实验结果显示TTAT能显著抑制裸鼠骨肿瘤的生长,抑制破骨细胞的分化,显著抑制RANKL诱导的胞质ERK和JNK的磷酸化水平,在TTAT高浓度组这种抑制作用更加明显。结果表明OPG/RANKL/RANK信号通路在乳腺癌骨转移中起着重要作用,TTAT能够通过上调OPG/RANKL的比值进而调控其下游信号转导通路来抑制肿瘤细胞的转移和骨质的破坏,由此可见抑制OPG/RANKL/RANK信号通路的表达可能成为减少肿瘤骨转移的潜在方法之一,TTAT有望开发成为抗肿瘤转移的有效药物。
