UPLC/Q-TOF MS/MS技术评价防腐剂硼酸和叠氮化钠对尿液代谢物的影响
2018-12-07王美杰侯绍英
肖 瑶,王美杰,侯绍英*
(哈尔滨医科大学公共卫生学院营养与食品卫生学教研室,黑龙江 哈尔滨 150081)
代谢组学是研究代谢产物变化规律的一门学科,自Nicholson等[1]于1999年提出“代谢组”一词后,代谢组学在筛选疾病的生物标志物[2-3]以 及疗效评价[4]等多个方面展现出良好应用前景。代谢组学分析流程包括样品采集、样品前处理、仪器检测、数据分析等几个环节,为了得到真实可靠的实验结果,各环节都需严格设计、精确执行。其中,对样品进行适宜的前处理至关重要[5]。
尿液是代谢组学研究常用的生物样本,它具有很多优点。首先,尿液中含有丰富的代谢产物,并且大多数代谢产物能反映机体的代谢变化信息[6-7];其次,尿液是机体的排泄废物,采集方便、快捷,对生命体本身无侵袭性,并且收集的体积几乎不受限制。但尿液样本在收集过程中,常常会受细菌微生物等因素的影响,从而使其中的代谢物发生变化[8],可能导致错误的分析结果。为解决这一问题,很多学者在尿液样品中添加防腐剂,以抑制细菌生长繁殖[9],但其前提是这些防腐剂不影响尿液中的代谢物。此前曾有学者采用光学技术以及基于核磁共振波谱技术(nuclear magnetic resonance,NMR)的代谢组学技术探讨了常用防腐剂作用效果以及对代谢物的影响。但由于NMR技术的灵敏度低于超高效液相色谱-四级杆-飞行时间串联质谱(ultra-performance liquid chromatography tandem quadrupole time of flight mass spectrometry,UPLC/QTOF MS/MS),而后者在代谢组学研究中应用越来越广泛,所以基于该技术平台阐明防腐剂对尿液代谢物的影响就显得很重要。因此,我们在尿液中添加两种常用防腐剂硼酸和叠氮化钠,在基于UPLC/Q-TOF MS/MS技术的代谢组学研究中观察其对尿液代谢物的影响,筛选适宜的防腐剂及其适宜的浓度范围,以便为后续研究奠定一定的基础。
1 材料与方法
1.1 主要仪器及试剂
采用Waters超高效液相色谱-四级杆-飞行时间串联质谱联用仪进行样品检测。HSS T3色谱柱(1.8 μm,2.1×100 mm)购于Waters公司,色谱级乙腈和甲醇购于Dikma公司,色谱级甲酸购于Fisher公司,亮氨酸脑啡肽购于Sigma公司。采用Millipore公司的Milli-Q超纯水系统制备超纯水。
1.2 实验方法
1.2.1 实验分组与尿液处理 采用进口离心管收集哈尔滨医科大学6名健康志愿者的晨尿(男女各3名),各取40 mL等量混匀并分装。按处理方式不同分为3个组,即对照组、叠氮化钠组(NaN3)和硼酸组(boric acid),其中对照组不添加任何防腐剂,叠氮化钠组中分别添加终浓度为0.1、1和10 mmol/L的叠氮化钠;硼酸组则在尿液中分别添加终浓度为2、20和200 mmol/L的硼酸。
每个处理均设置4个平行样。尿样在4 ℃下以3 000 g离心5 min,吸取上清100 μL,加入1 100 μL超纯水,涡旋混匀后,再次于4 ℃以12 000 g离心10 min。轻吸上清液1 000 μL置于进样瓶中。检测时为避免误差,将各组样品随机进样。
等量吸取所有样品并混匀,制成质控样品(quality control,QC)。每隔15个样品各采集一次QC和纯乙腈(空白样品),以便进行质量控制。
1.2.2 UPLC/Q-TOF MS/MS条件 采用Waters UPLC HSS T3色谱柱进行样品的分离。柱温设置为35 ℃,自动进样室温度设置为4 ℃。流动相A液为0.1%甲酸水溶液,B液为100%乙腈。流速为0.45 mL/min,进样量为2 μL。洗脱方法如表1所示。
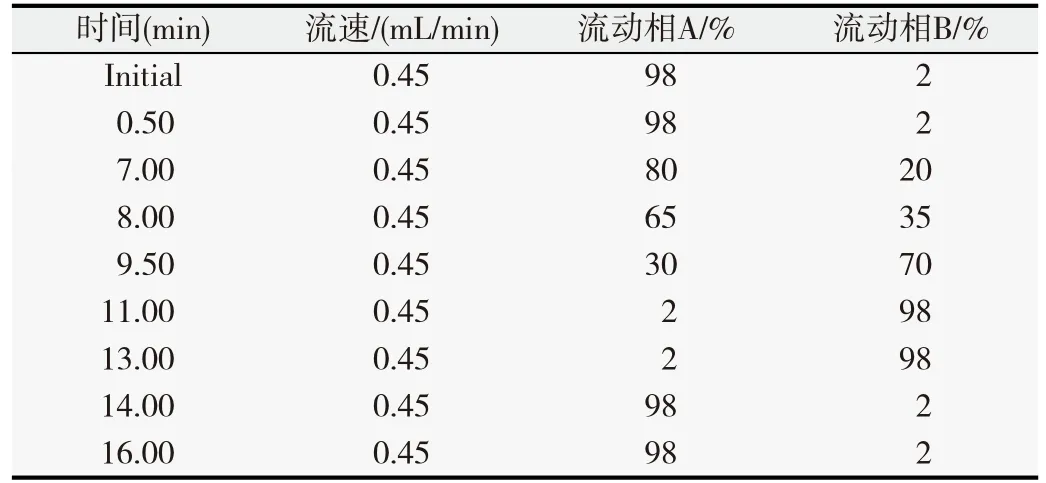
表1 UPLC梯度洗脱程序
质谱分析器由四级杆质谱和飞行时间质谱仪串联而成,采用电喷雾离子源(electrospray ion source,ESI)分别采集正、负两个离子模式下质荷比50~1 200范围的离子。质谱扫描采用MSE连续模式,采集时间为0~16 min。质谱分析参数如下:毛细管电压为0.5 kV,锥孔电压为60 V,离子源温度为110 ℃,脱溶剂气温度为450 ℃,锥孔气流为50 L/h,脱溶剂气流为900 L/h。在整个检测过程中,使用200 pg/μL的亮氨酸脑啡肽作为质谱校正离子([M+H]+=556.277 1,[M+H]-=554.261 5)进行仪器的实时校正,扫描时间为0.2 s,间隔时间为15 s。
1.3 数据处理与分析
将检测得到的数据导入Progenesis QI软件(Waters)进行峰识别、峰提取和归一化后,将数据导入SIMCAP 13.0软件(Umetrics),采用主成分分析(principal components analysis,PCA)、偏最小二乘判别分析(partial least-squares discriminant analysis,PLS-DA)和正交偏最小二乘判别分析(orthogonal projection to latent structures discriminant analysis,OPLS-DA)等多元统计分析方法进行分析。根据变量权重的重要性排序值(variable importance in projection,VIP)进一步筛选具有差异的变量,选择其中差异倍数大于2且P<0.05者为差异代谢物。
2 结 果
2.1 仪器的稳定性及数据的可靠性
分别采用空白样品和QC样品,对实验过程进行质量控制。对4个空白样品的色谱图重叠处理后(图1A)发现它们的色谱图重叠在一起,没有额外的色谱峰出现,说明整个分析过程中色谱柱中没有物质残留,不存在交叉污染问题。
对各处理组样品和QC进行PCA分析,发现在PCA得分图中(图1B),QC样品聚集并位于所有样品的中间,说明了系统的稳定性和数据的可靠性。
2.2 防腐剂种类和浓度对尿液代谢物的影响
我们分别在正负两个离子模式下进行了数据采集。正离子模式下,对所有防腐剂组和对照组进行分析,观察各组数据的聚类情况,结果如PCA得分图(图2A,R2X=0.913,Q2=0.882),说明模型的拟合度和预测性良好。在PLS-DA得分图(图2B,R2Y=0.243,Q2=0.050)中可以看出,终浓度为2、20 mmol/L的硼酸处理组,以及0.1、1和10 mmol/L NaN3处理组,均与对照组样品聚集在一起,没有明显的分离趋势;而终浓度为200 mmol/L硼酸处理组与对照及其他样品组显著分离,提示加入硼酸的终浓度达到200 mmol/L时对尿液的代谢物有影响。
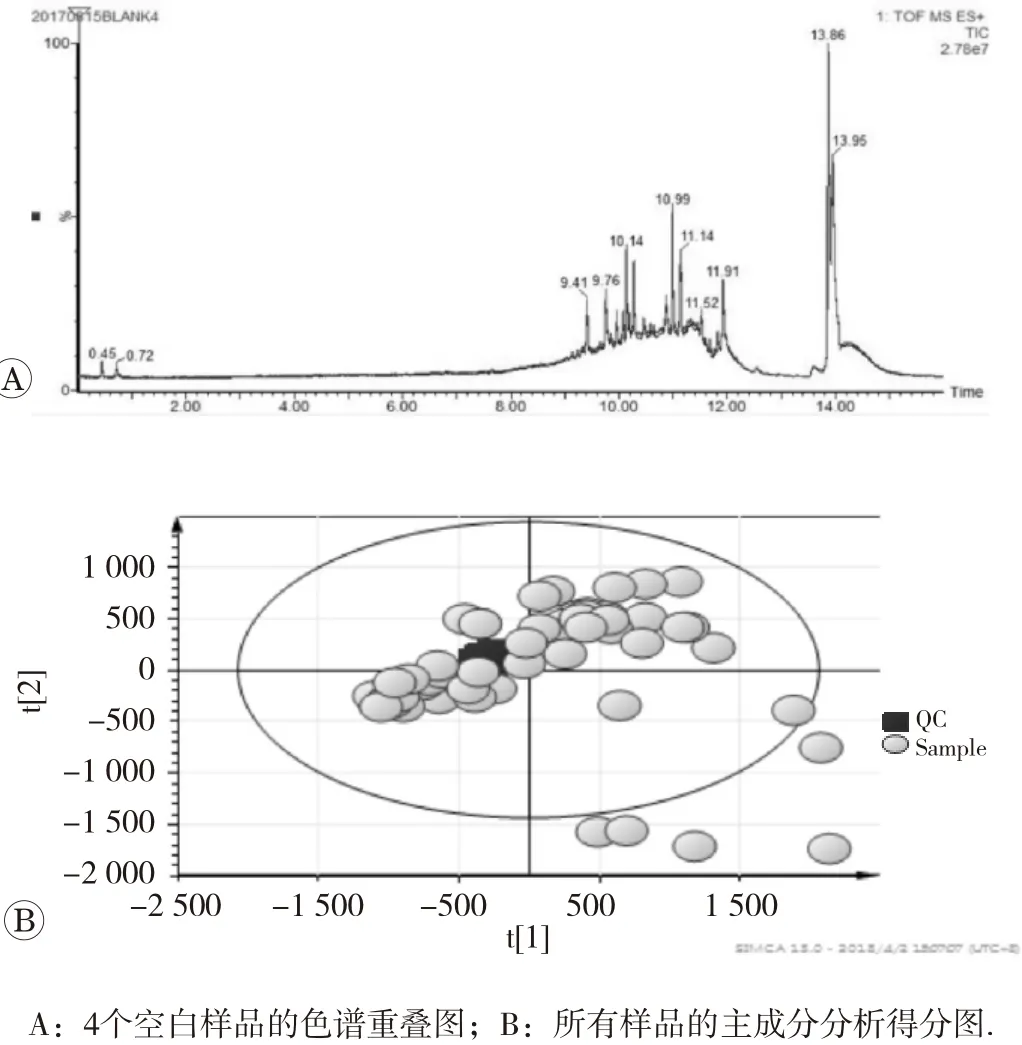
图1 仪器的稳定性及数据可靠性评估图
为了更好观察对照组与2、20 mmol/L硼酸处理组以及NaN3处理组之间的差异,我们暂时将200 m mol/L硼酸组移除,再次进行PLS-DA分析(图2C,R2Y= 0.140,Q2=0.035),发现对照组样品与这些处理组的尿样之间没有分离趋势,说明加入终浓度为2~20 mmol/L 硼酸和0.1~10 mmol/L NaN3不会对尿液代谢产物产影响。
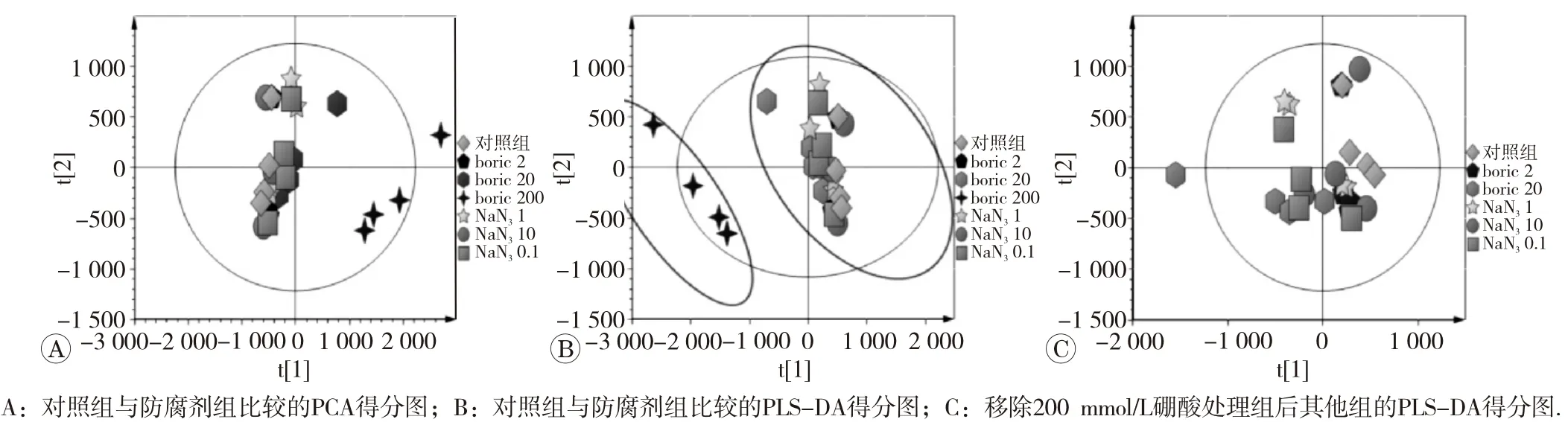
图2 不同防腐剂处理组与对照组比较的分析图
对负离子模式下的数据进行处理后,我们发现终浓度为20和200 mmol/L硼酸处理组样品与对照及其他组样品有明显的分离趋势。
2.3 200 mmol/L硼酸处理对尿液代谢物的影响
对200 mmol/L硼酸组和对照组作PCA和PLS-DA分析(图3A,R2X=0.963,Q2=0.921;图3B,R2Y=0.976,Q2=0.949),发现两组样品得到很好的区分,说明模型稳定且有较高的预测性。为了防止过度拟合,进一步对该PLS-DA模型做了置换检验(图3C),图中左侧随机实验数值均低于右侧原始值,说明模型的有效性。
进一步进行OPLS-DA分析(图3D),可看到200 mmol/L硼酸组和对照组显著分离,该模型的R2=0.976,Q2=0.955。为了观察在两组有显著差异的代谢物,我们筛选VIP>1、差异倍数大于2倍,且P<0.05的代谢物,最终得到235个差异代谢物,与对照组相比其中有147个的浓度升高,88个浓度降低。在负离子模式下,我们得到更多的差异代谢物,其中VIP>2的差异代谢物有92个。以上结果说明经200 mmol/L硼酸处理后,尿液代谢物有明显改变,所以不宜应用于基于UPLC/Q-TOF MS/MS技术的尿液代谢组学研究。

图3 浓度为200 mmol/L的硼酸处理对尿液代谢物影响分析图
3 讨 论
在代谢组学研究中,采用适宜的样品前处理方法以保证样品真实反映机体生理病理状态,这一点至关重要[5,10]。尿液是代谢组学研究中常用的样品,在收集过程易受到微生物的污染。在室温下,尿液中细菌菌落数变化显著,可能导致错误的临床诊断[9]。而细菌繁殖可消耗葡萄糖、还原硝酸盐或者分解尿素使pH升高,使尿液成分发生改变,最终结果可能无法真实反映机体的病理生理状态。Rotter等[8]通过流动注射电喷雾离子化串联质谱靶标分析发现人类尿液在室温(20℃)存放24 h后,精氨酸、色氨酸和己糖等6种代谢物明显下降。由此可见,控制微生物污染对样品成分的影响至关重要,NaN3和硼酸等防腐剂能有效抑制微生物繁殖,但目前的证据大多是基于NMR技术的,考虑到UPLC/Q-TOF MS/MS技术的灵敏度更高,且应用越来越广泛,因此本文采用UPLC/Q-TOF MS/MS技术探讨NaN3和硼酸这两种防腐剂对尿液代谢物的影响,最终发现0.1~10 mmol/L的NaN3和2 mmol/L的硼酸适于基于UPLC/Q-TOF M S/MS技术的尿液代谢组学研究。
研究中人们常采用多种防腐剂进行样品处理以消除微生物繁殖引起的代谢物改变,有学者研究了多种防腐剂的抑菌效果。Thongboonkerd等[11]研究了2~200 mmol/L硼酸和0.1~10 mmol/L NaN3的防腐效果。他们分别采用紫外可见分光光度法和革兰氏染色对细菌的繁殖进行确认,发现以上浓度的两种防腐剂可以有效抑制细菌生长,而且10 mmol/L NaN3和200 mmol/L硼酸组中的防腐作用能至少持续48 h,因此认为200 mmol/L硼酸和10 mmol/L NaN3的抑菌效果更好。Eisinger等[9]采用尿液防腐管(BD Vacutainer Plus Urine C&S reservative Tubes,主要成分是硼酸和甲酸钠等)发现其可以有效抑制细菌生长长达48 h,但他们没有进行其他方面的实验室检验。而Eksioglu等[12]则采用另一种尿液防腐管(BD Vacutainer®Plus Urinalysis Preservative Tubes,主要成分是丙酸钠),在不同时间点对防腐管中尿液进行生化指标的分析,发现4 h后样品中蛋白质减少了20%;48 h后血红蛋白减少了36%,白细胞酶减少了23%,该结果提示尿液中的代谢物发生了改变。以上研究均说明,在基于光学技术或者一般生化检测技术的研究中,NaN3和硼酸能有效抑制尿液样品中微生物的繁殖。但由于代谢组学中常用的液质联用和NMR等技术的灵敏度远远高于这些传统的技术,所以这些防腐剂是否仍适用于代谢组学中尿液样品的处理,仍值得进一步探讨。
Smith等[13]采 用基于1H NMR技术的研究发现,0~30 mmol/L的硼酸盐与甘露醇、柠檬酸等化学物之间相互作用,但与个体差异相比,该变化非常微弱,因此认为0~30 mmol/L的硼酸可应用于基于NMR技术的尿液代谢组学研究。但由于NMR相对灵敏度低、动态范围有限[14],而UPLC/Q-TOF MS/MS的灵敏度和分辨率显著高于NMR[15], 所以Smith等[13]的结果并不能直接应用于基于UPLC/Q-TOF MS/MS的代谢组学研究。Roux等[16]在尿液中添加200 mmol/L硼酸,采用液质联用技术检测后发现,加入200 mmol/L硼酸的尿样与未加入者有一定分离趋势,因此认为200 mmol/L硼酸虽能抑制细菌生长,但对尿液中的代谢物有一定影响,该结果与本文一致。本研究中,我们还发现虽然在正离子模式下20 mmol/L硼酸未对尿液代谢图谱产生明显影响,但在负离子模式下20 mmol/L硼酸处理后的尿液样品与对照组有明显分离趋势,因此我们认为将硼酸作为防腐剂应用于尿液代谢组学研究时,浓度应低于20 mmol/L。
Lauridsen等[17]使用NaN3作为防腐剂处理尿液样品,采用NMR技术对样本进行检测,发现0.1% NaN3(相当于15.38 mmol/L)处理的样品与对照组没有分离趋势,说明0.1% NaN3适于基于NMR技术的尿液代谢组学研究。本研究发现10 mmol/L NaN3处理对尿液代谢图谱无明显影响,该浓度比Lauridsen等[17]所用的NaN3浓度要低,但考虑UPLC/Q-TOF MS/MS检测技术的灵敏度,同样可以认为添加NaN3对尿液代谢物影响较小。
综上所述,在基于UPLC/Q-TOF MS/MS技术的尿液代谢组学研究中,我们发现0.1~10 mmol/L NaN3和2 mmol/L硼酸可有效抑制微生物的繁殖,同时对尿液中的代谢物影响较小,是比较适宜的尿液样品的处理方法。但高浓度的硼酸到底影响了哪些代谢产物,尚需进一步确认。
