发泡法吸收四氧化二氮废气的试验研究
2018-12-06王伟清王胜群黄希云龚景城
童 伟,王伟清,王胜群,王 杰,黄希云,龚景城
(酒泉卫星发射中心,甘肃 酒泉 732750)
四氧化二氮作为液体火箭推进剂在导弹武器和航天运载工具上已得到广泛应用[1],但四氧化二氮具有高毒性,可以通过呼吸道或皮肤引发人员中毒甚至死亡,且与大多数有机物接触会发生燃烧甚至爆炸,具有火灾、爆炸危险性[2]。由于四氧化二氮沸点较低(21.2℃)[3],一旦泄漏会由液体迅速蒸发成为二氧化氮气体,有强烈的刺激臭味,且密度比空气大[4],在地表聚集形成红棕色烟,会给操作人员和环境带来不同程度的危害。
四氧化二氮废气处理问题一直是困扰科研工作者的难题,常用的处理方法中填料塔水吸收法是中、小型化工企业常用的手段[5],该法吸收装置较为简单、投资成本低,能使氮氧化合物大部分转化为硝酸盐,但由于少量NO极难溶于水溶液,吸收效率不高;燃烧处理法对四氧化二氮废气的处理效果较好,但该法的吸收装置体积庞大、难以移动,只能在固定场所使用;而直接排放四氧化二氮废液或废气会给环境带来较大的危害。由于在实验室现有条件下很难对四氧化二氮废气进行有效处理,因此亟需研制一种不仅能高效处理四氧化二氮及其产物,而且满足便携化、易操作、成本低、可推广的吸收四氧化二氮废气的新方法。
针对液体四氧化二氮遇水反应剧烈、极易喷溅的现象,本文拟将四氧化二氮液体转化为气体,设法实现对四氧化二氮气体(以下称四氧化二氮废气)的安全高效吸收。前期探索得知,在吸收剂溶液中加入少量泡沫剂,生成的泡沫层实现了对四氧化二氮废气的致密覆盖,且未检测到四氧化二氮废气逸出,收到了明显的吸收效果,以此作为研究方向具有一定的可行性。为此,本文开展了发泡法吸收四氧化二氮废气的试验研究,通过筛选吸收剂、泡沫剂和起泡方式,确定了四氧化二氮废气吸收系统的组合液配方,建立了四氧化二氮废气处理的新方法,可切实解决四氧化二氮废气的危害问题。
1 材料与方法
1. 1 主要仪器和试剂
主要仪器:TJNB-3型毒气浓度监测仪(北京精密仪器有限公司);普兰德Transferpette®S数字可调型移液器(上海成贯仪器有限公司);MS300型磁力加热搅拌器(上海般特仪器有限公司); HP8453E型紫外-可见分光光度计(美国Agilent公司)。
主要试剂:水为二次蒸馏水;盐酸、碳酸氢钠、冰乙酸、尿素、氨基磺酸、对氨基苯磺酸、盐酸奈乙二胺均为分析纯;硝酸钾为优级纯;G型泡沫剂、Z型泡沫剂、F型泡沫剂、S型泡沫剂、M型泡沫剂、P型泡沫剂(陕西科技股份有限公司);四氧化二氮样品(中国石油吉林石化公司)。
1. 2 试验装置
试验装置主要由两部分组成:一部分是废气发生源,它的作用是保持样品钢瓶提供连续稳定的四氧化二氮废气,可通过恒温加热装有四氧化二氮的钢瓶实现;另一部分是废气吸收系统,它主要由水、泡沫剂、吸收剂等组合试液组成。试验装置示意图见图1。

图1 试验装置示意图Fig.1 Schematic diagram of the experimental device
1. 3 泡沫剂的选取
在常温下,向6个2 L烧杯中各加入1 L水,再分别加入不同种类的泡沫剂3 mL,然后向烧杯中通入四氧化二氮废气,记录溶液体积上升至2 L刻度线位置所用的时间,并以起泡时间衡量不同种类泡沫剂的起泡速率;待溶液达到2 L刻度线,立即停止通入四氧化二氮气体,重新开始计时,记录溶液体积下降至1 L刻度线所用的时间,并以消泡时间评价泡沫的稳定性。平行测定5组,挑选出起泡速率快且泡沫稳定时间长的泡沫剂种类。
1. 4 吸收剂的选取及其用量的确定
依次称量50 g氢氧化钠、50 mL过氧化氢、50 mL高锰酸钾溶液(0.08 mol/L)、50 g尿素,分别溶于1 L水(2 L烧杯盛装)中,充分搅拌至完全溶解,以1 L水作空白对照;然后向这5组不同吸收液(包括空白对照组)中分别加入3 mL泡沫剂,并将四氧化二氮废气通入吸收液中,观察并记录试验现象,比较不同吸收剂与泡沫剂的相容性和协同性。
将每次吸收时间设定为1 min,根据四氧化二氮溢出速度以及吸收剂和四氧化二氮的化学计量关系,推算出吸收剂的用量。连续给废气吸收系统通入四氧化二氮废气,记录1 min内消耗废气的质量。在相同条件下进行10组平行测定试验。
1. 5 发泡方案设计
在4个2 L烧杯中均加入1 L水、10 g尿素、3 mL泡沫剂,依次编号为1、2、3、4号;然后各烧杯中均通入四氧化二氮废气,其中1号烧杯要求用玻璃棒相同方向搅拌(玻璃棒搅拌法),2号烧杯通过磁力搅拌子搅拌(磁力搅拌法),3号烧杯通过空气瓶不断鼓入气体(气体鼓入法),4号烧杯依次加入5 g碳酸氢钠和4.5 mL盐酸(正好完全反应)并用玻璃棒搅拌均匀(化学反应发泡法);最后观察并记录各烧杯内起泡情况。
1. 6 硝酸盐氮含量的测定
1.6.1 硝酸盐氮标准工作曲线的绘制
依次向6个100 mL容量瓶中加入0 mL、0.25 mL、0.50 mL、1.00 mL、1.50 mL、2.00 mL硝酸盐氮标准溶液(0.1 mg/mL),再各加入1.0 mL 1 mol/L盐酸溶液和0.1 mL氨基磺酸溶液(w=0.8%),稀释至标线;在分光光度计上以光程长1 cm的石英比色皿测量不同浓度标准溶液在220 nm处的吸光度,进而绘制硝酸盐氮的标准工作曲线。
1.6.2 吸收液硝酸盐氮含量的测定
吸收时间设定为1 min,吸收前对样品钢瓶进行称量,质量记为m0;反应1 min后,停止通入四氧化二氮废气,再对样品钢瓶进行称量,质量记为m1;充分搅拌使吸收液适量消泡,将溶液静置10 min,待反应体系趋于稳定后,移取1 mL试液在25 mL比色管中定容至刻度线,充分摇匀,静置待用;按标准溶液测定相同步骤操作,测量溶液在220 nm处的吸光度,记为Am,并根据硝酸盐氮的标准工作曲线计算得到硝酸盐氮的含量ρm。
1. 7 亚硝酸盐氮含量的测定
四氧化二氮废气被吸收液吸收后,生成亚硝酸和硝酸,其中亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸奈乙二胺偶合,生成玫瑰红色染料,并根据颜色深浅,采用分光光度法测量溶液在540 nm处的吸光度[5]。
1.7.1 亚硝酸盐氮标准工作曲线的绘制
依次向6个50 mL容量瓶中加入0 mL、1.00 mL、3.00 mL、5.00 mL、7.00 mL和10.00 mL亚硝酸盐氮标准溶液(1 μg/mL),再加入1.0 mL显色剂后,稀释至标线;充分摇匀,放置暗处静置20 min后,在分光光度计上以光程长10 nm的石英比色皿测量不同浓度标准溶液在540 nm处的吸光度,进而绘制亚硝酸盐氮的标准工作曲线。
1.7.2 吸收液亚硝酸盐氮含量的测定

2 结果与讨论
2. 1 泡沫剂的选取
6种泡沫剂的起泡时间见图2。
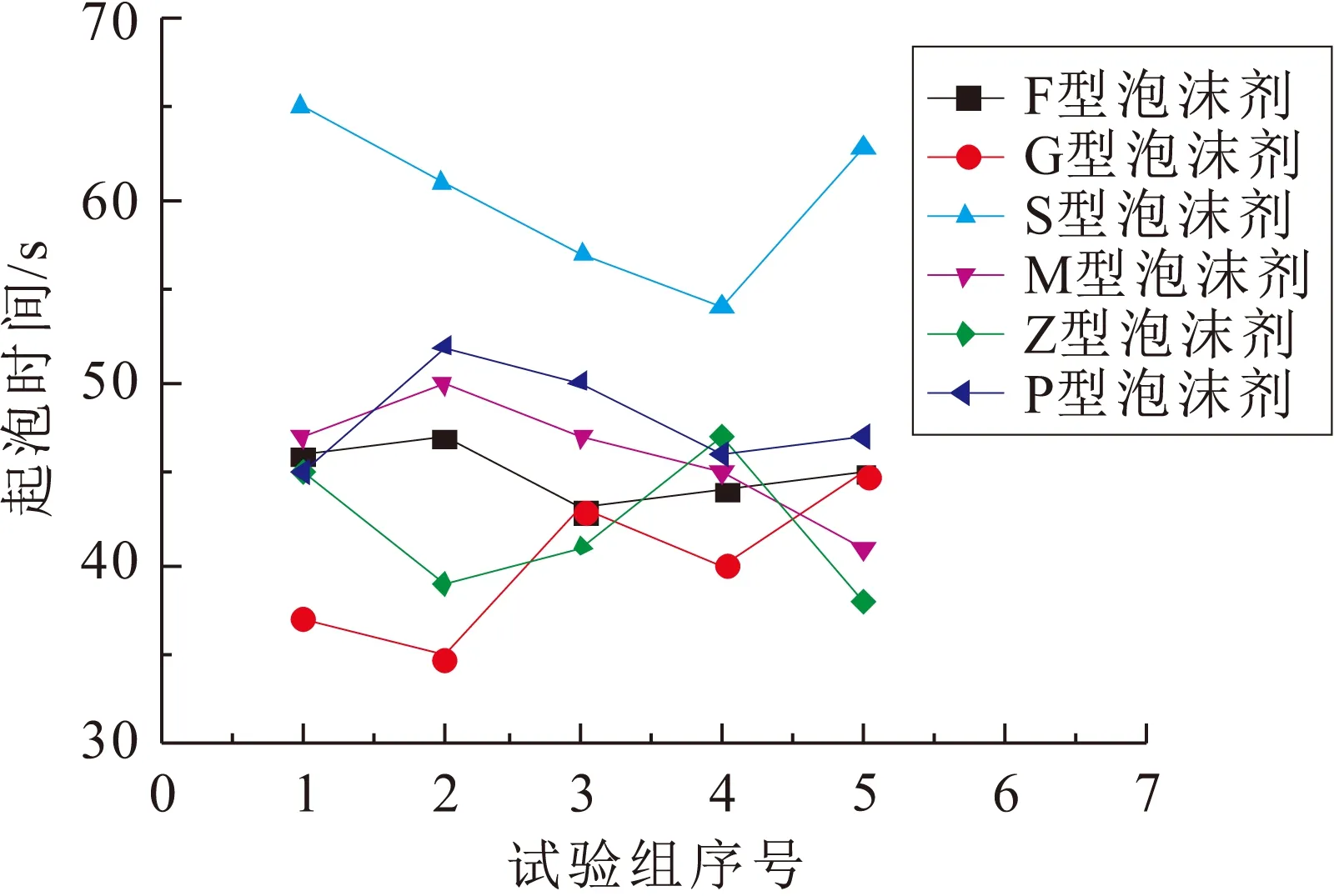
图2 6种泡沫剂的起泡时间Fig.2 Foaming time of six kinds of foaming agents
由图2可见,除S型泡沫剂起泡时间稍长外,其他5种泡沫剂发泡效果差别不大,且均在50 s(均值)以内发泡至2 L刻度线。此外,在试验过程中还发现,F型、P型泡沫剂所生成的泡沫层致密均匀,且未见大气泡存在,其他4种泡沫剂所生成的泡沫层均较为稀松离散,有部分或大量大气泡夹杂其中。
6种泡沫剂的消泡时间见图3。
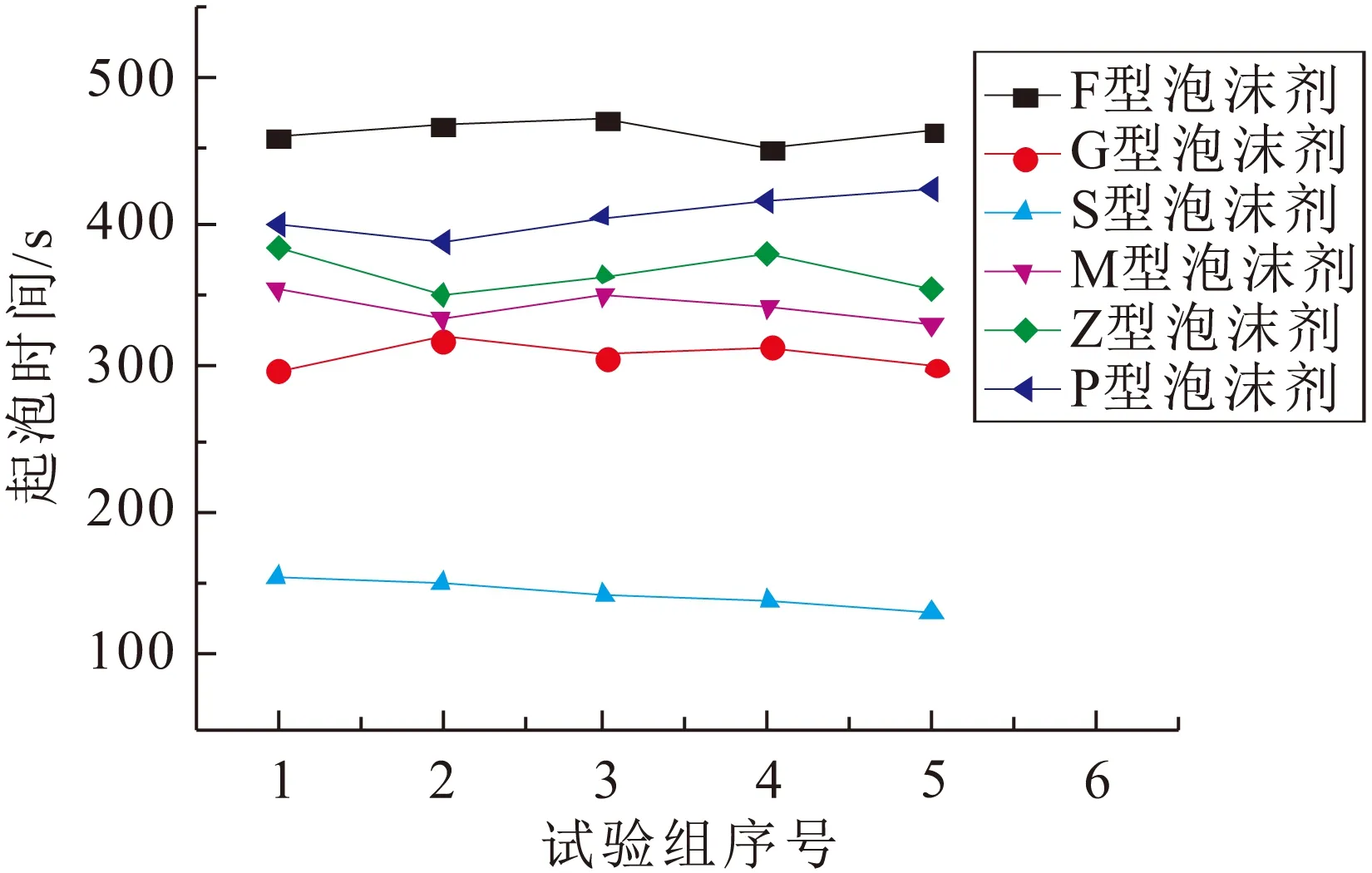
图3 6种泡沫剂的消泡时间Fig.3 Defoaming time of six kinds of foaming agents
由图3可见,F型、P型泡沫剂所生成泡沫的稳定时间最长,均在400 s(均值)以上,S型泡沫剂所生成泡沫的稳定时间最短,只能维持143 s(均值),而且所生成的泡沫较为松散。
分析图2和图3可知:①泡沫剂起泡速率与其发泡倍数和组成成分密切相关,G型、Z型泡沫剂表现出较高的发泡速率,是因其自身较高的发泡倍数,而F型泡沫剂虽是低倍数发泡剂,但因其含有适量的氟碳表面活性剂,大大加强了其发泡能力,这是因为氟碳表面活性剂能以极低的浓度显著降低溶剂表面张力,且F-C键键能高,很难被破坏,使其非常稳定,另外能与其他各类活性剂很好地相容,可广泛用于各种配方体系;②大气泡是决定泡沫剂寿命的主要因素,由于大气泡膜壁较薄,使其极易受挤压而破碎[6],而且其易受蒸发、振动等因素影响,故寿命一般不长,而致密泡沫层则不同,泡沫排布紧密、间隙较小,减少了泡膜表面溶剂蒸发,泡沫分子相互补充、协同作用,延长了泡沫的寿命,故泡沫的稳定时间长。
综上分析可见,F型泡沫剂起泡速率快、泡沫层致密、泡沫稳定性好,是6种泡沫剂中综合性能最好的一种泡沫剂。因此,本试验研究所用泡沫剂除特殊说明的外,均指该类泡沫剂。此外,结合泡沫剂自身使用特性(加入少量即可显著改善溶液界面状态)[7],本试验中F型泡沫剂的用量设定为3 mL。
2. 2 吸收剂的选取及其用量分析
2.2.1 吸收剂的选取结果与分析
水中直接加入泡沫剂吸收持续时间不长,后期起泡难度逐渐加大,有部分大气泡生成,极易受挤压而破碎,导致废气不断逸出;在泡沫剂中加入氢氧化钠吸收剂,会使得泡沫剂中蛋白质分子失活,致使泡沫剂起泡等性能缺失,泡沫剂无法正常发泡;在泡沫剂中加入高锰酸钾吸收剂,在短时间内对废气的吸收效果尚可,但在实际应用中会受到高锰酸钾溶解性能的限制;在泡沫剂中加入过氧化氢吸收剂,过氧化氢与高锰酸钾溶解性不同,其与水可以任意比例互溶,对废气的吸收效果稍好于高锰酸钾;在泡沫剂中加入尿素吸收剂,尿素反应中生成的大量气体会加快泡沫均匀生长,有利于形成致密泡沫层,可大幅提高其吸收效果。
通过比较以上5种吸收剂,得出尿素吸收剂对四氧化二氮废气的吸收效果最佳。尿素不仅价廉易得,而且其与泡沫剂的组合试液发泡快、泡沫量大、泡沫稳定性强,两者的相容性、协同性均较好,可用于四氧化二氮废气的持续吸收。
2.2.2 吸收剂的用量分析
吸收剂的用量与四氧化二氮废气处理量直接相关。四氧化二氮与尿素的反应式如下[5]:
N2O4+CO(NH2)2→N2+CO2+NH4NO3
(1)
利用反应式中四氧化二氮与尿素的化学计量关系,可得出吸收剂尿素用量的计算公式如下:
(2)
式中:mu为尿素的质量(g);mn为四氧化二氮的质量(g);60、92分别为尿素和四氧化二氮的相对分子质量。
在相同供气条件下,四氧化二氮废气出气量总体上是稳定的,可将其测定的平均值作为四氧化二氮废气产生量的参考值,再利用公式(2)计算出吸收剂尿素的理论使用量。四氧化二氮废气产生量和吸收剂尿素的理论使用量详见表1。
由表1可知,吸收剂尿素用量的平均值为9.2 g。考虑到吸收剂的过量原则和高溶解性能,将吸收剂尿素用量按过量约10%进行计算,则吸收剂尿素实际用量选取为10 g。

表1 四氧化二氮废气产生量和吸收剂尿素的理论使用量
2. 3 起泡方式的选择与分析
本试验设计的发泡方案中,玻璃棒搅拌法只能在液面上方产生一层薄的泡沫,泡沫无法继续生长,该法不推荐使用;磁力搅拌法只能带动局部搅动,泡沫产生量较少,且搅拌动力不足,空气无法大量被引入溶液,故起泡效果不佳;气体鼓入法虽可将气体引入溶液,加快泡沫剂均匀分散,但空气在水中溶解性差,引起气泡大小不均,无法形成致密泡沫层,泡沫极易破碎消褪;化学反应发泡法所生成的泡沫层最为致密均匀,而且泡沫稳定时间长、起泡速率快,分析原因主要有:一是盐酸与碳酸氢钠反应产生的大量气体加快了液面泡沫剂均匀分布,缩短了泡沫层形成定向排列的时间[8],降低了液面表面张力,更易起泡;二是四氧化二氮与尿素反应自身也产生气体,使得溶液内气体平稳上浮,泡沫剂受力均匀,有利于形成致密细腻的泡沫层[9]。
综上分析可知,化学反应发泡法起泡速率快、起泡方式简单、泡沫稳定性好,与尿素协同发挥覆盖吸收作用,是4种起泡方式的首选方法。
2. 4 吸收液配方的确定
由以上分析可知,四氧化二氮废气吸收系统的吸收液中水的用量为1 L,F型泡沫剂的用量为3 mL,吸收剂尿素的实际用量为10 g,起泡方式为化学反应发泡法,反应试剂碳酸氢钠和盐酸加入量分别为5 g、4.5 mL。
2. 5 四氧化二氮废气吸收率的计算结果与分析
2.5.1 硝酸盐氮标准工作曲线的建立
分别以吸光度和硝酸盐氮标准溶液体积为纵、横坐标,建立了硝酸盐氮的标准工作曲线,见图4。
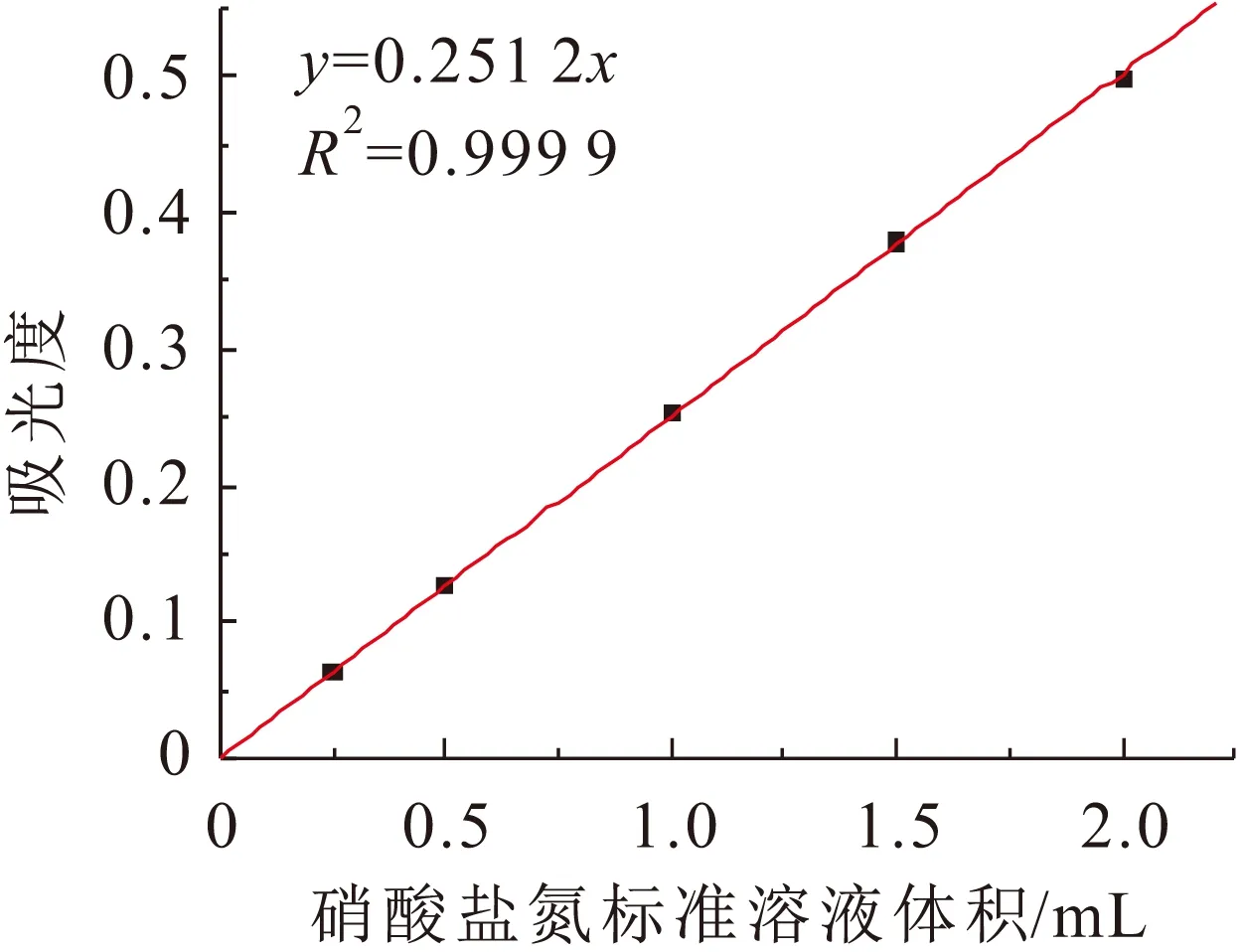
图4 硝酸盐氮的标准工作曲线Fig.4 Standard work curve of nitrate-nitrogen
由图4可见,拟合得到的吸光度与硝酸盐氮标准溶液体积的线性方程为y=0.251 2x,相关系数R2=0.999 9,表明该拟合曲线线性相关程度极好。
2.5.2 吸收液中硝酸盐氮含量的计算
吸收液中硝酸盐氮的含量可通过硝酸盐氮标准工作曲线计算得出,由吸光度值找到对应的硝酸盐氮标准溶液体积值,并结合硝酸盐氮标准溶液的浓度换算成硝酸盐氮的质量,则硝酸盐氮含量的计算公式为
(3)
式中:ρm为硝酸盐氮的含量(mg/L);k为比例常数;Am/k为100 mL容量瓶中对应的硝酸盐氮标准溶液的体积(mL);25/V0为比色管中原有体积与比色管中取出体积之比;ρk为硝酸盐氮标准溶液的浓度(mg/mL),ρk=0.1 mg/mL;Vt为从吸收液中取出的样品体积(mL),Vt=1 mL。
2.5.3 四氧化二氮废气吸收率的计算与分析
四氧化二氮废气的实际吸收量是四氧化二氮与吸收液中尿素真实反应的那一部分,由公式(1)中四氧化二氮与硝酸盐氮的化学计量关系,可推出四氧化二氮废气实际参与反应的量,其计算公式为
(4)
式中:mN为四氧化二氮废气的实际吸收量(g);VL为吸收液的体积(L),VL=1 L;92和14分别为四氧化二氮的相对分子质量和氮的相对原子质量。
四氧化二氮废气吸收系统对四氧化二氮废气的吸收率可由四氧化二氮废气的实际吸收量与理论吸收量的比值求得。其中,四氧化二氮废气的理论吸收量即为反应前后样品钢瓶的质量差,用m0-m1表示。四氧化二氮废气吸收率η的计算公式为
(5)
本次吸收试验吸收液中硝酸盐氮的含量ρm和四氧化二氮废气吸收率η的计算结果见表2。

表2 吸收试验数据处理结果
由表2可知,经多次试验测定得到的四氧化二氮废气吸收率的计算结果较为接近,其标准偏差为1.00%,相对标准偏差为1.06%,这说明该方法的建立能较好地保证硝酸盐氮含量测定的平行性和重现性。
关于水和氢氧化钠溶液对四氧化二氮废气的吸收率测定,前人已有研究[10],在密塞碘量瓶中,通过摇碎已知纯度的四氧化二氮安瓿球样,改变水的加入量,5 min内水对四氧化二氮废气的吸收率最高可达75%,10 min内水对四氧化二氮废气的吸收率最高可达82%,而用过量氢氧化钠在密塞5 min充分振荡条件下,其吸收率均值可达90.9%。本文的研究方法与之不同,通过泡沫剂发泡形成的致密泡沫层,在敞口式开放条件下,即可完成对四氧化二氮废气的高效率吸收,1 min内即可达到93.7%的吸收率,显著改善了对四氧化二氮废气的吸收效果。
2. 6 亚硝酸盐氮含量的测定结果与分析
2.6.1 亚硝酸盐氮标准工作曲线的建立
分别以吸光度和亚硝酸盐氮标准溶液体积为纵、横坐标,建立了亚硝酸盐氮的标准工作曲线,见图5。

图5 亚硝酸盐氮的标准工作曲线Fig.5 Standard work curve of nitrite-nitrogen
由图5可见,拟合得到的吸光度与亚硝酸盐氮标准溶液体积的线性方程为y=0.006 9x,相关系数R2=0.999 5,说明该拟合曲线线性相关程度较好。
2.6.2 吸收液中亚硝酸盐氮含量的计算与分析
吸收液中亚硝酸盐氮的含量可通过亚硝酸盐氮标准工作曲线上,由吸光度值找到对应的亚硝酸盐氮标准溶液体积值,并结合亚硝酸盐标准溶液的浓度换算成亚硝酸盐的质量,则亚硝酸盐氮含量的计算公式为
(6)

根据公式(6)计算得出的亚硝酸盐氮含量,可绘制亚硝酸盐氮含量的柱形图,见图6。

图6 亚硝酸盐氮含量的柱状图Fig.6 Bar chart of the nitrite-nitrogen content
由图6可见,经多次试验测定得到的亚硝酸盐氮含量的计算结果较为接近,这说明该方法的建立能基本保证亚硝酸盐含量测定的重现性。
亚硝酸盐是一种致癌毒性物质,必须对其进行严格控制与处理。我国国家标准《地表水环境质量标准》(GB 3838—2002)中规定亚硝酸盐氮在地表水中的质量浓度不高于0.2 mg/L(即200 μg/L)[11],由本次吸收试验测定结果可知,发泡法吸收处理后亚硝酸盐氮的质量浓度(均值为32.3 μg/L)低于国家标准规定的地表水中亚硝酸氮质量浓度的排放标准限值。这是因为随着吸收试验的进行,溶液逐渐呈酸性,吸收剂尿素在酸性条件下可迅速将亚硝酸根还原成氮,不利于其大量稳定存在[9]。
3 结 论
本文建立了四氧化二氮废气吸收的新方法,主要利用泡沫剂与吸收剂作用生成的致密泡沫层,实现了对四氧化二氮废气的多层覆盖吸收[9],并通过泡沫剂起泡速率和泡沫稳定时间两项重要指标综合评定了泡沫剂的使用性能和吸收效果,确定F型泡沫剂为最佳泡沫剂,选择尿素为最佳吸收剂,并最终得到四氧化二氮废气吸收系统组合液的配方是:吸收液中水的用量为1 L、吸收剂尿素的实际用量为10 g、F型泡沫剂的用量为3 mL、发泡方式为化学反应发泡法、反应试剂碳酸氢钠和盐酸的加入量分别为5 g、4.5 mL。在进行1 min连续吸收后,四氧化二氮废气的吸收率均值达到了93.7%,亚硝酸盐氮含量均值为32.3 μg/L,低于国家标准规定的地表水中亚硝酸盐氮含量(质量浓度)的排放标准限值(200 μg/L),真正意义上实现了对四氧化二氮废气的高效率吸收和无毒化排放,并且该方法处理四氧化二氮废气的安全性和可靠性明显提高,具有较高的环保效益和推广价值。
