匍枝根霉纤维素酶高产菌株的诱变选育及发酵优化
2018-12-03郑贤金
郑贤金,汤 斌
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
纤维素酶作为一种重要的工业酶制剂,具有环保、高效地将纤维素转化成人类需要的能源和其他工业原料的功能,因而被广泛应用于畜牧、纺织、造纸、食品工业等诸多领域,如作为动物饲料添加剂、增加棉织物的光洁度和柔软度等[1-2].然而,纤维素酶酶活性低、生产成本高是制约其应用的关键因素.为降低纤维素酶生产成本,国内外学者展开了大量的研究工作,这些研究包括从自然界中筛选高产菌株、在实验室中对保藏的微生物菌株进行遗传改良和对纤维素酶基因进行分子改造等.孙尚琛[3]等从牛粪、枯枝、麦垛腐殖质中筛选、分离得到一株短小芽胞菌,其FPA酶活最高为1 204 U/mL(等同于6.7 IU/mL);Zhang X Y[4]等对里氏木霉Rut-30进行甲基磺酸乙酯诱变,获得突变株D-7,酶活为4.53 IU/mL,比Rut-30提高了57.55%;张飞[5]等利用人工锌指蛋白文库转化里氏木霉Rut-30,筛选高产纤维素酶的突变株,最终FPA酶活达到4.58 IU/mL.这些手段不同程度提高了纤维素酶的酶活,但距离大规模生产应用仍有差距.
研究所使用出发菌株匍枝根霉TP-02,由安徽工程大学3R实验室从国家5A级旅游景区黄山采集分离得到.TP-02具有酶活高、发酵时间短等特性[6],因而可能对进一步提高纤维素酶产量具有重要的工业应用潜力.研究通过对TP-02诱变处理得到一株高产纤维素酶菌株TZ-03,并对其培养基组分进行优化,确定最优培养基,在此基础上进行10L发酵罐放大实验及发酵条件控制,最终提高了纤维素酶产量.
1 材料与方法
1.1 材料与试剂
(1)菌株.匍枝根霉TP-02,为安徽工程大学3R实验室筛选及保藏.
(2)主要试剂.甲基磺酸乙酯(Ethylmethylsulfone,EMS),购于生工生物工程(上海)股份有限公司;微晶纤维素,购于河南华悦化工产品有限公司;其余试剂均采购于国药集团化学试剂有限公司.
(3)培养基.筛选培养基:CMC 15 g/L,(NH4)2SO42 g/L,MgSO40.5 g/L,KH2PO41 g/L,121 ℃灭菌20 min.种子培养基:10%麸皮浸出汁(100 g新鲜麸皮加入1 000 mL蒸馏水,煮沸30 min,六层纱布过滤并最终定容至1 000 mL),121 ℃灭菌20 min.发酵培养基:稻草粉(80目)20 g/L,豆粕粉10 g/L,5%麸皮浸出汁,CaCl22 g/L,MgSO4·7H2O 3 g/L,KH2PO43 g/L,PEG-4000 0.25 g/L,Tween 80 200 μL/L,微量元素溶液1 mL/L,121 ℃灭菌20 min.微量元素溶液:FeSO4·7H2O 0.005 g/L,MnSO4·H2O 0.001 6 g/L,ZnSO4·7H2O 0.001 4 g/L,CoCl2·2H2O 0.002 g/L.
1.2 仪器与设备
L3 723分光光度计、SW-CI-10 单面垂直净化操作台、BOXUN立式压力蒸汽灭菌锅、SHA-CA数显恒温振荡器、新亚特正品ZWS 90W紫外灯管、BIOTECH-10JSA-3000PLC自动发酵罐.
1.3 实验方法
(1)菌株诱变及筛选.将匍枝根霉TP-02接种至PDA斜面培养基上培养,待其长成后用无菌生理盐水从斜面上将孢子洗下并通过计数控制质量分数在107~108个/mL,制备孢子悬浮液.取10 mL孢子悬液于9 cm无菌培养皿中,将其置于90 W紫外灯下30 cm处,打开平皿盖,分别照射1~7 min,间隔1 min,进行紫外诱变[7];取2 mL EMS原液加4 mL pH 7.2的磷酸缓冲液配成EMS母液,处理时间30~180 s,间隔30 s,进行EMS诱变,反应结束后立即加入10% NaS2O3溶液终止反应[8].将处理液梯度稀释适当倍数后涂布于刚果红筛选培养基,待其长成后,以菌落周围透明圈的大小为主要指标,挑取透明圈大、菌落小的菌落转接到PDA斜面上.将初筛得到的菌株接种于种子培养基,30 ℃、200 r/min条件下培养24 h后按10%接种量转接至发酵基础培养基中.30 ℃、200 r/min条件下培养5 d,测定滤纸酶活,以滤纸酶活为指标进行复筛.以上述诱变后得到的高产菌为出发菌株进行紫外-EMS复合诱变,其条件为单因子诱变最优条件[8].
(2)发酵条件优化.
①碳氮源优化.分别以质量分数为2%的蔗糖、葡萄糖、纤维二糖、木糖、乳糖、可溶性淀粉、玉米淀粉、糊精、麸皮粉、稻草粉、微晶纤维素、CMC、壳聚糖为碳源,加入到含有豆粕粉1%、麸皮浸出汁2.5%、CaCl20.2%、MgSO4·7H2O 0.4%、KH2PO40.3%、微量元素液0.002%、Tween 80 200 μL/L、PEG-4000 0.025%的250 mL锥形瓶中,装液量为80 mL.灭菌后按10%接种量接入匍枝根霉种子液,在30 ℃、200 r/min条件下培养5 d,24 h后每12 h测定一次滤纸酶活.在确定最佳碳源的条件下,分别以1%的硫酸铵、氯化铵、胰蛋白胨、鱼粉蛋白胨、大豆蛋白胨、豆粕粉、豆渣粉、黄豆粉、酵母粉、乳清粉、玉米浆和0.5%的尿素为氮源,按同样方式发酵,测定酶活.
②各种氨基酸的添加对酶活的影响.以碳氮源单因素实验得到的最优结果为碳氮源,其他成分保持不变,配置发酵培养基,121 ℃灭菌20 min.向灭菌后的发酵培养基中添加已过滤除菌的各种氨基酸,使其最终质量分数为0.1%.以10%的接种量接种培养24 h后的TZ-03种子液,30 ℃、200 r/min条件下培养,每隔12 h测定滤纸酶活.
(3)发酵产纤维素酶条件研究.经过培养基组分优化确定摇瓶发酵的最优条件,此条件下分别以TP-02和TZ-03为出发菌株进行发酵产纤维素酶,观察诱变前后酶活的变化.利用摇瓶优化的最佳培养基进行10 L发酵罐放大实验.装液量5 L,接种量为10%,温度为30 ℃,初始转速300 r/min,初始罐压0.06 MPa.在发酵过程中通过对转速、通气量和罐压等参数的调节,控制溶氧维持在30%左右;通过调节磷酸、氨水的添加量控制pH维持在4.8左右;发酵24 h后每隔3 h测定一次发酵液中还原糖含量,以还原糖含量为指标,调整20%淀粉水解液的补加速度,控制发酵液中的还原糖含量基本维持在1.2 mg/mL.
(4)各指标实验方法.
①致死率计算.分别统计未经紫外和EMS处理的PDA平板菌落数和经过不同时间诱变处理后的PDA平板菌落数,按以下公式计算诱变致死率.

②酶活测定.取发酵液1.2 mL于1.5 mL离心管中,3 500 r/min离心10 s后,将上清液用0.05 mol/L pH 4.8柠檬酸-柠檬酸钠缓冲液稀释适当倍数用于酶活测定.分别以1 cm×6 cm滤纸条、1%CMC溶液1 mL、2%微晶纤维素1 mL和1%水杨苷溶液1 mL为底物[9],测定FPA酶活、CMC酶活、CBH酶活和BG酶活.酶活定义:适当反应条件下,每分钟水解底物生成1 μmol还原糖所需的酶量即为一个酶活单位,表示为IU/mL.
2 结果与分析
2.1 菌株诱变及筛选
(1)单因子诱变.通过致死率计算得知紫外照射的最优时间为5 min,此时的致死率为96.15%;EMS的最佳诱变时间为120 s,菌株的致死率达到98.63%.以此最优条件进行多次诱变,将诱变后的孢子悬液稀释适当倍数后涂布于刚果红筛选培养基.利用培养基上透明圈的大小[10]和FPA酶活高低筛选出两种诱变方式处理后酶活较高的突变株各8株,并命名为UV 01-08,EMS 01-08.
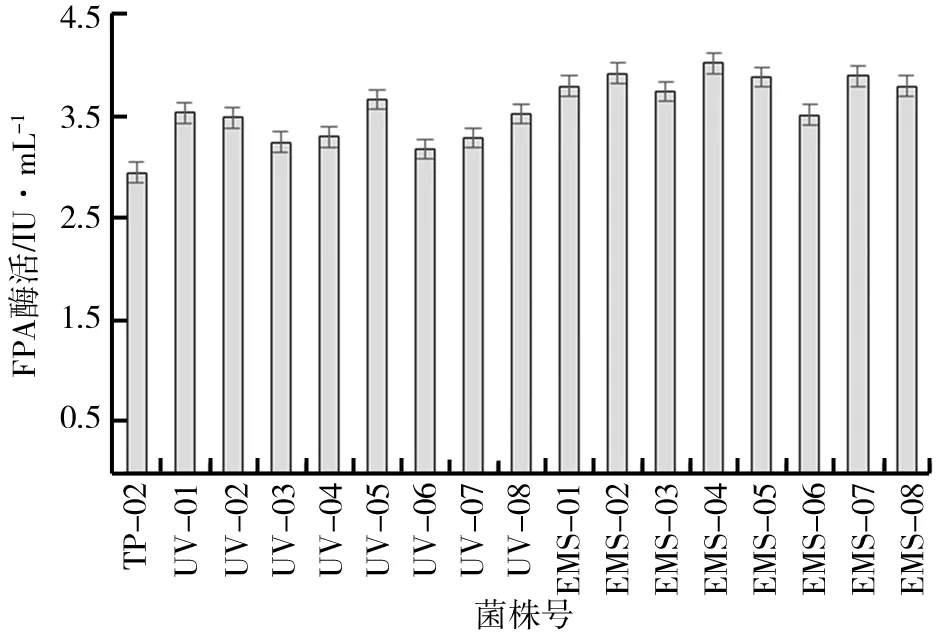
图1 诱变后各突变株的FPA酶活
诱变后各突变株的FPA酶活如图1所示.由图1可知,紫外诱变得到的突变株中UV-05提高明显,其FPA酶活较TP-02提高了24%;EMS诱变效果优于紫外诱变,其中EMS-04的FPA酶活最高,与TP-02相比,其FPA酶活提高了32.2%.诱变剂的复合处理通常表现为协同作用,且不同诱变剂处理后的稳定性不同,紫外线处理后菌株难以回复突变[11].综合考虑菌株的稳定性和酶活选取UV-05、EMS-02、EMS-04、EMS-05、EMS-07为出发菌株,进行后续复合诱变.
(2)复合诱变.对复合诱变得到的菌株进行初筛、复筛,最终由UV-05复合诱变后筛选得到的突变株效果最好,命名为TZ-03,其FPA酶活在108 h可达到4.96 IU/mL,相对TP-02提高了37.8%.TP-02与TZ-03的菌落形态及透明圈对比图如图2所示.由图2可知,诱变前孢子呈现灰褐色,具有细长菌丝;诱变后,菌丝变短,且孢子颜色为黑褐色.通过对菌落直径和透明圈直径之和与菌落直径比值(H/C)的计算,TZ-03的H/C值明显高于TP-02,分别为2.67和1.35.遗传稳定性实验结果如图3所示.由图3可知,10代以内TZ-03均能保持较为稳定的产酶能力,FPA酶活在5%之内波动,TZ-03的遗传稳定性良好.
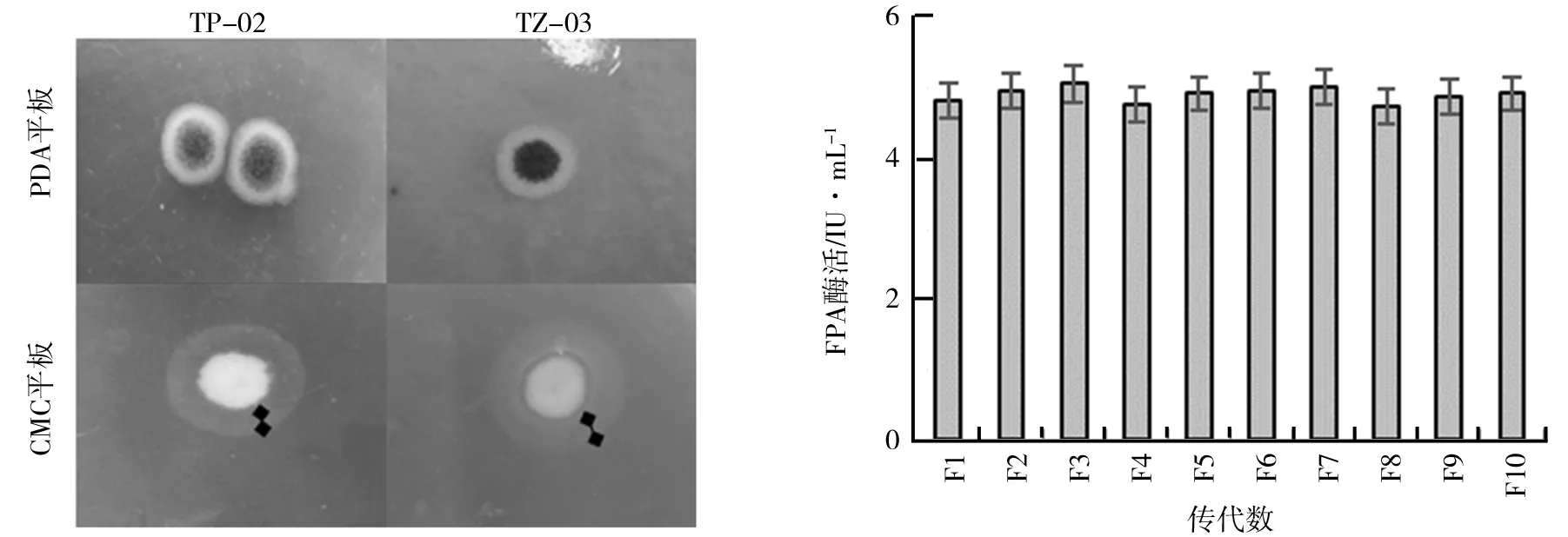
图2 TP-02与TZ-03的菌落形态及透明圈对比图 图3 TZ-03的遗传稳定性
2.2 培养基优化
(1)碳氮源优化.碳、氮源在微生物生长过程中提供营养物质及参与部分代谢产物的合成,对微生物的生长及产物合成具有重要作用.碳氮源优化对FPA酶活影响如图4所示.由图4a可知,碳源种类对纤维素酶酶活的影响较为显著,在以麸皮粉、稻草粉、微晶纤维素、CMC等纤维素类底物为碳源时,酶活相对较高.其中2%的微晶纤维素为碳源时TZ-03在108 h达到FPA酶活峰值6.72 IU/mL,较对照组(稻草粉)提高了26.7%.因此,选取微晶纤维素为最佳碳源.在确定最优碳源为微晶纤维素的基础上研究不同氮源对酶活的影响如图4b所示.由图4b可知,当以氯化铵、硫酸铵等无机氮源发酵时,FPA酶活只有2 IU/mL左右;当选用有机氮源发酵时,酶活明显高于无机氮源发酵.其中,酵母粉、鱼粉蛋白胨和胰蛋白胨的效果较好,当以鱼粉蛋白胨为氮源时,108 h时达到最高酶活8.21 IU/mL,这可能是因为有机氮源中含有维生素、生长因子或微量元素等能够促进菌体生长或者诱导产酶的物质.
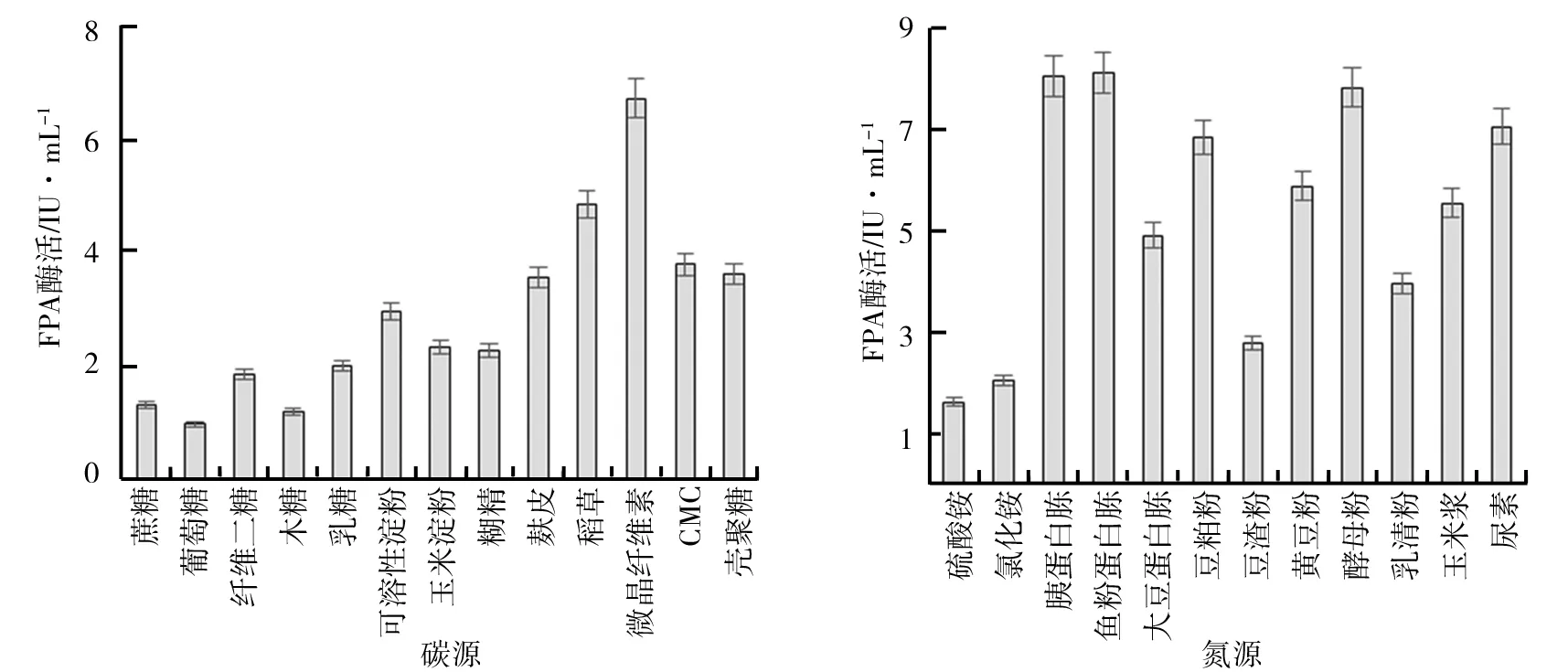
图4 碳氮源优化对FPA酶活影响
(2)氨基酸添加对酶活的影响.氨基酸类营养物质可透过细胞膜直接被微生物吸收,会对蛋白质的合成速度产生相应的影响,进而影响到这些蛋白质所承载的生理活性表现及相关代谢途径的调节[12].氨基酸添加对FPA酶活影响如图5所示.由图5可知,在培养基中添加一定量的色氨酸、酪氨酸、半胱氨酸和谷氨酰胺后,滤纸酶活提高明显,108 h时的FPA酶活分别为10.57 IU/mL、10.76 IU/mL、11.09 IU/mL和11.23 IU/mL.酶活的提高可能与纤维素酶的结构有关,当这些氨基酸加入后可能会对纤维素酶吸附结构域和谷氨酰胺-脯氨酸激活域等结构产生影响,从而可能提高底物表面有效酶的浓度或者纤维素酶激活蛋白的转录过程[13-14],最终提高了FPA的酶活.
2.3 摇瓶发酵产纤维素酶
通过以上培养基优化实验,确定最优发酵培养基:微晶纤维素20 g/L,鱼粉蛋白胨10 g/L,麸皮浸出汁2.5%,CaCl22 g/L,MgSO4·7H2O 4 g/L,KH2PO43 g/L,谷氨酰胺 1 g/L,PEG-4000 0.25 g/L,Tween 80 200 μL/L,微量元素液1 mL/L.
此条件下,TP-02和TZ-03的酶活均在108 h时达到最大值,TP-02与TZ-03的酶活比较如图6所示.由图6可知,TP-02的纤维素酶酶活中,EG酶活最高,为5.75 IU/mL,CBH酶活最低,为2.32 IU/mL.而突变之后,BG酶活最高,为24.10 IU/mL,CBH酶活最低,为9.7 IU/mL.BG具有将纤维二糖水解成葡萄糖的作用,虽然纤维二糖在纤维素酶的产生过程中有一定的诱导作用,但是过多的纤维二糖也会抑制EG和CBH的产生[15].诱变之后,BG酶活增加,可能减弱了纤维二糖对其他酶的抑制作用,从而使3种酶之间的比例更加合理,总酶活FPA酶活增加.
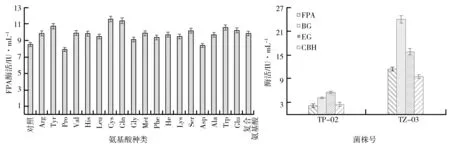
图5 氨基酸添加对FPA酶活影响 图6 TP-02与TZ-03的酶活比较
2.4 10 L发酵罐放大实验
以摇瓶优化最优条件进行10 L发酵罐直接放大实验,发酵过程参数如图7所示.由图7可知,0~12 h内,糖类物质大量被消耗,菌体利用糖类物质快速生长繁殖,此过程可能产生了大量的酸性物质使发酵液中的pH下降,12 h时,pH已达最低值3.7.此后可能由于部分酸性物质被菌体利用及菌体自溶,pH略有上升,36 h后维持在4.2左右.0~12 h内,溶氧量也一直在下降,在10 h时,溶氧下降到8.7%,并维持将近1 h.之后,溶氧逐渐上升,在66 h以后基本维持在80%左右.10 L发酵罐发酵酶活曲线如图8所示.由图8可知,FPA酶活在72 h达到峰值13.80 IU/mL,与摇瓶发酵的最高酶活11.58 IU/mL相比,上罐发酵酶活提高并不明显,这可能是发酵过程中的溶氧和pH的不合理导致.溶氧的供应对菌体的正常生长及代谢产酶均有重要影响,所以一般的生产过程控制溶氧在20%~30%[16],同时pH过低不仅不利于菌体生长,还会造成一部分纤维素酶酶活损失[17].因此对于溶氧和pH的控制可能是上罐发酵产酶的关键因素,此外,发酵后期发酵液中的糖类物质过低,只有0.5mg/mL,因此通过适当补料提高发酵液中糖的含量可能是提高酶活的又一手段.
如图7b可知,研究主要控制转速使溶氧维持在30%左右,同时通过氨水和磷酸的添加对发酵过程的pH进行调控,使其维持在4.8[18],在发酵24 h后通过补料使残糖含量维持在1.2 mg/mL左右.其结果如图8所示,FPA酶活在84 h达到峰值21.32 IU/mL,与摇瓶发酵相比提高了89.8%,时间缩短了近24 h,与不进行调控的上罐发酵相比,酶活也提高了54.5%.在此条件下CBH酶活于72 h达到最大值16.94 IU/mL,BG和EG酶活也在84 h达到峰值41.06 IU/mL和26.76 IU/mL.
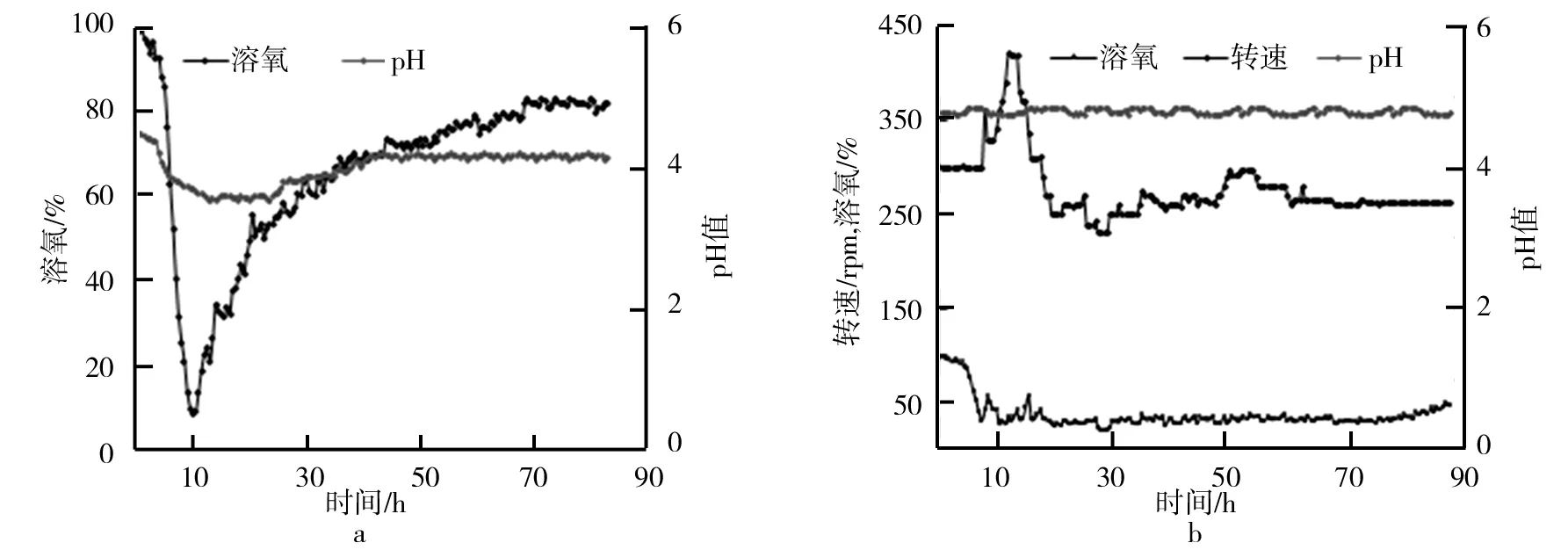
图7 发酵过程参数
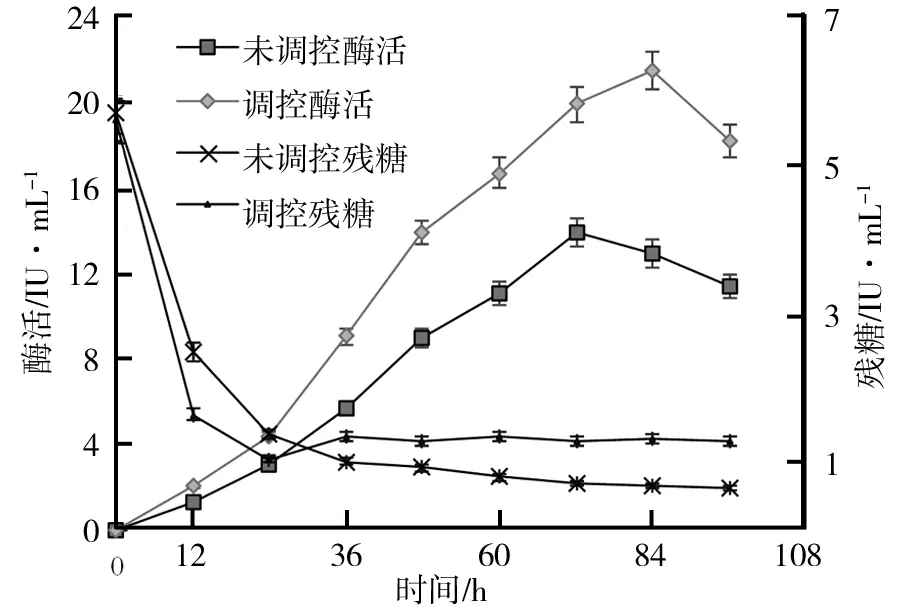
图8 10 L发酵罐发酵酶活曲线
3 讨论
目前,工业上的纤维素酶生产菌主要为里氏木霉、绿色木霉、黑曲霉等,而研究中所采用出发菌株匍枝根霉TP-02为实验室自主筛选所得,与常用纤维素酶生产菌株相比,具有产量高、发酵时间短等优势,因此提高其纤维素产量具有重要工业价值.当前对匍枝根霉纤维素酶的研究主要集中在分子层面,酶活提高的手段也多为优化其培养条件,并未从根本上提高菌株的产酶能力.以匍枝根霉TP-02为出发菌株,经紫外、EMS和复合诱变等手段筛选得到一株高产纤维素酶菌株TZ-03,其FPA最高酶活为4.96 IU/mL,较原菌提高37.8%.在此基础上进行发酵优化和10 L发酵罐放大实验,最终使其在以微晶纤维素为唯一碳源的培养基中FPA酶活84 h酶活达到峰值21.32 IU/mL,菌株产酶能力及产量均得到较大幅度提升.
此外,诱变还改变了纤维素酶酶系组成,TZ-03所产纤维素酶中BG酶活显著提高.在纤维素酶常见生产菌株中,除黑曲霉外,其他生产菌株如木霉等,其纤维素酶系组成中EG和CBH产量较高,而BG酶活则相比不足,BG具有将纤维二糖分解成葡萄糖从而解除纤维二糖大量积累对其他酶组分造成抑制的作用,其产量过低会影响纤维素酶的酶解效率.实验诱变选育所得TZ-03菌株BG产量较高,后续研究若能进一步对诱变后BG酶活提高的原因进行分析,则会为其他菌株的酶系组成优化提供一定的理论参考,从而为纤维素酶的大规模工业化应用奠定基础.
