人脐带间充质干细胞上清液对大鼠肝星状细胞生长的影响
2018-11-28汪文颖郝利铭黄可欣姜文华
汪文颖,郝利铭,尹 菲,黄可欣,姜文华
(吉林大学基础医学院 组胚教研室,吉林 长春130021)
随着国内外对干细胞研究的深入和技术的发展,间充质干细胞(mensenchymal stem cells,MSCs)因其来源丰富,取材方便、容易,免疫原性低,具有多向分化的潜能成为治疗肝纤维化的研究热点[1,2]。肝纤维化是慢性肝损伤的终末期,肝星状细胞(hepatic stellate cells,HSCs)激活后分泌大量胶原蛋白,造成细胞外基质的过度沉积而导致的肝损伤在肝纤维化的发展过程中起着关键作用。据相关研究[3,4]MSCs上清液含有干细胞分泌的相关因子[5],可以作为MSCs移植[6-8]的替代疗法。本文利用脐带来源的MSCs研究其上清液对大鼠肝星状细胞(HSC-T6)的影响及机制。
1 材料与方法
1.1 材料
见表1。

表1 实验细胞、试剂的来源
1.2 方法
1.2.1人脐带间充质干细胞( human umbilical cord mensenchymal stem cells,hUCMSCs)的纯化、扩增、冻存和复苏
脐带来源于吉林大学白求恩第一医院健康足月分娩的新生儿。本研究通过吉林大学伦理委员会审批,家属均签署知情同意书。按文献报道的方法[9]采用组织块贴壁法获得hUCMSCs,采用10%FBS+DMEM+双抗培养液在37℃,5%CO2条件下常规培养,0.25% 胰酶消化传代培养以纯化。冻存:消化细胞制备单细胞悬液, 1 000 rpm×3 min中 离心,弃上清,置于10%DMSO+20%FBS+DMEM 的冻存液中,直接放入顺序降温盒中,隔天放入液氮罐冻存。复苏:从液氮罐中取出冻存管,迅速移入37℃水浴锅轻轻摇动使其融化,移入离心管中添加适量PBS混匀,1 000 rpm×3min 离心,弃上清,添加5 ml培养液混匀,置于培养瓶中常规培养。并鉴定冻存、复苏对hUCMSCs的形态的影响。
1.2.2hUCMSCs上清液的提取
取第3、4 代hUCMSCs,计数2.4×105cell/5ml培养液/瓶,常规培养,培养3天后,收集液体,0.22 μm滤膜过滤后,2 000 rpm×5 min 低温离心,收集上清,-80℃保存。
1.2.3HSC-T6 细胞培养、传代、冻存及复苏
HSC-T6细胞培养在10%FBS+1%双抗+89%DMEM-H的培养液中,于37℃,5%CO2条件下常规培养。待细胞达到80%融合时,取对数生长期细胞用0.25%胰蛋白酶消化传代。 冻存和复苏方法同1.2.1。
1.2.4实验分组
实验取对数生长期HSC-T6细胞接种于培养板中,24 h后分为3 组,分别为对照组(10%FBS+1%双抗+89%DMEM-H)、25%hUCMSCs 上清液组(10%FBS+1%双抗+25%hUCMSCs上清液+64%DMEM-H)、50%hUCMSCs 上清液组(10%FBS+1%双抗+50%hUCMSCs上清液+39%DMEM-H)。
1.2.5hUCMSCs上清液对HSC-T6细胞形态的影响
将HSC-T6按2×104细胞/1 ml/孔,接种于24孔板中,按1.2.4中的实验分组,分别于培养0 h、24 h、48 h后,显微镜下观察其生长状态和形态变化。
1.2.6MTT检测hUCMSCs上清液对HSC-T6细胞增殖的影响
HSC-T6以4×104细胞/ml,每孔100 μl接种于96 孔板中。按2.4中的分组,设置4 个板,每组设6 复孔,分别用于检测细胞贴壁后培养12 h,24 h,36 h,48 h 的细胞增殖情况。 在达到培养时间前4 h进行MTT 检测。每孔加入5 g/L 的MTT 溶液20 μl,作用4 h后弃上清。每孔加入DMSO 溶液150 μl,溶解形成的甲臜结晶。作用10-20 min后,在分光光度计490 nm 波长下检测吸光值。以A490 下的吸光度值代表细胞的相对数量,反映细胞增殖情况。
1.2.7Annexin V-FITC/PI 双染检测hUCMSCs上清液对HSC-T6凋亡的影响
将HSC-T6按2×104细胞/1 ml/孔,接种于24孔板中,按1.2.4中的实验分组,培养48 h。
(1)各组细胞用不含EDTA 的胰酶消化后,300 g,4℃离心5 min 收集细胞。
(2)用预冷的PBS 洗涤细胞2 次,每次均需300 g,4℃离心5 min。收集1-5×105细胞。
(3)加入100 μl 1×Binding Buffer 重悬细胞。
(4)加入5 μl Annexin V-FITC 和5 μl PI Staining Solution,轻轻混匀。
(5)避光、室温反应10 min。
(6)加入400 μl 1×Binding Buffer,混匀。
(7)滴1滴用Annexin V-FITC/PI 双染的细胞悬液于载玻片上,盖上盖玻片。在荧光显微镜下用双色滤光片观察。Annexin V-FITC 荧光信号呈绿色,PI 荧光信号呈红色。
1.2.8免疫细胞化学检测hUCMSCs上清液对HSC-T6 细胞TGF-β1、α-SMA 表达的影响
HSC-T6以2×105细胞/ml/每孔接种于带有细胞载玻片的24孔板中,按1.2.4中分组情况,培养48 h后,取出载玻片,采用免疫组化SP染色方法,按说明书要求操作,进行TGF-β1、α-SMA抗体染色,TGF-β1的一抗稀释为1∶600、α-SMA的一抗稀释为1∶800,DAB显色。染色完成后显微镜下观察并分析TGF-β1、α-SMA的阳性表达情况。
1.2.9统计学分析
采用SPSS19.0 软件计算每组数据的均值和方差,所得结果均采用平均值±标准差(means±SD)表示,采用t检验进行统计学分析,当P<0.05时表示差异具有统计学意义。
2 结果
2.1 组织块贴壁法培养hUCMSCs 细胞的形态
组织块贴壁后1周可见散在、贴壁生长的细胞集落。原代细胞培养需10-14 d,传代后在3-5 d细胞需再次传代,细胞低密度时长成扁平单层细胞,细胞生长密度增加趋于融合时,细胞形态变得细长,形态类似成纤维细胞,呈平行排列生长或旋涡状生长,冻存复苏后细胞形态和生长状况稳定(图1)。按照课题组已发表的论文鉴定为MSCs[10,11]。
2.2 hUCMSCs上清液对HSC-T6 细胞形态的影响
对照组HSC-T6细胞贴壁生长、呈星形或多边形伸展状态,胞内含大量颗粒;随着培养时间的延长,细胞数量明显增加。(见图2 A1、 A2、A3);25%hUCMSCs上清液组HSC-T6细胞,随着培养时间的延长,细胞突起减少,细胞数目减少(见图2 B1、B2、B3);50%hUCMSCs上清液组在24 h、48 h与0 h对比发现细胞形态更加不规则,细胞体积减小、突起减少明显,细胞数量明显减少 (见图2 C1、C2、C3)。
2.3 hUCMSCs上清液对HSC-T6 细胞增殖的影响
MTT结果分析显示(表1),12 h时3组细胞数量无明显差异(P>0.05)。培养24 h后,25% hUCMSCs上清液组、50% hUCMSCs上清液组HSC-T6 细胞的增殖受到抑制,与对照组相比,均差异显著(P<0.05);培养36 h后,25% hUCMSCs上清液组、50% hUCMSCs上清液组与对照组相比,HSC-T6 细胞的增殖明显受到抑制,差异显著(P<0.05);培养48 h后,25%hUCMSCs上清液组与对照组相比差异显著(P<0.05),50%hUCMSCs上清液组和对照组相比差异性极其显著(P<0.001),25%hUCMSCs上清液组和50%hUCMSCs上清液组相比差异性极其显著(P<0.001)。

A:传代培养24 h的 hUCMSCs B:传代培养48 h的hUCMSCsC:传代培养72 h 的hUCMSCs D:复苏后培养96 h的hUCMSCs
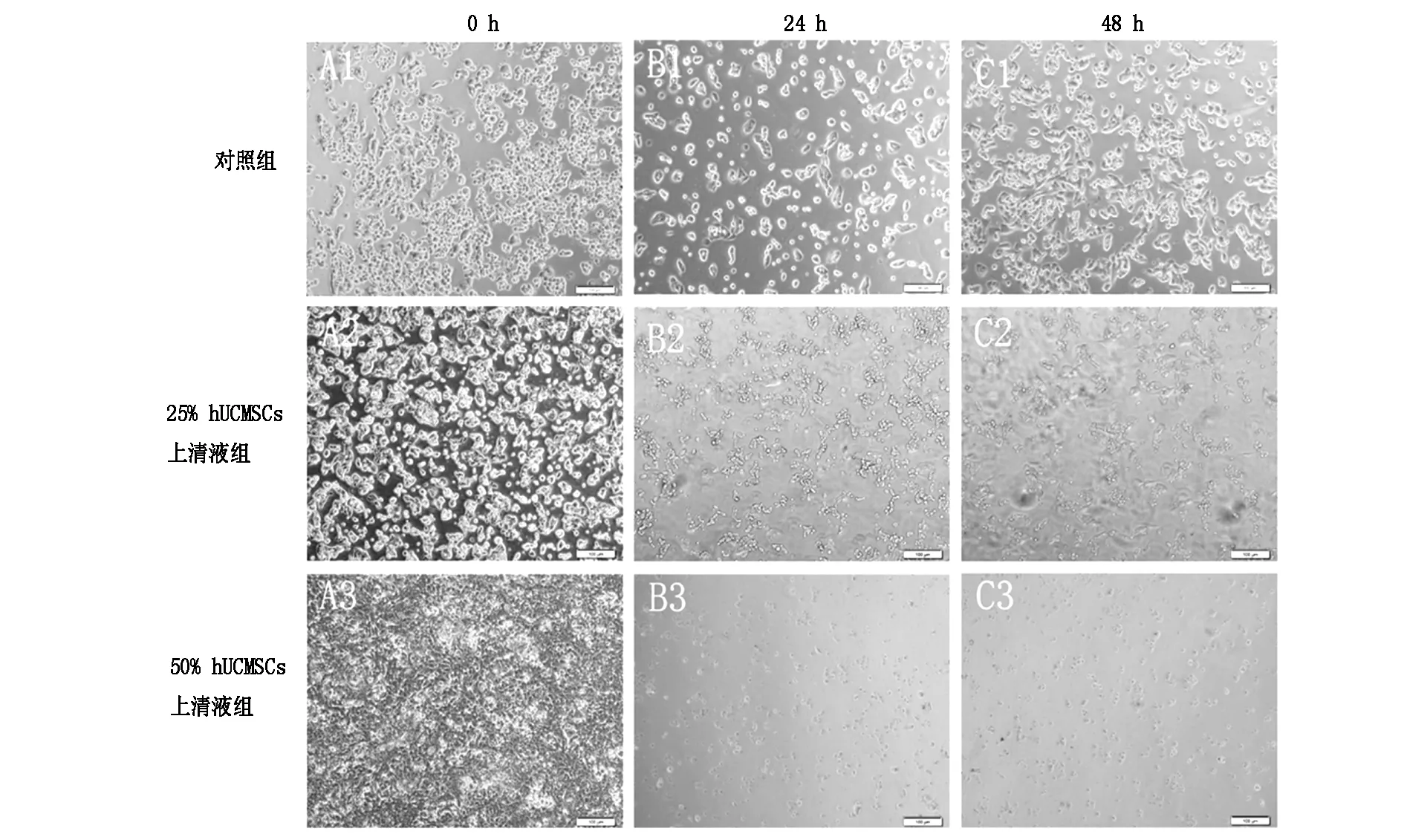
A1、A2、A3分别为对照组0 h、24 h、48 h;B1、B2、B3分别为25% hUCMSCs上清液组0 h、24 h、48 h;C1、C2、C3分别为50% hUCMSCs上清液组0 h、24 h、48 h
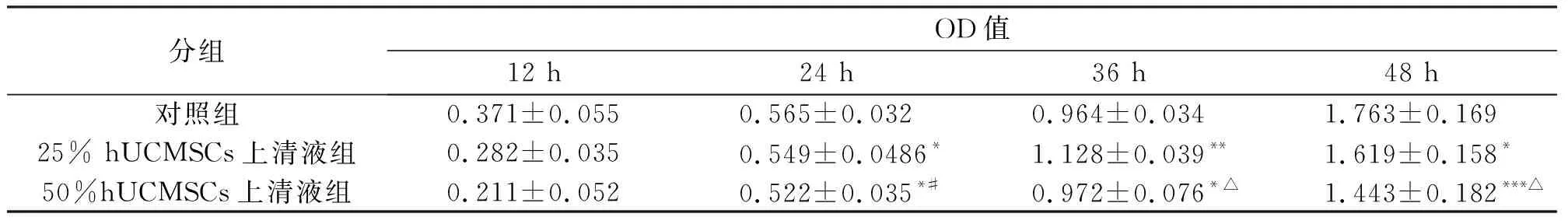
图2 hUCMSCs上清液对HSC-T6 细胞形态的影响
*:与对照组比较P<0.05;**:与对照组比较P<0.01;***:与对照组比较P<0.001;#:与25% hUCMSCs上清液组比较P<0.05;△:与25% hUCMSCs上清液组比较P<0.001。
2.4 hUCMSCs上清液对HSC-T6 细胞凋亡的影响
Annexin V-FITC/PI 双染显示绿色、红色荧光的细胞分别为早期、晚期凋亡细胞。对照组HSC-T6 细胞绿色荧光、红色荧光的细胞较少(图3 A、B、C)。 25%hUCMSCs上清液组、50%hUCMSCs上清液组凋亡的细胞数量均增多(图3D、E、F、 G、H、I),凋亡细胞百分率与对照组相比,均明显增加(图3J),差异显著(P<0.01)。
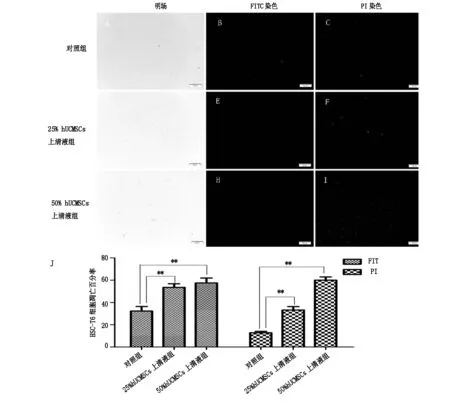
A、B、C 为对照组;D、E、F为25% hUCMSCs上清液组;G、H、I为50% hUCMSCs上清液组 J为3组凋亡细胞百分率对比图**:与对照组相比P<0.01
图3AnnexinV-FITC/PI双染检测hUCMSCs上清液对HSC-T6细胞凋亡的影响
2.5 hUCMSCs上清液对HSC-T6 细胞中TGF-β1、α-SMA 表达的影响
TGF-β1和α-SMA的阳性表达均表达在HSC-T6 细胞胞浆内,DAB显为黄色。25%hUCMSCs上清液组(见图4B)、50%hUCMSCs上清液组(见图4C)和对照组(见图4A)相比,25%hUCMSCs上清液组TGF-β1的阳性表达减少,但无显著性差异(P>0.05), 50%hUCMSCs上清液组TGF-β1的阳性表达明显减少,差异显著(P<0.05)(见图4H); 25%hUCMSCs上清液组(图4E)、50%hUCMSCs上清液组(图4F)和对照组(图4D)相比,25%hUCMSCs上清液组α-SMA的阳性表达减少,但无显著性差异(P>0.05),50%hUCMSCs上清液组α-SMA的阳性表达明显明显减少,差异显著(P<0.05)(见图4H)。
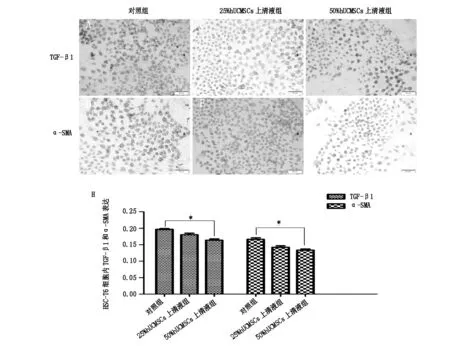
A为对照组TGF-β1;B为25%hUCMSCs上清液组TGF-β1;C为50%hUCMSCs上清液组TGF-β1 D为对照组α-SMA;E为25%hUCMSCs上清液组α-SMA;F为25%hUCMSCs上清液组α-SMA;H为3组平均光密度对比图*:与对照组比较P<0.05
图4hUCMSCs上清液对HSC-T6细胞中TGF-β1、α-SMA表达的影响
3 讨论
肝纤维化[12,13]是由各种致病因素引起肝细胞变性、坏死,导致炎症反应,刺激纤维组织异常增生而形成的病理过程,我国是世界上慢性肝病发病率最高的地区之一,目前慢性肝病的治疗缺乏有效措施,因而急需研究和探索新的肝病治疗技术[14,15]。
目前研究表明,肝纤维化过程是可逆的[16,17],肝星状细胞的异常激活并导致细胞外基质在肝内过量积聚是肝纤维化发生的中心环节[18,19]。抑制肝星状细胞的增殖或促进其凋亡,抑制其分泌细胞外基质或促进细胞外基质降解,是阻止或逆转肝纤维化进程的关键[20-22]。
本研究通过组织块贴壁法获得的细胞,经形态学、表面抗原、分化能力等鉴定为间充质干细胞,可常规冻存、复苏。通过hUCMSCs上清液与HSC-T6共培养的方法检测hUCMSCs上清液对HSC-T6细胞的影响,MTT结果表明,hUCMSCs上清抑制HSC-T6的增殖,且与hUCMSCs上清液的浓度与时间成正比。Annexin V-FITC/PI 双染方法检测表明,hUCMSCs上清液促进HSC-T6 细胞凋亡,且hUCMSCs上清的浓度越高,HSC-T6 细胞凋亡比率越高。这表明,hUCMSCs上清液可明显抑制HSC-T6 细胞的生长。
在此过程中,hUCMSCs上清液是否可抑制肝星状细胞的激活?α-SMA是肝星状细胞活化的标志蛋白,为此,本研究检测了HSC-T6 细胞α-SMA的表达。免疫组化结果显示,50%hUCMSCs组α-SMA 的表达明显降低,这表明,hUCMSCs上清液可抑制HSC-T6 细胞的活化。
TGF-β1是炎症条件下诱导肝星状细胞活化的重要信号分子,TGF-β1激活后,能够快速与肝星状细胞表面的受体相结合,导致肝星状细胞激活,在TGF-β1持续刺激下造成细胞外基质(如胶原纤维)的大量合成[12],形成肝纤维化。hUCMSCs上清液抑制肝星状细胞活化的作用机制是否与其能抑制TGF-β1的表达相关?为此,本研究检测了hUCMSCs上清液对HSC-T6 细胞TGF-β1表达的影响。免疫组化结果显示,50%hUCMSCs上清液组HSC-T6 细胞TGF-β1的表达较对照组明显降低,这表明,hUCMSCs上清液可明显抑制HSC-T6 细胞TGF-β1的表达。
上述结果表明,一方面,hUCMSCs上清液能够抑制HSC-T6 细胞的生长、促进其凋亡,使活化的肝星状细胞数量下降;另一方面,hUCMSCs上清液能够抑制TGF-β1在活化的肝星状细胞的表达,则抑制了TGF-β1 与肝星状细胞表面的受体相结合,导致活化的肝星状细胞合成细胞外基质的能力下降。hUCMSCs上清液通过上述两方面的作用,抑制了HSC-T6细胞的生长。
