单细胞测序发现内毛细胞活动诱导I型螺旋神经节分为三型
2018-11-23林珊珊汪琪璇摘译黄治物审校浙江中医药大学医学技术学院听力与言语康复系杭州30053上海交通大学医学院耳科学研究所上海市耳鼻疾病转化医学重点实验室
/林珊珊 汪琪璇摘译 黄治物审校/ 浙江中医药大学医学技术学院听力与言语康复系(杭州 30053); 上海交通大学医学院耳科学研究所,上海市耳鼻疾病转化医学重点实验室
采用单细胞RNA测序的方法,Shrestha及其同事发现(图1):①内耳I型螺旋神经节神经元可分为三种亚型;②各个亚型之间以及频率响应轴不同区域的分子表达存在显著差异;③各个亚型的分化从出生后开始,依赖正常内毛细胞活动的诱导。
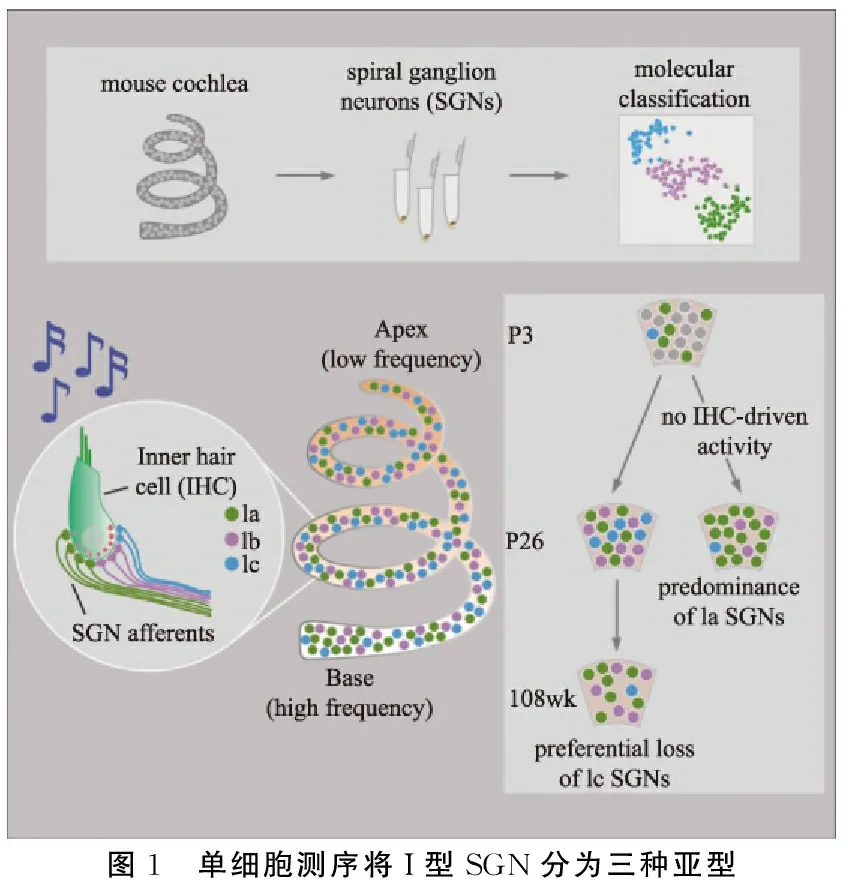
图1 单细胞测序将I型SGN分为三种亚型
1 介绍
神经系统具有异质性的特征,通常可根据神经元的位置、功能和形态等来区分不同类型的神经元,它们构成特定功能的神经信号网络。在听觉神经系统中,I型螺旋神经节神经元(spiral ganglion neurons, SGNs)是与内毛细胞(inner hair cells, IHCs)相连的双极细胞,具有声音编码能力,能够将复杂的声学信息传递到听觉脑干。早在50年前,就有学者通过猫听神经中的单纤维记录发现I型SGNs对声音的敏感性和自发放电率(spontaneous firing rate, SR)不同,Liberman等学者根据神经兴奋性阈值与SR之间的关系,将它们分为三组:低SR、中SR和高SR的I型SGNs,三种类型的SGNs分别沿IHCs胞底外侧的不同位置形成突触,并投射到脑干内的不同细胞。这种微观结构和电生理特征的异质性使耳蜗能够编码宽范围的声音强度,并有助于维持嘈杂环境下的听力,但其本质和根源尚不清楚。
事实上,已有研究提示SGNs可能存在分子异质性,不同类型的SGNs可能表达不同的受体和离子通道。然而对于形态、位置、功能相似的各亚型SGNs,尚缺乏对亚型特异分子标志的认知,限制了我们对各亚型的功能及其潜在选择易感性的研究。因此,想要明晰SGNs主动调节听觉信号编码的方式,必须全面认识其分子图谱。
在最近的一项研究中,Shrestha、Liberman 等学者首次对内耳SGNs采用基于高通量单细胞转录组测序的方法(single-cell RNA sequencing, scRNA-seq)来研究I型SGNs的亚型分类及其相关特性。该研究发现了三种分子表达特征截然不同的亚型(Ia、Ib和Ic),分别与高、中、低SR的SGNs的解剖学位置对应匹配,且其沿着内耳基底膜频率响应轴的分布存在差异。他们还发现,I型SGNs的分型是随听觉发育逐渐形成的,其分化需要IHCs活动的促进。这项对SGNs异质性的通观揭示了直接影响听觉信息编码的内源性差异,强调了在发育过程中听觉活动对异质性形成的重要性,重点提示了年龄相关性听力损失和先天性听力损失影响SGNs的组成。
2 首次将单细胞测序用于内耳SGNs分子学研究的成果
2.1细胞RNA测序明确I型和II型SGNs之间存在明显分子表达差异 为了确定采用scRNA-seq 研究SGNs异质性方法的准确性,该研究首先分别收集了P25-P27小鼠耳蜗基底膜底回、中回和顶回的SGNs(共11只小鼠,186个SGNs)进行scRNA-seq,根据其分子表达特征,通过t-分布邻域嵌入算法(t-SNE)将其分为若干不同的细胞亚群。研究观察到I型和II型SGNs(二者在解剖学特征、髓鞘形成和突触数目等方面有明显的差异)被分为两个分子表达各异的亚群,各占实验样本的96%和4%,接近组织学比例,且分别富含已知的I型和II型SGNs分子标记Epha4 和Th。采用半定量RNA原位检测方法RNA scope验证了scRNA-seq检测到异质性是真实的差异,证实了转录组图谱可用于构建SGNs的亚型的分子框架。
此外,研究还发现了I型和II型SGNs在1 700余个基因表达水平上存在显著差异(P<0.01),其中335个基因表现为二元有/无(定义表达细胞>70%为有,表达细胞<20% 为无)表达,表达谱差异的前50个基因富集于突触前囊泡相关蛋白见图2。

图 2 I型和II型SGNs间的差异表达基因
2.2I型SGNs的三种分子学亚型 该研究聚焦于表达Epha4+Th-的I型SGNs,其在t-SNE中显示为三个细胞亚群,与主成分分析、分级聚类分析法等多种统计学方法得出的分型一致,提示I型SGNs可分为三种亚型,即Ia、Ib和Ic型,分别占35%、40%和25%。共有425个基因在Ia、Ib和Ic型 SGNs之间显著差异表达(P<0.01),前100个基因见图3。GO分析显示亚型间差异表达的基因富集于调控神经元分化、连接和生理功能,如“钾通道活性”、“钙离子结合”、“信号传导活性”、“神经元分化”、“离子转运调节”和“轴突发育”等过程,编码“突触”、"阳离子通道复合体"和"质膜"蛋白质的基因过度表达,同时多个转录因子表达差异的组合进一步表明I型SGNs各个亚型内不同基因群的表达可能影响其分化。
由此可见,SGNs各亚型分子表达特征的差异具有明显的生理学意义,一些突触传递、神经生理相关蛋白及其家族蛋白的表达具有显著的亚型特异性。例如,Ia、Ib和Ic型SGNs的神经递质受体表达差异较大,谷氨酸受体亚基Grik4 从Ia到Ic的表达呈梯度递增,而代谢型受体亚基Grm8仅在Ic型SGNs中特异性表达。Ia型SGNs富含胆碱能受体亚基Chrna1和Chrna4,而Ic型SGNs富含多巴胺受体亚基Drd1。在离子通道方面,编码钾离子通道亚基的基因中,Kcnq4和Kcnd2主要存在于Ia和Ib型SGNs中,而Ib和Ic型SGNs富含Kcnip2和Kcnj9表达。Ia型SGNs富含电压门控钙离子通道Cacna1b、Cacna1h和Cacna2d1亚基表达。漏钠通道Nalcn的表达局限于Ib和Ic型SGNs,而电压门控钠离子通道的Scn2b亚基从Ic到Ia型SGNs的表达梯度递减。总之,以上发现表明,三种分子学定义的I型SGNs亚群构成了生理功能不同的亚型。
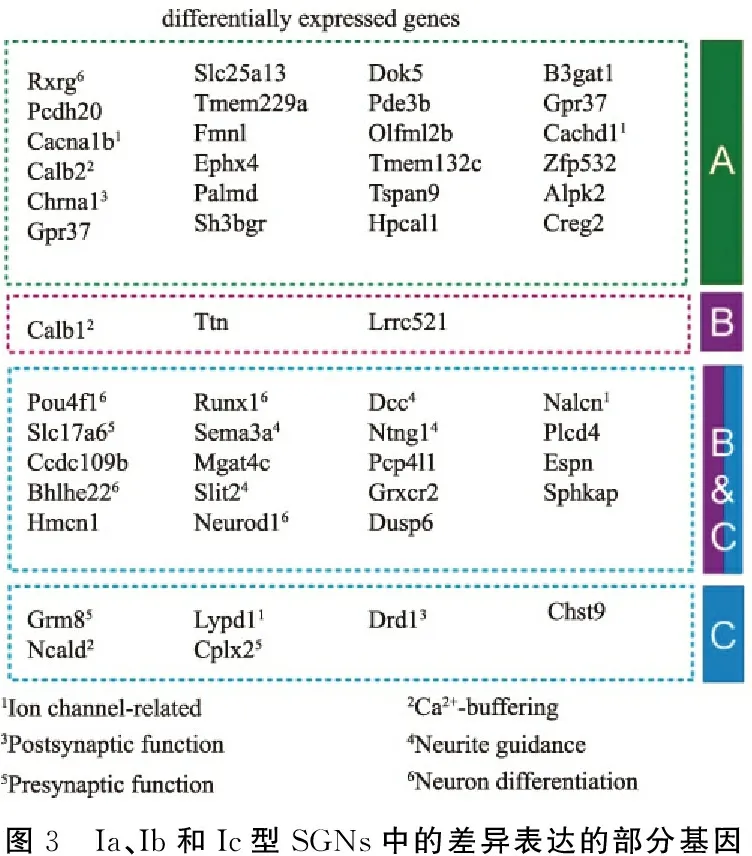
图3 Ia、Ib和Ic型SGNs中的差异表达的部分基因
2.3I型SGNs的频率响应区差异性 为进一步研究I型SGNs异质性的来源,该研究分别对耳蜗底回、中回和顶回三个区域的SGNs进行scRNA-seq,发现其基因表达存在频率响应区域的差异性。三个区域的I型SGNs间存在114个差异表达的基因,而不同亚型之间有425个基因差异表达。与驱动Ia、Ib和Ic分型的基因不同,区域富集的基因主要呈梯度表达,例如编码钾离子通道亚基Kv9.3的Kcns3表达量在顶回最高,其次在中回,在底回最低。而一些基因沿频率响应轴的表达差异还具有亚型特异性。例如,编码轴突导向分子Ephrin A1的EFNA1基因在Ib型SGNs中,在中回和底回的表达水平高于顶回,而在Ia和Ic型SGNs中仅在底回富集。Kcnip2和Cpne6在Ib和Ic型SGNs中均从顶回-底回呈梯度上升表达,在Ia型SGNs中则仅在底回富集。编码电压门控钙离子通道亚基的Cacng5表达模式更加复杂,其在Ic型SGNs中从顶回-底回呈梯度下降,在Ia型SGNs中仅从顶回-中回呈梯度下降,而在Ib型SGNs中表达相对均匀。总之,该研究通过对频率响应轴各型SGNs的分析,发现了分别在Ia、Ib和Ic型SGNs中具有频率响应区域差异的184、157和183个基因,在这524个基因中,有494个是特异的。因此,对各个亚型的scRNA-seq数据分析揭示了SGNs频率响应区差异性的一个新层面。
此外,耳蜗三个区域中SGNs亚型的比例也存在不同。在中回分别有33%Ia、45%Ib、22%Ic型SGNs;顶回与之相似(31%Ia,43%Ib和26%Ic型SGNs),而底回的Ia型SGNs比例相对较高(46%),Ib型SGNs较少(24%)。因此,SGNs亚型组织水平分布的差异叠加于基因表达梯度,形成频率响应特征。
2.4SGNs的三种分子学分型与传统分型的解剖和形态差异匹配 早年已有研究表明三种SR特性的SGNs存在突触大小的差异和空间分离投射。该研究以在Ia、Ib和Ic型SGNs中差异表达的钙结合蛋白 CALB2为分子标记,发现低表达CALB2的Ic型SGNs轴突更接近前庭阶(scala vestibule, SV),并与IHCs的蜗轴侧形成大的带状突触。相反,高表达CALB2的Ia型SGNs轴突纤维更接近鼓阶(scala tympani, ST),与IHCs的柱状细胞形成小的带状突触。具有中等CALB2表达水平的Ib型SGNs位于中间,与IHCs形成中等大小的带状突触。证实了通过分子差异分型的Ia、Ib和Ic型SGNs纤维位置、突触位置和突触形态,分别与高、中和低SR亚型SGNs的特征相匹配,见图4。
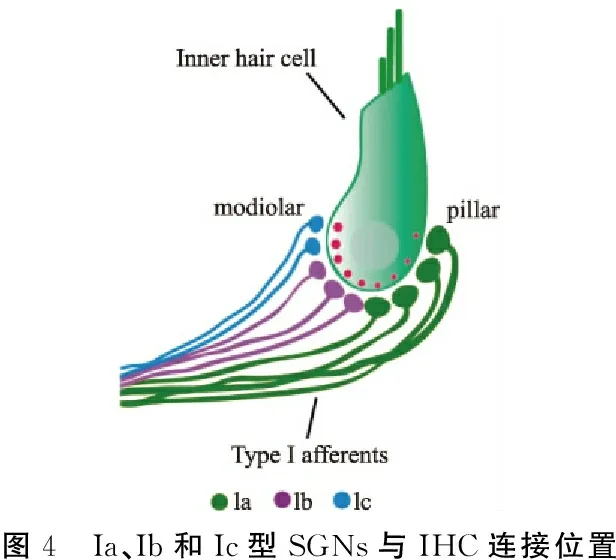
图4 Ia、Ib和Ic型SGNs与IHC连接位置
2.5Ic型SGNs对年龄相关有选择易感性 早年的研究表明,SGNs随着衰老逐渐丢失,其中低SR的SGNs纤维受影响最大。该研究则通过分子标记的方法(以Calb2和Lypd1的表达来确定分型)分别评估了32、64和108周龄小鼠的Ia、Ib和Ic型SGNs数量,发现总SGNs密度随着年龄的增长而下降,且只有Ic型SGNs表现出相似的下降趋势,从32周时的30%下降到64周时的20%,并且在108周时进一步降至11%。而Ia和Ib型SGNs比例相对上升,表明Ic型SGNs对年龄相关性听力损失有选择易感性,与此前的研究进一步对应。
2.6SGNs亚型特征在出生时出现并在出生后的第一周内完善 通常,神经元在有丝分裂后即表现出特性,并受到神经功能环路活动的调控。在小鼠耳蜗中,I型和II型SGNs在胚胎第16.5天(E16.5)即表现出不同的解剖学特征。相比之下,I型SGNs的亚型差异在出生后、周围突到达IHCs之后才能被检测到,而IHCs-SGNs间突触形态直到出生后第4周才完全成熟。
该研究借助亚型特异标记物进一步研究了SGNs分型的时间进程,他们发现SGNs在围产期开始出现差异,并在出生后第一周内细化分型。Ia型SGNs标记物Calb2和Ic型SGNs标记物Lypd1在胚胎晚期阶段(E18.5)和出生时耳蜗的表达较均一,还无法区分SGNs的亚型。到出生后第3天(P3),一小部分细胞表现出Calb2和Lypd1的互斥表达,出生后第7天(P7)耳蜗SGNs差异表达Calb2和Lypd1的梯度更加明显,低表达Calb2的神经元表达了高水平的Lypd1。在出生后第26天(P26)时,90%的SGNs表现为 Calb2和Lypd1互斥表达。这表明SGNs在出生时表达的分子广泛重叠,出生后某些分子表达开始受到限制,第一周后出现了类似成年SGNs各亚型互斥表达的分子标志,逐渐形成了各亚型SGNs。
2.7IHCs突触传递信号是出生后SGNs分型的必要条件 小鼠在出生后第12天左右开始对气导声音信号产生反应,耳蜗功能发育完善则持续到出生后第3周。在此期间,IHCs释放谷氨酸神经递质诱发SGNs产生动作电位。为了解这些突触信号联系是否影响SGNs形成内在差异,该研究首先对IHCs到SGNs谷氨酸传递缺失的成年小鼠(Vglut3-/-)进行了scRNA-seq,发现其SGNs只能被分成两群,80%的细胞主要表达Ia型SGNs的标记(如Calb2),20%的细胞主要表达Ib型SGNs的标记(Ntng1,Pou4f1)和极低水平Ic型SGNs标记(Lypd1,Grm8)。为明确Vglut3-/-小鼠SGNs的异常分型在何时出现,他们进一步分析了耳蜗早期发育阶段SGNs各亚型特异标志物的表达。在出生后第3天,Vglut3-/-小鼠SGNs表达标志分子与野生型相似,表明SGNs分型的初始不依赖于IHCs的活动。然而从出生后第8天至第4周,Vglut3-/-小鼠中表达Ic型SGNs标记物Lypd1+的细胞比例逐渐降低,表达Ia型SGNs的标记Calb2+的SGNs比例增加,在出生后第27天时最显著,见图5。
以上结果表明, SGNs在出生后逐渐分成各亚型的过程需要IHCs活动的诱导,出生后一周内IHCs活动若受损,将导致SGNs分型异常,并持续至成年。
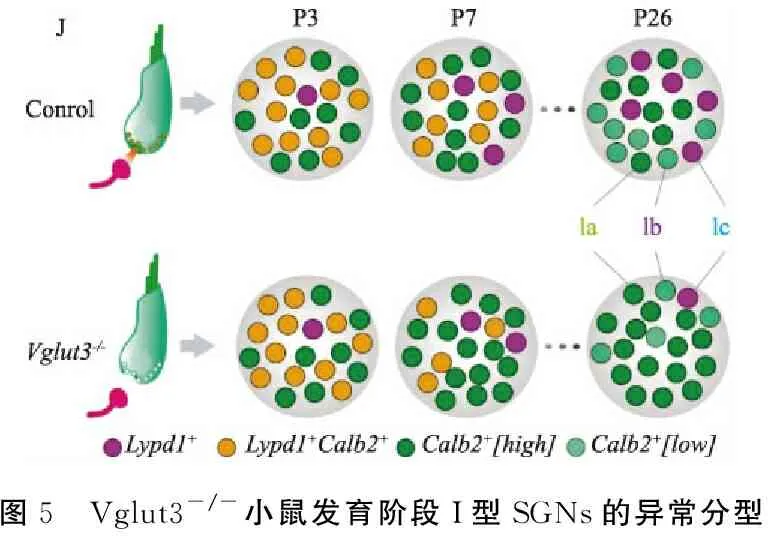
图5 Vglut3-/-小鼠发育阶段I型SGNs的异常分型
3 对疾病认识和治疗的意义及展望
Vglut3的突变是人类DFNA25耳聋的基础。该研究证明了SGNs的分型依赖于出生后早期IHCs的正常活动,这可能是某些类型的先天性耳聋--尤其是听力发生前即出现SGNs功能受损的致病机制。这提示我们在评估与致聋突变相关的主要细胞(如IHCs)时,还应注意包括SGNs在内的细胞异常。该研究还尝试回答了一个重要的问题,即如果对IHCs缺陷的先天性耳聋进行基因治疗恢复其功能,是否能够挽救相关的SGNs损伤表型。在某种程度上,这取决于SGNs分型的可塑性,尤其是其在成年之后是否还能受IHCs活动的诱导。未来的研究或许可以直接以SGNs为靶点,通过在听觉发育期,甚至是成年后重构其各个亚型的比例,探究SGNs相关治疗的新途径。
(摘译自:Shrestha BR, Chia C, Wu L, et al.Sensory neuron diversity in the inner ear is shaped by activity[J].Cell,2018,174:1229.)
