游离脂肪酸与子痫前期和妊娠期糖尿病发生的相关性
2018-11-15张瑞晴徐先明张佳荣
张瑞晴,徐先明,张佳荣
上海交通大学附属第一人民医院妇产科,上海 200020
子痫前期和妊娠期糖尿病(gestational diabetes mellitus, GDM)是妊娠期常见的并发症。子痫前期和GDM会增加母亲和子代心血管疾病的发生风险[1]。为了维持胎儿的正常发育和自身的能量代谢,孕妇机体对脂肪的吸收能力明显增强,形成生理性高血脂。高脂血症特别是高三酰甘油(triglyceride, TG)血症是代谢综合征的危险因素。而子痫前期或GDM孕妇TG水平较正常妊娠孕妇TG水平升高[2-3]。
游离脂肪酸(free fatty acids, FFA)是TG的代谢产物。与TG、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)相比,FFA可以更敏感且更早地反映脂质代谢功能障碍。研究[4]表明,循环FFA是葡萄糖代谢的关键调节因子,在子痫前期和GDM患者中增加。因此,本研究进一步分析了妊娠期妇女FFA水平与子痫前期和(或)GDM的关系。
1 资料与方法
1.1 一般资料 选择2016年1月1日至12月31日在上海交通大学附属第一人民医院分娩的孕妇2 435例。其中417例患有子痫前期和(或)GDM(观察组),包括子痫前期患者60例,GDM患者347例,子痫前期合并GDM患者10例;另选2 018例正常生产妊娠孕妇作为对照组。排除标准:(1)多胎妊娠;(2)妊娠前患有糖尿病、高血压、甲状腺疾病或心血管疾病;(3)使用辅助生殖技术。本研究经医院伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 诊断标准 GDM的诊断参考2014年我国《妊娠合并糖尿病诊治指南》标准,即有以下任意1项或多项表现:(1)空腹血糖>5.1 mmol/L;(2)口服75 g葡萄糖后1 h血糖>10.0 mmol/L;(3)口服75 g葡萄糖后2 h血糖>8.5 mmol/L。子痫前期的诊断参考第8版《妇产科学》,即孕20周后出现收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg伴尿蛋白≥0.3 g/24 h,或随机尿蛋白(+)。
1.3 检测指标及方法 各组孕妇在空腹12 h后,于清晨抽取静脉血。用酶法检测血脂代谢水平,包括总胆固醇(total cholesterol,TC)、TG、HDL-C、LDL-C、FFA,由Olympus AU640型全自动生化分析仪完成。
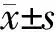
2 结 果
2.1 两组孕妇和胎儿基本临床特征的比较 结果(表1)显示:观察组孕妇年龄、孕前BMI均大于对照组(P<0.001);观察组胎儿的出生体质量低于对照组(P<0.05)。
2.2 两组孕妇脂代谢指标水平的比较 结果(表2)表明:观察组TG和FFA水平高于对照组(P<0.01);观察组HDL-C和LDL-C水平低于对照组(P<0.05);两组TC水平差异无统计学意义。

表1 两组孕妇和胎儿基本临床特征的比较
BMI:体质指数

表2 两组孕妇脂代谢相关指标水平比较 cB/ (mmol·L-1)
TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;FFA:游离脂肪酸
2.3 子痫前期和(或)GDM的脂代谢异常影响因素多元logistic回归分析 结果(表3)表明:孕晚期TG水平升高是子痫前期发生的危险因素(P=0.012);TG水平升高是GDM发生的危险因素(P<0.001);孕晚期FFA水平升高是子痫前期、GDM、子痫前期合并GDM发生的危险因素(P<0.01)。TC、HDL-C、LDL-C水平升高是GDM的保护因素(P<0.05)。

表3 多元logistic回归分析子痫前期和(或)妊娠期糖尿病的预测因素 cB/ (mmol·L-1)
TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;FFA:游离脂肪酸;GDM:妊娠期糖尿病
2.4 FFA预测子痫前期和(或)GDM的临床价值 ROC曲线(图1)示:血清FFA预测子痫前期和(或)GDM的曲线下面积(AUC)为0.591;以血清FFA<0.435 mmol/L为截断点,其敏感度为65.50%、特异度为49.60%(P<0.001)。

图1 FFA预测子痫前期和(或)GDM的ROC曲线
3 讨 论
妊娠期伴随糖、蛋白、脂肪的摄入量增加,孕妇体内营养物质的代谢水平也发生了变化。其中,脂代谢异常与妊娠期并发症有关。人体摄取含脂肪的食物后,TG在肠腔中脂解成FFA和单酰甘油,并通过被动扩散被肠细胞吸收[5]。脂蛋白脂肪酶(lipoprotein lipase, LPL)是循环中TG分解的主要酶,并且在需要大量FFA的组织中表达,如心脏、骨骼肌和脂肪组织。从乳糜微粒和极低密度脂蛋白释放的FFA的量取决于胰岛素刺激的LPL的活性[6]。由此可见,胰岛素是FFA动员的调节因子,胰岛素抵抗对TG和FFA代谢有重要影响。
GDM是以胰岛素抵抗和β细胞受损为特点。Wang等[7]发现,胰岛素抵抗和氧化应激反应是导致高TG和低HDL的主要原因,尤其是在GDM患者中;TG/HDL比值与GDM患病率有明显相关性。本研究显示,TG水平升高会增加GDM的风险,而HDL-C和LDL-C是GDM的保护因素,与既往研究相似。研究[8]发现,妊娠期高血压和GDM患者孕早期血清中的TC和LDL-C浓度均较高,而在孕中晚期下降。本研究中,孕晚期子痫前期和(或)GDM的患者血清中LDL-C水平低于对照组(P=0.01),而TC在观察组和对照组间差异无统计学意义。TC在孕晚期子痫前期和(或)GDM的患者中的变化还有待进一步研究。
子痫前期的主要发病机制是内皮细胞的激活和损伤,而脂质过氧化物和炎性细胞因子是导致内皮损伤的主要原因。Gallos等[9]发现,高三酰甘油血症与子痫前期有关,且发生于子痫前期之前,认为TG可能参与子痫前期发生。本研究发现,调整孕妇年龄、孕前BMI和采血时孕周后,TG浓度使子痫前期发生风险增加了1.21倍。
FFA作为TG的产物,也会增加子痫前期和GDM患病及子痫前期合并GDM患病的风险。本研究中,子痫前期和(或)GDM患者血清中FFA水平明显高于对照组(P=0.002)。研究[10]表明,GDM患者血清中FFA水平与胰岛素敏感性负相关。FFA还可以通过抑制外周葡萄糖的利用和促进糖异生以诱导胰岛素抵抗来促进子痫前期的发展[11]。上述研究表明,妊娠期胰岛素抵抗与孕期子痫前期和(或)GDM具有一定的相关性。
综上所述,脂代谢异常可促进子痫前期和(或)GDM发生率,其中孕晚期FFA的升高与子痫前期、GDM和子痫前期合并GDM风险的增加密切相关。通过对血脂代谢的研究及发现、干预、治疗,将血脂控制在适当范围内,可以降低母胎并发症的发生率。
