糖尿病合并腔隙性脑梗死患者血清铁蛋白和β2微球蛋白的检测意义
2018-11-15李晓艳尹世杰
李晓艳, 张 乐, 李 彬, 姜 丹*, 尹世杰
1.安徽省第二人民医院神经内科,合肥 230041 2.安徽医科大学第一附属医院神经内科,合肥 230000
腔隙性脑梗死(LI)是由皮质下深穿支动脉及其分支闭塞引起的、梗死灶直径小于20 mm的脑梗死。LI是常见的缺血性脑血管病,发生率较高,占所有脑梗死的 20%~30%[1]。LI主要累及脑内小动脉及微小动脉,其病因和发病机制尚未明确。研究[2]表明,糖尿病和LI的发生密切相关。血清铁蛋白(SF)及β2微球蛋白(β2M)和大动脉粥样硬化相关[3],也可导致小动脉病变,但在糖尿病合并LI发病中的作用尚不清楚。因此,本研究通过探讨糖尿病合并LI患者不同糖化血红蛋白(HbA1c)水平时SF、β2M的水平,进一步分析糖尿病对SF和β2M的影响及在糖尿病合并LI发病中的作用。
1 资料与方法
1.1 一般资料 选择2016年1月至2017年12月在安徽省第二人民医院经磁共振(MRI)检查证实的LI患者127例。根据糖尿病史及入院后血糖、HbA1c的测定结果,将其分为糖尿病合并LI组65例和非糖尿病合并LI组62例;同时选取年龄、性别相似的健康体检者60例作为对照组。本研究经医院伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 入组、排除标准 糖尿病诊断根据WHO 2006年标准[4];LI诊断依据1995年全国第四次脑血管病学术会议制定的标准[5]。入组标准:意识清楚,经头颅MRI检查证实为LI,且LI直径<20 mm。排除标准:(1)排除心源性或大动脉性梗死,包括任何皮质梗死;(2)排除严重的心、肝、肾、甲状腺功能障碍及严重感染性疾病和恶性肿瘤;(3)酗酒;(3) 2周内服用含铁制剂、免疫抑制剂、叶酸、维生素类等影响血清铁水平的药物或食物。
1.3 观察指标 患者入院后采血前均空腹12 h以上,抽取静脉血5 mL。分离血清,测定空腹血糖(FPG)、HbA1c、总胆固醇(TC)、三酰甘油(TG)、SF及β2M等。入院时测量血压。采用美国GE signa Hde3.0 T磁共振仪。由2名副主任医师分别计数双侧额部、颞部、基底节、顶枕部及幕下部的白质或深部灰质内LI(图1)的数目,取均值作为LI数目。比较各组间各指标的差异,并分析SF、β2M、LI数目的影响因素及三者间的相关性。
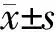
2 结 果
2.1 三组患者临床特征和生化指标 结果(表1)表明:3组对象的年龄、性别、舒张压、TG水平差异均无统计学意义。糖尿病合并LI组及非糖尿病合并LI组TC、FPG、HbA1c、SF、β2M均较对照组升高(P<0.01)。糖尿病合并LI组收缩压、TC、FPG、HbA1c、SF、β2M、LI数目均较非糖尿病合并LI组升高(P<0.01)。

图1 LI磁共振表现
A:侧脑室体层面,T1WI,梗死灶低信号(箭头处);B:T2WI,梗死灶高信号(箭头处);C:丘脑体层面,T1WI,梗死灶低信号(箭头处);D:T2WI,梗死灶高信号(箭头处)

表1 3组患者临床资料及生化指标比较
TC:总胆固醇;TG:三酰甘油;FPG:空腹血糖;HbA1c:糖化血红蛋白;SF:血清铁蛋白;β2M:β2微球蛋白;LI:腔隙性脑梗死.*P<0.01与对照组相比;△P<0.01与非糖尿病合并LI组相比
2.2 SF、β2M及LI数目的影响因素分析
2.2.1 单因素分析 结果(表2)表明:在糖尿病合并LI患者中,血清SF、β2M、LI数目均与收缩压、TC、FPG、HbA1c正相关(P<0.01)。SF与TG、LI数目正相关(P<0.01),与β2M无相关性。β2M与SF、TG、LI数目无相关性。LI数目与TG正相关(P<0.01),与β2M无相关性。
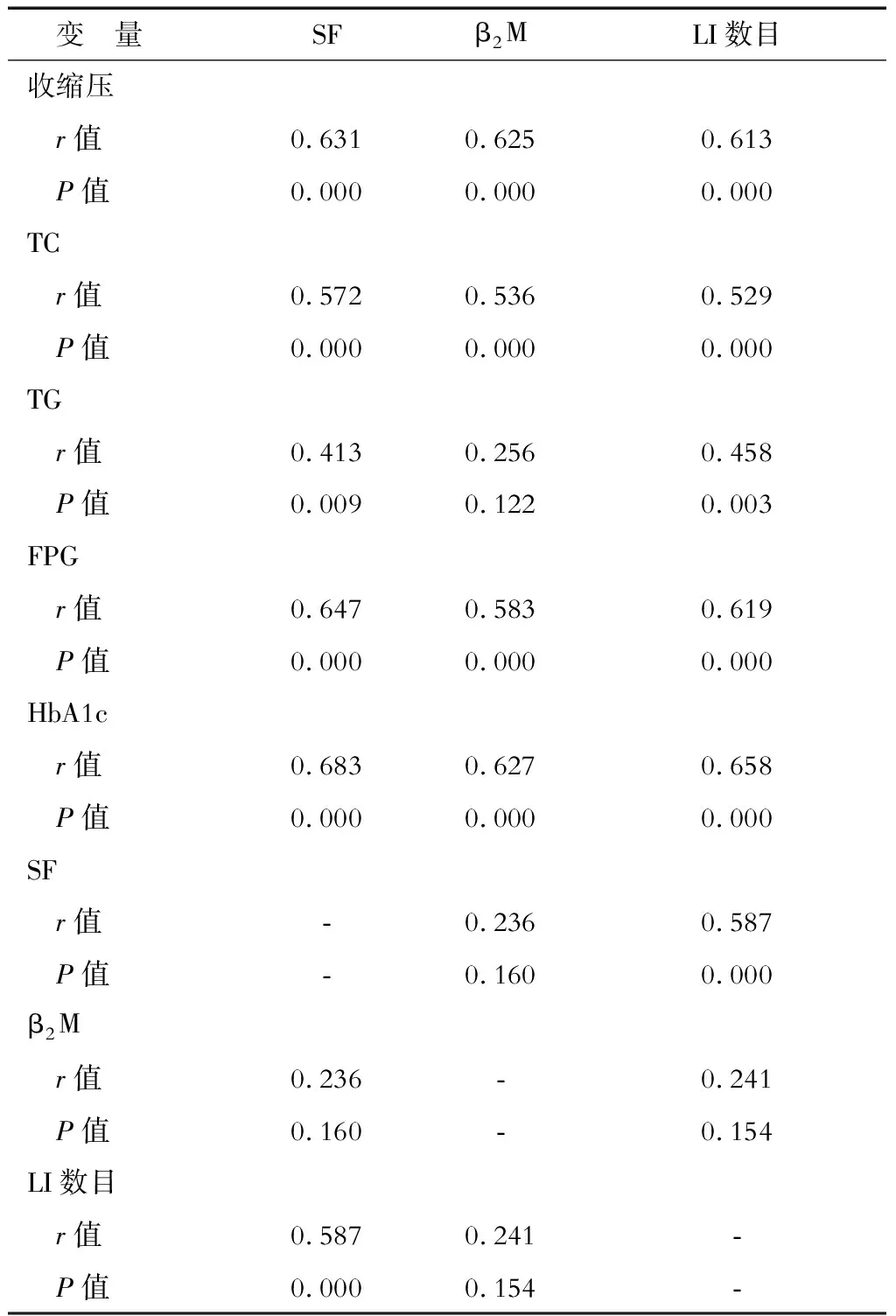
表2 影响血清SF、β2M、LI数目的单因素分析
TC:总胆固醇;TG:三酰甘油;FPG:空腹血糖;HbA1c:糖化血红蛋白;SF:血清铁蛋白;β2M:β2微球蛋白;LI:腔隙性脑梗死
2.2.2 多元逐步回归分析 以SF为应变量,收缩压、TC、FPG、HbA1c、TG、LI数目为自变量进行多元逐步回归分析,结果显示,HbA1c进入回归方程,标准化偏回归系数(β’)为0.627(P<0.05)。以β2M为应变量,收缩压、舒张压、TC、FPG、HbA1c为自变量,结果显示,HbA1c和收缩压进入回归方程,β’分别为0.492和0.513(P<0.05)。以LI数目为应变量,收缩压、TC、TG、FPG、HbA1c、SF为自变量,结果显示,SF进入回归方程,β’为0.643(P<0.05)。
3 讨 论
糖尿病是LI发生的重要危险因素之一,约30%的LI患者伴有糖尿病[6]。糖尿病微血管病变为LI的常见病因,其病理改变为微血管基底膜增厚、透明变性[7]。高血糖引起的代谢紊乱会导致细胞无氧代谢增加及酸中毒的发生,从而加重脑血管损害,引发脑部小血管病变[8]。本研究发现,糖尿病合并LI患者较非糖尿病合并LI患者LI数目增多(P<0.01),说明糖尿病与LI的发生有相关性。有研究[9]表明,HbA1c是脑小血管病(CSVD)发生的独立危险因素,与CSVD严重程度正相关;Chandni等[10]发现,糖尿病微血管病变与HbA1c控制水平相关。本研究发现,LI患者HbA1c水平和LI数目正相关,与上述研究相符。
SF是机体内铁离子的主要储存形式。Wang等[11]指出,SF与人体免疫低下、炎症、血管病及癌症等的发生相关。高SF可引起动脉硬化,增加心脑血管病的风险[12]。Mandal等[13]研究表明,SF在急性缺血性卒中患者中显著升高。Dàvalos等[14]的前瞻性研究发现,在正常SF水平的人群中,SF越高者患脑卒中的风险越大。Mccord[15]认为,高SF引起血管损害的机制有:铁离子可增加低密度脂蛋白(LDL)对血管内膜的损害,加速动脉粥样硬化斑块的形成;铁离子可加速脂质过氧化的速度和羟自由基的生成,通过损害血管内膜引起动脉硬化。Abdalla等[16]研究表明,中性粒细胞激活后可生成氧自由基,使LDL发生氧化修饰,而高SF可加速这一过程;另外铁负荷增加可提高血红蛋白浓度并导致血小板激活,增加血栓形成风险[17]。
有学者[18]发现,SF水平和HbA1c正相关,本研究结果支持该结论。其原因可能是:高SF可引起胰岛素抵抗[19],而胰岛素抵抗又可加重肝脏内的铁沉积,形成恶性循环。本研究发现,SF与LI数目正相关,是其独立危险因素,说明高SF可引起LI。Goot等[20]认为脑小血管病患者SF水平明显升高原因为:一方面可能是CSVD原发,SF升高后加速氧化应激及组织损伤;另一方面由于缺氧等诱发氧化应激,使SF代偿性增高。因此,SF在糖尿病合并LI的发生发展中起重要作用,可能是糖尿病合并LI发生的预测因子。
β2M是有核细胞表面释放的单链多肽,仅通过肾脏代谢,经肾小球滤过后99.9%在近曲小管重新吸收后降解[21]。因此,β2M可以反映肾小球滤过功能。正常情况下,血液中的β2M浓度较为恒定,当肾小球功能损害时,血β2M浓度升高。糖尿病患者易并发肾脏损害,HbA1c越高,其肾脏损害则越严重,则β2M越高。Siddiqi等[22]研究表明,尿微量白蛋白、β2M对糖尿病肾病具有重要预测价值。黄慧等[23]发现,血糖为β2M升高的独立危险因素。Drüek[24]研究指出,神经、血管病变与淀粉样沉积物相关,而淀粉样沉积物主要由β2M原纤维组成。β2M与LI的关系目前鲜有报道。刘洋等[25]发现,急性脑梗死患者β2M水平高于健康对照组,脑梗死亚型LAA型、CE型、SAO型之间β2M差异无显著性。本研究发现,β2M和LI数目无相关性。
综上所述,高SF在糖尿病合并LI患者中通过损害血管内膜、增加血黏度、激活血小板等,导致LI的进展,可作为预防糖尿病患者发生LI或LI进展的潜在靶点;β2M与糖尿病合并LI无相关性;降低糖尿病患者的HbA1c水平对减少LI的发生有重要意义。
