芍药苷-6-O′-苯磺酸酯在Caco-2细胞模型中吸收机制研究
2018-11-07王剑,王春,肖峰,马勇,魏伟
王 剑,王 春,肖 峰,马 勇,魏 伟
白芍总苷(total glucosides of paeony, TGP)提取于芍药干燥根部,临床长期用药证实TGP治疗类风湿性关节(rheumatoid arthritis, RA)疗效显著,但起效较慢[1]。芍药苷(paeoniflorin, Pae)是TGP的主要有效成分。研究[2]显示Pae具有相同的抗炎和免疫调节作用。由于其低亲脂性的特性,Pae在口服后吸收较差,生物利用度极低 (3%~4%)[3]。因此课题组前期合成了一种新的Pae酯化衍生物苯芍药苷-6′-O-苯磺酸酯(benzene sulfonyl paeoniflorin) , 代号CP-25。课题组已有研究[4]表明CP-25具有良好的抗炎免疫和软调节性能,其药理学活性[3]和生物利用度[5]均高于Pae。在体单向肠灌流大鼠模型研究[6]表明CP-25吸收明显高于Pae,被动转运是CP-25 在大鼠小肠中主要吸收机制。此外,前期研究[7]使用超高效液相质谱 (UPLC-MS/MS) 方法测定CP-25大鼠体内药代动力学参数,结果显示疾病状态下的大鼠血浆中,CP-25在雌性大鼠体内分布显著大于雄性大鼠, 食物摄取显著增强CP-25的吸收。然而,CP-25在Caco-2细胞中的吸收特性仍然不清楚。因此,该研究将探讨CP-25在Caco-2细胞中的吸收和转运机制。
1 材料与方法
1.1材料
1.1.1药物与试剂 CP-25:白色粉末状,自制,纯度>98%;DMEM培养基和胰蛋白酶购自美国Gibco公司;甲醇、乙腈为色谱级,购于Merck公司; Transwell 12孔板购自Corning公司;MTT购自白鲨生物科技有限公司;胎牛血清购自美国Gibco公司;GF120918购自美国Sigma公司,纯度>95%;MK571购自美国Sigma公司,纯度>95%;KO143购自美国Sigma公司,纯度> 98%。
1.1.2实验细胞株 Caco-2细胞购于ATCC (American Type Culture Collection)
1.1.3主要仪器 SW-CJ系列洁净工作台购自苏州净化设备工程有限公司;Agilent1200 高效液相色谱仪购自美国安捷伦公司;AA-200DS 电子分析天平购自Denver 仪器公司;CO2培养箱购自Thermo;Millicell-ERS上皮跨膜细胞电阻仪购自美国Millipore。
1.2实验方法
1.2.1Caco-2细胞模型液CP-25定量分析方法的建立
1.2.1.1色谱条件及其专属性 Agilent1200 高效液相色谱仪色谱仪;Aglient TC-C18(5 mm×250 mm);流动相:甲醇-水(53 ∶47);柱温:30 ℃;流速:0.8 ml/min;进样量:20 μl;检测波长:230 nm。在该条件下CP-25的色谱峰与相邻峰基线分离度较好,峰形对称。
1.2.1.2CP-25标准曲线建立 将CP-25储备液溶液用HBSS液分别稀释成1、2、5、10、20、40、80 μg/ml的质量浓度标准溶液,取上述标准溶液涡旋混合1 min,放置 15 min后,取上清液0.2 ml进样测定,记录峰面积。以峰面积为Y,质量浓度为 X(μg/ml)作线性回归,计算相关回归方程。
1.2.1.3CP-25稳定性实验 精密称取CP-25标准品,用HBSS液溶解并定容至10 μg/ml,置于37 ℃恒温水浴槽中保温,分别于0、0.5、1、1.5、2、3 h取样涡旋混合1 min,放置 15 min后,取上清液0.2 ml按照1.2.1.1项下进行操作,记录相应峰面积。
1.2.1.4CP-25精密度实验 取线性范围内低(5 μg/ml)、中(10 μg/ml)、高(20 μg/ml)3个浓度样品,按1.2.1.1项下操作,每个浓度样品制备5份。同一样品1 d内测定5次的结果为日内精密度,连续5 d测定同一样品的结果为日间精密度。
1.2.1.5CP-25回收率实验 取CP-25线性范围内低(5 μg/ml)、中(10 μg/ml)、高(20 μg/ml) 3个浓度的样品,按1.2.1.1项下操作并记录峰面积。将CP-25峰面积代入标准曲线中,即得CP-25的实际加入的浓度,以测定质量浓度与加入质量浓度之比计算回收率即得CP-25低、中、高3个浓度的回收率。另用流动相制备相同浓度的CP-25样品溶液,直接进样并记录其峰面积,两峰面积之比即为相对回收率。
1.2.2Caco-2细胞模型的建立
1.2.2.1细胞培养 Caco-2细胞在含10 % FBS、1%非必需氨基酸、1% L-谷氨酰胺和1%的链青霉素的DMEM培养基中于37 ℃、相对湿度95%、5% CO2的培养箱培养,当细胞生长融合达到80%~90%时,用胰酶按1 ∶3消化传代,本实验所用细胞为35~60代。
1.2.2.2Caco-2单细胞层的建立 将Caco-2细胞以密度为1×105个/ml接种在12孔Transwell小室上,AP侧加0.5 ml细胞悬液, BL侧加1.5 ml DMEM培养液,培养21~23 d。
1.2.2.3TEER电阻值的测定 细胞在接种后的4、8、12、16、20、22 d分别用Millicell ERS-2细胞电阻仪测定细胞跨膜电阻值,按照下列公式计算跨膜电阻值(transepithelial electrical resistance, TEER):TEER=(Rt-R0)×A(Ω·cm2)。其中Rt为细胞孔实测电阻值;R0为不含细胞空白电阻值;A为小室有效膜面积(1.12 cm2)。
1.2.3CP-25在Caco-2细胞模型上吸收和转运机制的研究[8]
1.2.3.1MTT法检测CP-25对Caco-2单细胞层毒性 胰酶消化对数生长期Caco-2细胞制成单细胞悬液,以每孔5×104个细胞密度接种到96孔培养板中。培养24 h后取出原细胞培养基,再将不同浓度CP-25(0、0.2、0.5、1.0、2.0、5.0、10.0、20.0、40.0、80.0、160.0 μg/ml)加入细胞中孵育4 h。每孔加入20 μl MTT并孵育4 h,再每孔加入200 μl DMSO,用微型振荡器振荡10 min。使用酶标仪在492 nm处分析样品。使用没有接种细胞的孔作为空白对照,并且含有细胞但没有样品溶液的孔用作阴性对照。每组由3个复孔组成。细胞存活率用下式计算:细胞存活率=(实验组OD值 - 空白组OD值)/(阴性对照组OD值 - 空白组OD值)×100%。
1.2.3.2不同浓度对CP-25转运的影响 将CP-25溶解于HBSS培养基中,制备不同浓度的CP-25,分别为0.2、0.5、1.0、2.0、5.0、10.0、20.0 μg/ml。细胞在不同浓度的CP-25 HBSS培养基中孵育2 h,2 h后分别在AP侧和BL侧吸取0.2 ml溶液按照1.2.1.1项下操作,记录其峰面积。
1.2.3.3不同温度对CP-25转运的影响 将浓度为5、10、20 μg/ml的CP-25以0.5 ml体积分别加入AP侧,并将1.5 ml HBSS培养基加入到BL侧。 随后将含药细胞放置在4 ℃下培养2 h。2 h后,从每个样品的BL侧取出0.2 ml溶液按照1.2.1.1项下操作,记录其峰面积。
1.2.3.4P-gp、MRP2和BCRP对CP-25转运的影响 将CP-25用甲醇溶解并用HBSS培养基稀释,其含药稀释液用于溶解GF-120918、MK-571和KO143。P-gp拮抗剂GF120918(100 μmol/L)[9]、MRP2拮抗剂MK-571(50 μmol/L)[10]和BCRP拮抗剂KO143(10 μmol/L)可评估其对CP-25和Pae的Papp的影响。选择TEER高于500 Ω/ cm2的Caco-2细胞单层用于该实验。将0.5 ml和1.5 ml的药物溶液分别加入到AP侧和BL侧。同时,分别向BL侧和AP侧添加1.5 ml和0.5 ml的HBSS。将样品孵育2 h,然后分别从AP侧和BL侧取出0.4 ml和0.2 ml样品溶液按照1.2.1.1项下操作,记录其峰面积。
1.3表观渗透系数(Papp)的计算[11]Papp值的大小反映了受试物吸收的程度和速度。Papp由下式计算:
其中,ΔQ/Δt为化合物单位时间内的透过速率,A为细胞表面积,即为本模型中支持膜的面积(1.12 cm2),C0为化合物初始浓度。Papp的单位常用cm/h或cm/s表示。
1.4表观渗透率比(PDR)的计算[11]PDR是受试物从BL面到AP面和AP面搭配BL面之比,其大小反映了受试物吸收机制。PDR由下式计算:物质在当前色谱条件下无干扰,符合样品分析方法的检查要求。
其中,PappBL→AP从基底侧到肠腔侧(BL→AP)的Papp值,PappAP→BL从肠腔侧到基底侧的Papp值。
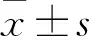
2 结果
2.1HPLC图谱专属性色谱图见图1,结果表明CP-25的保留时间为11.4 min,空白HBSS液和内源

图1 Caco-2细胞模型HBSS液(A)、CP-25供试液(B)的HPLC图
2.2HPLC方法学小结HPLC测定Caco-2 细胞模型HBSS液中的CP-25,出峰时间11.6 min,出峰时间适宜,无明显Caco-2模型内溶液干扰。CP-25标准曲线为Y=24.403X-23.678(r2=0.999),浓度范围在1~80 μg/ml,线性关系良好,相对回收率>90%,日内和日间RSD<5%,且在实验条件下(37±1)℃稳定,均符合样品分析要求。
2.3Caco-2细胞TEER值的测定Caco-2细胞接种Transwell小室后逐渐形成细胞单层,TEER值逐渐升高,22 d时达到(580±35)℃·cm2,表明此时细胞膜具有较强完整性,满足转运实验要求。见图2。

图2 Caco-2细胞在不同时期测定的TEER值
2.4CP-25对Caco-2单细胞层的毒性CP-25对Caco-2单细胞层的毒性结果如图3所示,CP-25 在0.2~20 μg/ ml范围48 h内未见毒性。因此,本研究使用此范围内的浓度进行后续转运实验。
2.5不同浓度对CP-25转运的影响结果如表1所示,CP-25的Papp值(AP→BL)在浓度为5、10、20 μg/ml时与2 μg/ml的CP-25组相比差异有统计学意义。CP-25 Papp(10-6cm/s) BL→AP值显著高于Papp(10-6cm/s) AP→BL值,然而,CP-25 PDR值差异无统计学意义。结果表明CP-25在Caco-2单细胞层中表现出浓度依赖性,并且CP-25的主要转运机制是被动转运。
2.6不同温度对CP-25转运的影响结果如表2所示,与37 ℃ 时Papp(10-6cm/s)相比,4 ℃ 时CP-25 AP-BL的Papp值在5、10和20 μg/ ml时显著降低(P<0.05,F=41.267),提示主动转运可能是CP-25在Caco-2细胞中的另一种吸收机制。
2.7P-gp、MRP2和BCRP对CP-25转运的影响P-gp抑制剂GF120918(100 μmol/L)、MRP2抑制剂MK571(50 μmol/L)和BCRP抑制剂KO143(10 μmol/L)对CP-25的Papp值如表3所示,与对照组 (不加抑制剂) 相比,GF120918和MK571 可使CP-25 Papp值增加约1.6和1.1倍,KO143对CP-25的Papp值没有明显影响;结果表明CP-25在Caco-2细胞上的转运有P-gp和MRP2参与,而与BCRP无关。此外,CP-25在Caco-2细胞中的PDR值小于1.5,表明CP-25主要转运机制是被动转运。
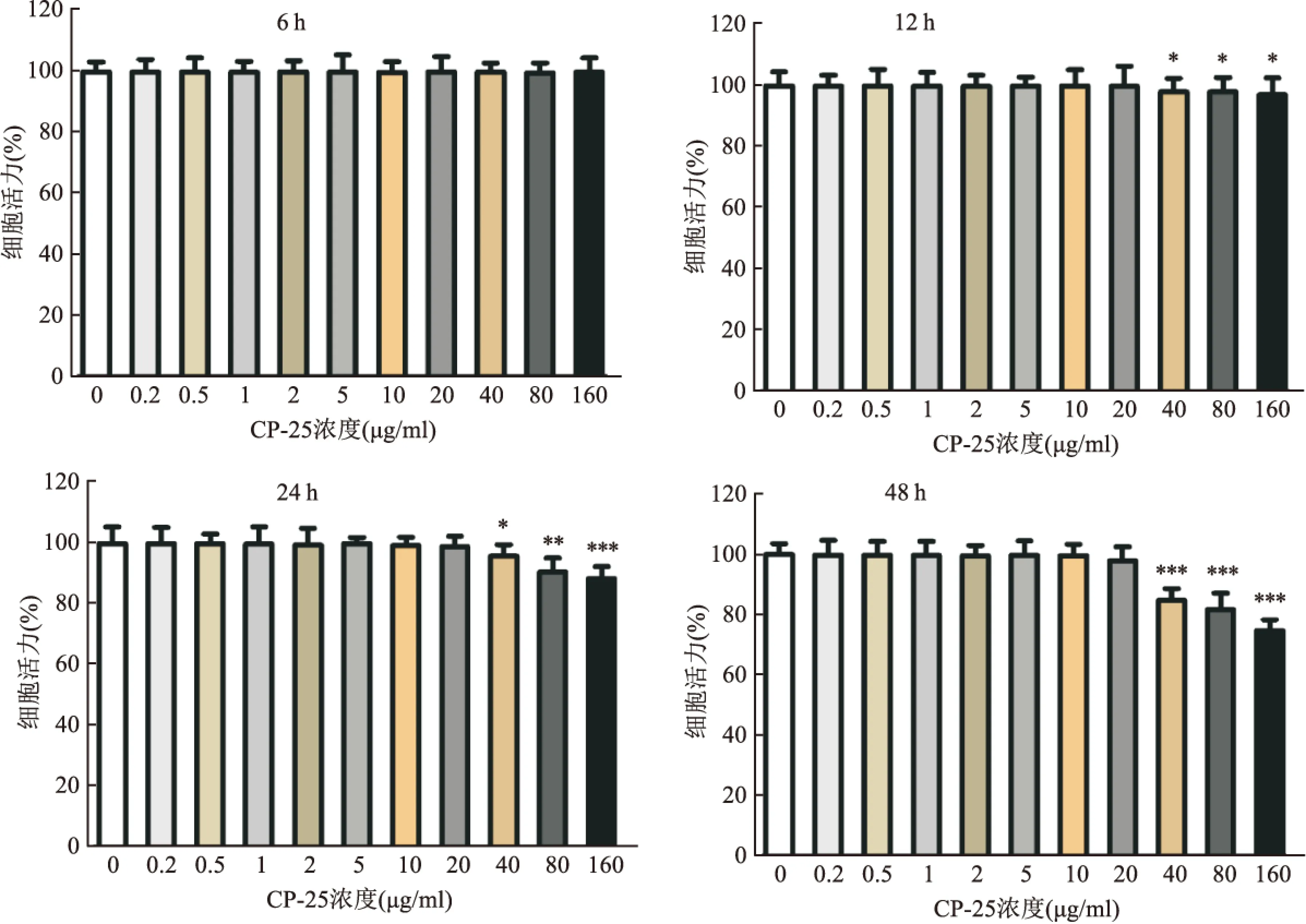
图3 CP-25对Caco-2单细胞层的毒性

组别CP-25(μg/ml)251020Papp(10-6 cm/s)AP→BL0.98±0.051.09±0.03*1.12±0.05*1.37±0.06*Papp(10-6 cm/s)BL→AP0.56±0.04#0.73±0.02#0.91±0.02#1.22±0.04#PDR0.570.670.810.88
与2 μg/ml CP-25 Papp(10-6cm/s) AP→BL组比较:*P<0.05;与CP-25 Papp(10-6cm/s)AP→BL组比较:#P<0.05

表2 Caco-2细胞单层模型中温度对CP-25转运的影响
与37 ℃ CP-25 Papp(10-6cm/s)组比较:*P<0.05

表3 Caco-2细胞单层模型中P-gp、MRP2和BCRP对CP-25转运的影响
与CP-25 (10 μg/ml) BL→AP组比较:*P<0.05,**P<0.01
3 讨论
良好的口服吸收是新药筛选的先决条件,药物溶解度和胃肠道的渗透性是影响口服吸收的主要因素。一般来说,药物溶解度和渗透性与其物理化学性质如亲脂性、分子大小、氢键强度和电离强度有关。然而,预测人的口服吸收却相对复杂,特别是在早期药物开发阶段。一些体外实验方法广泛用于新药的筛选和药物相关吸收机制的研究,Caco-2细胞体外分化成类似人的肠上皮细胞时可表达肠道特有的水解酶[12],此外Caco-2细胞表达P-gp和其他膜转运蛋白的水平与人的肠上皮细胞表达水平相当。因此,Caco-2细胞模型常常用于研究药物在人的肠细胞中的吸收和转运机制。本研究探讨了不同浓度和温度对CP-25在Caco-2细胞模型上吸收转运的影响,并通过GF120918、MK571和KO143 考察CP-25在Caco-2细胞吸收转运是否与P-gp、MRP2和BCRP三种转运蛋白有关。结果显示CP-25的转运量随着CP-25浓度的增加而增加,Papp(BL→AP)均显著低于Papp(AP→BL),说明药物在吸收过程中尽管会有药物外排,但总体趋势依旧是吸收,药物浓度越高,总体吸收程度越高。此外,CP-25 (2、5、10、20 μg/ml)在Caco-2细胞双向转运中的PDR值均小于1.5,说明CP-25主要转运机制是被动转运,这一结论与之前的报道[6]一致。
载体介导转运对温度十分敏感,载体是存在于细胞膜上的转运蛋白,只有在合适的温度条件下才具有生物活性。本实验在4 ℃ 条件下时,CP-25和Pae(5、10、20 μg/ml)的Papp(AP→BL)值与37 ℃ 条件下Papp(AP→BL)值相比显著降低,其原因可能是低温导致载体蛋白失活,因此主动转运可能是CP-25在Caco-2细胞中的另一种吸收机制。此外,也可能是由于CP-25微溶于水,药物在低温条件下可能会析出结晶,导致培养体系中CP-25实际浓度降低,从而Papp(AP→BL)值降低。
P-gp、MRP2和BCRP是ATP结合盒转运蛋白家族中研究最多的外排转运蛋白[13]。通常,口服给药必须穿过肠上皮细胞才能到达血液和组织,这些转运蛋白充当选择性屏障,将药物外排到肠腔中。因此, ABC家族转运体可抑制口服给药吸收性,是导致多药耐药性的主要因素。已有文献[14]报道P-gp、MRP2和BCRP在人的空肠和Caco-2细胞中表达丰富。Vaidyanathan et al[10]研究发现P-gp抑制剂GF120918、MRP2抑制剂MK571和BCRP抑制剂KO143可有效抑制三种转运蛋白的表达。本研究结果表明GF-120918和MK571 可使Papp(AP→BL)显著增加,Papp(BL→AP)显著降低,KO143对双向Papp均无显著差异,提示CP-25为外排转运蛋白P-gp、MRP2的底物,而不是BCRP的底物。课题组前期研究[6]表明CP-25均不是P-gp、MRP2和BCRP的底物。这一相悖结果可能是它们所用抑制剂的浓度 (GF120918 5.6 μg/ml,MK571 5.3 μg/ml,KO143 0.5 μg/ml)与其他报道[15]所用抑制剂浓度相比太低,不能对P-gp抑制作用产生很大影响造成的。因此,每个实验模型都有其自身的局限性,不能仅仅依赖于单一实验模型方法来确认其底物。
综上所述,CP-25主要吸收机制是被动转运,可能存在主动转运的参与。CP-25是P-gp和MRP2的底物,不是BCRP的底物,这一研究发现为提高CP-25生物利用度提供了实验依据和理论基础。
