人骨形成蛋白7对人牙髓细胞增殖和分化的作用研究
2018-11-07蒋玉清刘文钊苏玲瑜
喻 刚,蒋玉清,刘文钊,苏玲瑜
人牙髓细胞(human dental pulp cells,hDPCs)的主要成分是牙髓成纤维细胞和少量未分化的间充质细胞,其中,未分化的间充质细胞具有多向分化的潜能,在一定条件下可以向成牙本质细胞分化,这对于牙髓组织的损伤修复意义重大[1-2]。人骨形成蛋白(human bone morphogenetic proteins,BMPs)在牙齿发育和牙髓损伤修复中发挥着重要作用。有研究[3]显示,在动物体内,采用BMP-7(又名成骨蛋白1)与胶原载体复合用于牙齿的直接盖髓治疗,在盖髓部位可见修复性牙本质形成,表明BMP-7是牙髓修复的潜在治疗因子。该研究通过观察BMP-7对人牙髓细胞增殖和分化的影响,探讨BMP-7在人牙髓牙本质复合体损伤修复中的具体作用。
1 材料与方法
1.1实验材料
1.1.1实验试剂 BMP-7购自美国Peprotech公司;DMEM低糖培养基和胎牛血清均购自美国Gibco公司;胰酶、MTT购自Sigma公司;EdU细胞增殖检测试剂盒购自广州锐博生物科技有限公司;RNA提取试剂盒购自天根生化科技有限公司;矿化诱导液购自Biosharp公司;茜素红染液和碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒购自西安赫特生物科技有限公司;波形丝蛋白(Vimentin)和角蛋白(Keratin)抗体购自英国Abcam公司;FITC标记的荧光二抗购自武汉博士德生物工程有限公司;cDNA合成试剂盒和qRT-PCR试剂盒均购自美国BIO-RAD公司。
1.1.2实验仪器 Heraeus BB15型细胞培养箱(美国ThermoFisher公司);BHC-1000IIA/B3型生物安全柜(中国苏净安泰生物技术有限公司);Sorvall ST16型低速离心机(美国ThermoFisher公司);IX73型倒置荧光显微镜(日本Olympus公司);Multiscan MK3酶标仪(美国ThermoFisher公司);ABI7500型荧光定量PCR仪(美国Applied Biosystems公司)。
1.2实验方法
1.2.1人牙髓细胞的收集与原代培养 收集临床因正畸或阻生拔除的健康前磨牙(30岁以下,无牙体及牙周疾病),于无菌条件下用含有双抗的低糖无血清DMEM培养液浸泡并冲洗数遍,劈开牙冠取出牙髓组织,立即用培养基冲洗3遍并充分剪碎,加入2.5 g/L胰酶于37 ℃消化1 h,加入等量含血清培养基终止消化,1 000 r/min离心3 min收集细胞,采用含10%胎牛血清的低糖DMEM培养基重悬并接种细胞,置于5% CO2、37 ℃恒温培养箱培养。每2~3 d换液一次,待细胞融合率达80%后消化并按1 ∶2传代培养。取2~5代的hDPCs进行Vimentin和Keratin免疫荧光检测鉴定,并开展后续实验。
1.2.2EdU细胞增殖检测 收集对数生长期的hDPCs并接种于96孔板中,次日,向孔中加入终浓度为50、100和200 ng/ml 的BMP-7处理细胞,每个浓度3个复孔,并设置溶剂对照组。将EdU加入各处理组共同孵育36 h以标记增殖细胞,按试剂盒操作说明对细胞进行固定染色,在倒置荧光显微镜下观察并拍照。
1.2.3MTT法检测细胞活力 收集对数生长期的hDPCs并接种于96孔板中,次日,采用1.2.2项下的方法处理细胞。于处理1、3、7、10 d行MTT检测:向每孔加入20 μl MTT溶液(5 g/L),在37 ℃孵育2~4 h,再加入50 μl 质量浓度为200 g/L的酸性SDS溶液,于37 ℃溶解甲臜过夜,最后采用酶标仪检测570 nm波长下的吸光度值。
1.2.4矿化结节检测 收集2~5代的hDPCs并接种于96孔板中,待细胞贴壁后向孔中加入含50、100、200 ng/ml BMP-7的矿化诱导液(含10 nmol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 g/L 维生素C的DMEM培养基)处理细胞,每3 d更换一次诱导液。于处理后的第10天吸出诱导液,采用PBS洗3次,甲醇固定15 min,PBS洗2次,加入茜素红染液于37 ℃染色30 min,PBS洗3次,在倒置显微镜下观察并拍照。
1.2.5碱性磷酸酶活性检测 收集对数生长期的hDPCs并接种于24孔板中,采用1.2.4项下的处理方法诱导细胞。分别于诱导培养后第1、3、7、10天弃去诱导液并裂解细胞,按碱性磷酸酶检测试剂盒操作说明进行相应处理,并检测405 nm波长下的吸光度值。
1.2.6实时荧光定量PCR 收集对数生长期的hDPCs并接种于6孔板中,采用1.2.4项下的处理方法诱导细胞,并于诱导培养后第10天进行牙本质基质蛋白(dentin matrix protein 1,DMP-1)和牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)mRNA表达水平的测定:按试剂盒操作说明提取hDPCs总RNA,逆转录成cDNA,再进行荧光定量PCR检测。使用的引物序列如下:DMP-1(forward):5′-GTGAGTGAGTCCAGGGGAGATAA-3′,DMP-1(reverse):5′-TTTTGAGTGGGAGAGTGTGTGC-3′;DSPP(forward):5′-CTGTTGGGAAGAGCCAAGATAAG-3′,DSPP(reve-rse):5′-CCAAGATCATTCCATGTTGTCCT-3′;GAPDH(forward):5′-CAGGTGGTCTCCTCTGACTT-3′,GAPDH(reverse):5′-CCAAATTCGTTGTCATACCA-3′。以GAPDH mRNA表达水平作为内参,通过检测目的基因相对于内参基因的表达变化进行定量分析。
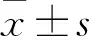
2 结果
2.1hDPCs细胞来源鉴定细胞免疫荧光的检测结果显示,原代培养的hDPCs细胞Vimentin检测结果为阳性,胞质内可见明显的绿色荧光,而Keratin检测呈阴性(图1)。该结果表明原代培养的hDPCs来源于中胚层的间充质细胞。
2.2BMP-7对hDPCs增殖的影响如图2A和2B所示,采用不同浓度的BMP-7(50、100和200 ng/ml)处理hDPCs后,对照组和BMP-7处理组hDPCs中红色标记的增殖细胞数量差异无统计学意义;此外,MTT细胞活力检测结果也显示,采用BMP-处理细胞1、3、7、10 d后,各时间点的BMP-7处理组与对照组相比,hDPCs细胞生长活力差异无统计学意义(P>0.05),不同浓度BMP-7处理组之间细胞活力也无明显差异(图2C)。结果表明,BMP-7对hDPCs增殖无明显影响。

图1 细胞免疫荧光鉴定hDPCs 细胞免疫荧光×200

图2 不同浓度BMP-7对hDPCs增殖的影响 EdU染色×100

图3 不同浓度BMP-7诱导hDPCs矿化结节形成情况 茜素红染色×100
2.3BMP-7对hDPCs钙化结节形成的影响采用含不同浓度BMP-7的矿化诱导液(BMP-7浓度分别为50、100和200 ng/ml)处理hDPCs 10 d后,BMP-7处理组茜素红染色均呈阳性,可见明显的矿化结节,且矿化结节的量随BMP-7浓度的升高而增多(图3)。
2.4BMP-7对hDPCsALP活性的影响采用含不同浓度BMP-7的矿化诱导液处理hDPCs 3、7、10 d后,BMP-7处理组ALP活性值显著高于对照组(P<0.01),且在同一时间点内,ALP的活性随着BMP-7浓度的升高而显著增强;随着作用时间的延长,各处理组ALP的活性也有明显提升(表1)。

表1 各时间点不同浓度的BMP-7处理组在405 nm处的吸光度值(n=3)
2.5BMP-7对成牙本质相关基因表达的影响采用不同浓度的BMP-7矿化诱导液处理hDPCs 10 d后,各BMP-7处理组DMP-1和DSPP mRNA表达水平均显著高于对照组(P<0.05),且随着BMP-7浓度的升高,两种基因的表达水平也有显著提升(图4)。

图4 BMP-7对成牙本质相关基因表达的影响
3 讨论
BMP-7属于TGF-β细胞因子超家族中骨形成蛋白亚家族,又称为成骨蛋白1,具有多种生物学功能。有研究[4]显示,BMP -7是一种重要的肾脏调节因子,与肾脏疾病的发生、发展、转归密切相关,对维持肾脏的正常结构和功能也有重要意义。此外,BMP-7还具有抑制器官纤维化的作用[5-6],还可用于诱导骨髓间充质干细胞向神经元细胞分化[7]。而作为一种重要的成骨诱导因子,其主要功能则在促进骨骼的发育和损伤修复方面,诸多实验和临床研究[8]表明,BMP-7能促进骨折愈合,并已在临床上用于多种骨科疾病的治疗。同时,在牙髓生物学领域,BMP-7在成牙本质细胞分化和第三期牙本质的形成中具有重要的作用,并能诱导牙乳头细胞发生功能性分化[3]。林正梅 等[9]采用重组腺病毒介导hBMP-7基因转染人牙髓细胞,发现与空载体组和未转染细胞组相比,hBMP-7基因转染组检测到了牙髓细胞向成牙本质细胞分化,表明BMP-7在牙髓的损伤修复中也具有重要的调控作用。由此可见,BMP-7在保髓治疗中也具有很大的应用前景。
本研究直接采用BMP-7因子处理人牙髓细胞,并运用多种评价指标检测BMP-7在诱导牙髓细胞增殖及分化中的作用。其中,ALP是评价牙髓细胞早期分化的重要标志物。当牙髓中的未分化间充质干细胞向成牙本质细胞分化时,ALP活性显著提升。DMP-1在牙本质形成和矿化过程中具有重要作用,它的表达水平可以提示牙髓细胞向成牙本质细胞分化的程度。DSPP是牙本质非胶原蛋白的主要成分,可以作为成牙本质细胞的特异性标记蛋白。结果显示,经BMP-7处理的hDPCs,细胞增殖无显著变化,但可形成明显的矿化结节,且ALP活性呈剂量和时间依赖性地增加,DMP-1和DSPP的表达水平也较对照组显著提升,进一步证实了BMP-7可以诱导牙髓细胞向成牙本质细胞分化。
BMPs家族蛋白发挥生物学效应的分子机制涉及两条重要的信号通路:Smads介导的信号通路和MAPK途径。前者是由靶细胞膜上BMPs受体及细胞质内各型Smads蛋白协同参与完成,是TGF-β超家族包括BMPs信号转导的经典通路;后者属于丝氨酸/苏氨酸蛋白激酶,主要在Smads途径被阻断后,作为补救途径来介导BMPs信号的传递[10]。大量研究显示,BMPs诱导的牙髓细胞分化与两种信号通路均有关联。Qin et al[11]的研究显示,在诱导向成牙本质细胞分化的过程中,BMP-2的加入促进了Smad1/5磷酸化,而采用BMP信号抑制剂Noggin选择性抑制Smad蛋白活性,则可显著抑制牙髓细胞的分化,表明Smad1/5在其中发挥了重要的调控作用。Yang et al[12]的研究则发现,BMP-2通过刺激p38 MAPK信号通路,激活了调控干细胞生长的WNT/ β-catenin信号,这一信号级联也是调控牙髓细胞分化的主要分子机制。此外, Li et al[13]的研究也表明MAPK通路参与了BMP-9诱导牙囊干细胞分化的调控。由此我们推断,BMP-7诱导牙髓细胞向成牙本质细胞分化也可能受到了Smads信号通路和MAPK途径的调控。
综上所述,BMP-7可诱导hDPCs向成牙本质细胞分化,而对hDPCs增殖无显著影响,其诱导牙髓细胞分化的作用机制可能与BMPs/Smads和MAPK信号通路的调控相关,具体机制有待进一步探讨。
