表皮生长因子对结肠细胞中紧密连接蛋白表达和磷酸化的影响
2018-11-07黄媛媛李忠稳夏先明
黄媛媛,李 静,李忠稳,夏先明
溃疡性结肠炎(ulcerative colitis,UC) 是一种肠道疾病,病理特征是炎症反应和黏膜损害。过度的炎症反应破坏了肠上皮细胞层的完整性,导致黏膜溃疡[1]。TJs蛋白差异表达导致的上皮细胞间结构松散或形态变化是UC患者肠黏膜屏障功能降低的主要原因[2]。研究[3]证明,紧密连接(tight junctions,TJs)蛋白的磷酸化会导致上皮细胞的极性改变和结构变化,从而影响上皮屏障功能。TJs蛋白的磷酸化状态受酪氨酸激酶和丝氨酸-苏氨酸激酶的调节。表皮生长因子受体(epidermal growth factor receptor,EGFR)是酪氨酸激酶家族中最重要的激酶,通过其配体表皮生长因子(epidermal growth factor,EGF)的激活,可以调节TJs蛋白的差异表达和磷酸化状态[4]。该研究观察T84结肠细胞中TJs蛋白的磷酸化状况,以及EGF对TJs蛋白磷酸化的影响。
1 材料与方法
1.1实验材料T84结肠细胞购自美国ATCC细胞中心;小鼠抗claudin-1抗体、小鼠抗claudin-5抗体、兔抗claudin-3抗体、兔抗claudin-7抗体、兔抗occludin抗体、兔抗Zo-1抗体、DMEM/F12培养基等购自美国Invitrogen公司;EGF购自美国Sigma公司;兔抗claudin-3(磷酸化位点Tyr219)抗体、兔抗claudin-5(磷酸化位点Tyr217)抗体、兔抗claudin-7(磷酸化位点Tyr210)抗体等购自美国Assay Biotechnology公司;兔抗β-tubulin抗体购自美国Santa Cruz Biotechnology 公司;辣根过氧化物酶结合的二抗购自上海康成生物公司;化学发光HRP底物购自美国Millipore公司。
1.2细胞培养T84细胞传至8~10代使用。以含有10%胎牛血清的DMEM/F12培养基,加入100 U/ml青霉素和100 μg/ml链霉素,在37 ℃、5% CO2、90%相对湿度的环境中培养。T84细胞培养至单层融合状态,然后在对照组培养基中加入DMSO (EGF溶剂,100 ng/ml),实验组培养基中加入EGF (100 ng/ml)。在干预后24、48、72 h进行细胞迁移检测或收集T84细胞,用于TJs蛋白的Western blot检测。
1.3Westernblot检测从每个样品中取出20 μg总蛋白,通过4%~20% SDS-PAGE电泳分离,并使用半干转印系统(Bio-Rad)转印到聚偏氟乙烯(PVDF)膜上。将PVDF膜在封闭溶液封闭2 h,加适当比例稀释的一抗孵育过夜。抗体稀释浓度:小鼠抗claudin-1抗体、小鼠抗claudin-5抗体、兔抗claudin-3抗体、兔抗claudin-7抗体、兔抗occludin抗体、兔抗Zo-1抗体、兔抗claudin-3磷酸化抗体、兔抗claudin-5磷酸化抗体,以及兔抗claudin-7磷酸化抗体、兔抗β-tubulin抗体等均以1 ∶200比例来稀释。以PBST洗涤PVDF膜4次。每次15 min,再加辣根过氧化物酶结合的二抗,稀释比例1︰1 000。最后将免疫复合物用辣根过氧化物酶底物的化学发光剂来显影,拍照留存。
1.4细胞迁移实验本实验使用划痕的方法来评价EGF对细胞迁移的影响。T84细胞培养至单层融合状态,并在DMEM/F12(不含胎牛血清)培养基中过夜。用无菌的20 μl加样枪头在细胞中央划痕,再用DMEM/F12洗去漂浮的细胞。划痕后的对照组培养基中加入DMSO(100 ng/ml),实验组培养基中加入EGF(100 ng/ml)。分别于干预后24 h和48 h,在相同的位置用倒置显微镜(型号IX71,日本奥林巴斯公司)拍照,评价细胞迁移的速度[5]。
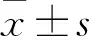
2 结果
2.1EGF对T84细胞TJs蛋白的表达和磷酸化的影响与对照组比较,EGF干预过的T84细胞在48 h后磷酸化claudin-3水平明显下降(t=7.024,P<0.05),非磷酸化claudin-3水平升高(t=-6.874,P<0.05);EGF干预过的T84细胞在24 h和72 h后,非磷酸化claudin-3及磷酸化claudin-3与对照组比较均无明显变化。见图1。与对照组比较,EGF干预过的T84细胞在48 h后磷酸化claudin-5水平升高(t=-13.115,P<0.05),非磷酸化claudin-5水平在72 h后明显下降(t=5.356,P<0.05);EGF干预过的T84细胞在24 h后,非磷酸化claudin-5及磷酸化claudin-5与对照组比较均无明显变化。见图2。与对照组比较,EGF干预过的T84细胞在48 h后磷酸化claudin-7水平升高(t=-7.116,P<0.05),非磷酸化claudin-7水平没有变化;EGF干预过的T84细胞在24 h和72 h后,非磷酸化claudin-7及磷酸化claudin-7与对照组比较均无明显变化。见图3。与对照组比较,EGF干预过的T84细胞在48 h后非磷酸化claudin-1水平升高(t=-10.337,P<0.05);非磷酸化occludin水平在各时间点与对照组相比均无变化;非磷酸化Zo-1水平在EGF干预24 h后高于对照组(t=-10.337,P<0.05),48 h后与对照组比较,差异无统计学意义,72 h后有所下降(t=-10.987,P<0.05)。见图4。
2.2EGF对T84结肠细胞迁移的影响划痕后24 h,EGF干预过的T84细胞和对照组的迁移率分别为(37.48±3.82)%和(21.37±2.35)%,EGF干预组迁移率高于对照组(t=-8.831,P<0.05),这一趋势在48 h后更为明显,EGF干预组和对照组迁移率分别为(50.35±5.43)%和(23.83±2.63)%(t=-11.105,P<0.05)。见图5。
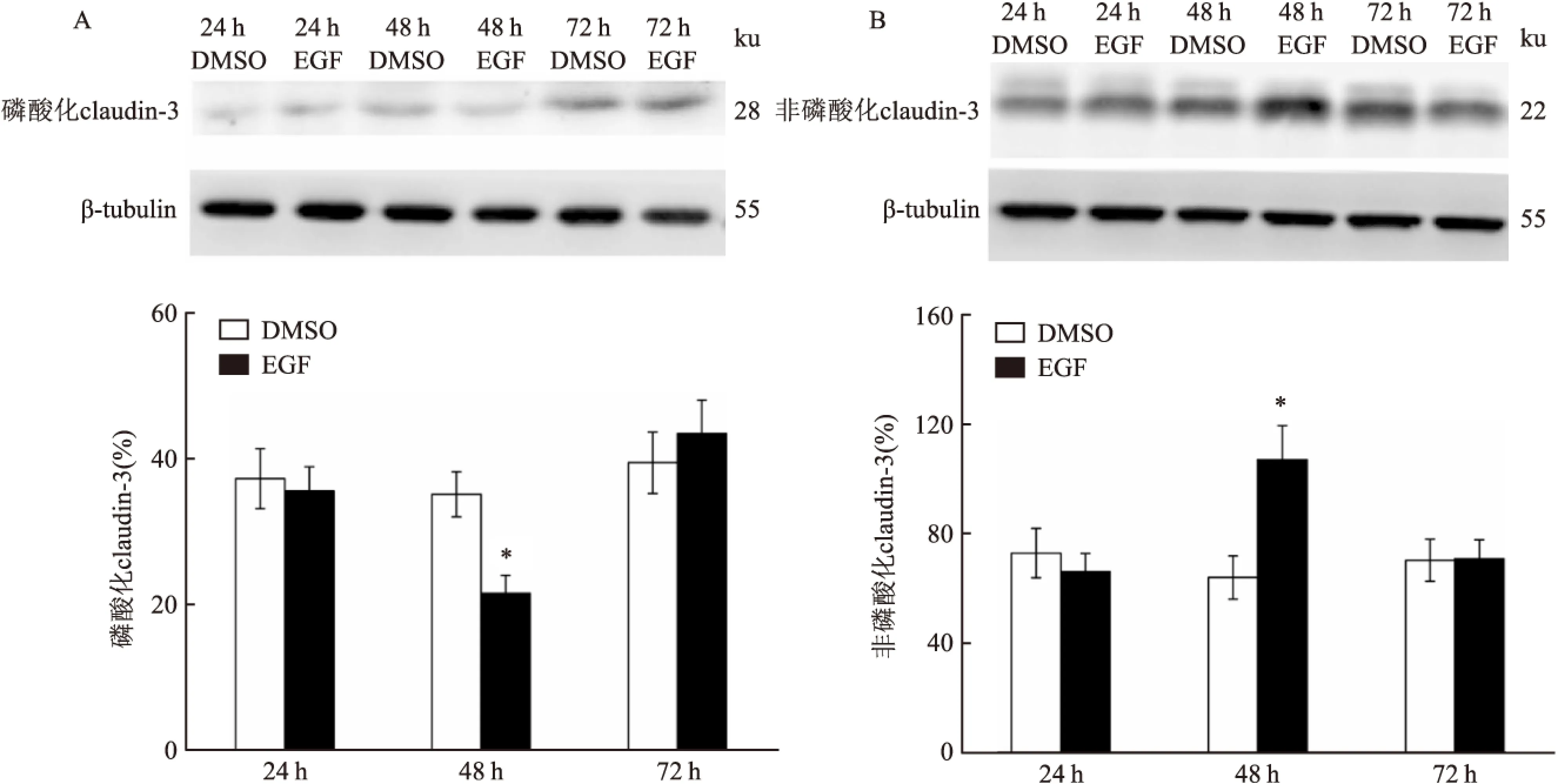
图1 Western blot检测EGF对T84 结肠细胞中claudin-3蛋白磷酸化的影响

图2 Western blot 检测EGF对T84 结肠细胞中claudin-5蛋白磷酸化的影响

图3 Western blot 检测EGF对T84 结肠细胞中claudin-7蛋白磷酸化的影响
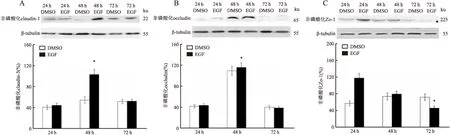
图4 Western blot 检测EGF对T84 结肠细胞中claudin-1、occludin、Zo-1蛋白表达的影响

图5 EGF 对T84 结肠细胞损伤/修复的影响 ×100
3 讨论
TJs位于上皮细胞和内皮细胞的顶层结构中,形成一个生理性屏障来调节各种溶质经细胞旁的渗透。TJs蛋白包括claudin亚型、occludin和Zo亚型,是细胞主要的跨膜蛋白,相互之间形成连续的紧密连接束,并以组织特异性的方式相互作用,在上皮细胞间形成电荷和孔道选择性屏障[6]。文献[7-8]报道,在实验性结肠炎模型中,可出现claudin亚型、occludin和Zo亚型的表达下调,并且这种效应常伴有肠上皮层通透性的增加,以及上皮屏障功能的受损。研究[9]表明,蛋白的翻译后修饰异常与疾病的发生发展关系密切,TJs蛋白的翻译后修饰包括棕榈化、O-糖基化和磷酸化。TJs蛋白的磷酸化是调节肠上皮细胞层通透性的重要方法。
某些TJs蛋白亚型适度的磷酸化是维持其生理功能所必须的;不过,TJs蛋白异常磷酸化会改变其彼此间的结合方式,从而影响TJs的聚集和结构的稳定性,使跨上皮细胞层电阻和上皮细胞间通透性发生变化,最终影响到上皮屏障的功能[10]。蛋白激酶C诱导的磷酸化使claudin-3参与装配TJs的位点减少,导致TJs强度的下降[11]。claudin-5的酪氨酸磷酸化与脑血管内皮细胞层的通透性增加有关,使单核细胞更容易通过损伤的血脑屏障[12]。在肾上皮细胞系,claudin-7磷酸化水平的升高与细胞间氯离子通透性增加有关[13]。TJs蛋白在UC时的磷酸化状态至今未有文献报道。
Guntaka et al[14]发现低氧诱导了胆管上皮细胞claudin-3的磷酸化,伴随TJs结构破坏和上皮屏障功能损伤,应用EGF可以降低claudin-3水平磷酸化,修复胆管上皮屏障。本研究显示,EGF影响了肠上皮细胞TJs蛋白的表达及磷酸化。与对照组比较,EGF干预过的T84细胞在48 h后磷酸化claudin-3水平明显下降,非磷酸化claudin-3水平升高,这与文献报道一致。此外,EGF干预过的T84细胞在48 h后磷酸化claudin-5、claudin-7水平升高,72 h后非磷酸化claudin-5水平明显下降,非磷酸化claudin-7水平没有变化。实验结果表明,EGF 可以调节claudin亚型的磷酸化水平。文献[15]报道中枢血管内皮细胞中claudin-5、claudin-7的磷酸化与内皮屏障功能受损有关,而本试验未曾探讨病理状态下T84细胞中TJs蛋白的磷酸化状况,仅提示EGF 可以调节提高claudin-5、claudin-7的磷酸化水平,其临床意义有待进一步实验研究。
本试验还观察到,EGF干预过的T84细胞在48 h后非磷酸化claudin-1水平升高,非磷酸化occludin水平在各时间点与对照组相比均无变化,而非磷酸化Zo-1水平在EGF干预24 h后即升高,48 h后与对照组差异无统计学意义,72 h后有所下降。以上结果表明EGF可以调节TJs蛋白的表达。EGF还对细胞划痕/修复有一定作用,表现为EGF干预过的T84细胞迁移率明显高于对照组,提示EGF可能有助于肠黏膜损伤的修复,与文献[16]报道一致。TJs蛋白的磷酸化使得其参与装配TJs的位点减少[11],因而细胞间连接功能减弱,细胞迁移功能增强;本研究显示EGF改变了细胞claudin蛋白的磷酸化状态,同时促进了上皮细胞的迁移,提示EGF介导的TJs蛋白磷酸化有助于上皮细胞的损伤后修复。
综上所述,EGF可以影响肠上皮细胞间TJs蛋白的表达和磷酸化状态,并促进损伤上皮细胞的修复。EGF对UC的治疗作用是否与此有关,以及其具体机制,有待进一步探讨。
