BMP4对神经干细胞分化的影响及分子机制的研究
2018-11-07宋旆文申才良
夏 翔,宋旆文,牛 杨,杨 超,申才良
严重的脊髓损伤(spinal cord injury,SCI)会造成不同形式的瘫痪,目前来说仍然无十分有效的治疗,这带来了巨大的个人和社会经济损失[1]。近年来随着干细胞研究的兴起,为治疗SCI以及类似神经系统疾病带来了新希望。但是研究[2]显示,损伤后无论是内源性的神经干细胞增生,还是移植的外源性神经干细胞,均不能有效的分化为神经元或者少突胶质细胞等神经功能细胞,而是较多的分化为星形胶质细胞。然而星形胶质细胞在损伤局部主要形成胶质瘢痕,阻碍了轴突的再生,抑制了神经功能的恢复[3]。研究[4-6]显示骨形态发生蛋白(bone morphogenetic protein,BMP)(BMP2/4/7)蛋白在损伤局部高表达,同时高表达的BMP会促进星形胶质细胞的分化,抑制神经元的分化。本实验通过体外培养神经干细胞(neural stem cells,NSCs),添加外源性BMP4蛋白以及其受体拮抗剂Noggin蛋白,观察其对NSCs分化的影响以及探索其可能的分子机制。
1 材料与方法
1.1材料DMEM/F12 细胞培养液和胎牛血清 (FBS) 以及B-27细胞因子(美国Gibco公司);细胞表皮生长因子(epidermal growth factor,EGF) 和碱性细胞成纤维生长因子(basic fbroblast growth factor,bFGF)(美国PeproTech公司);兔抗小鼠胶质纤维酸性蛋白 (glial fibrillary acidic protein,GFAP)抗体、兔抗小鼠-Id2抗体(美国Abcam公司);pSamd1/5/8抗体 (美国Cell Signaling公司);包被用左旋氏多聚赖氨酸(Poly-L-Lysine)(美国Sigma公司);ECL蛋白显影液试剂盒、BCA 蛋白定量检测试剂盒(美国Pierce公司);Transwell培养板(美国Corning公司);Dapi、免疫荧光一抗稀释液、免疫荧光二抗稀释液、青/链霉素溶液、即用型胰蛋白酶细胞消化液、抗荧光淬灭封片液(上海碧云天公司);BMP-4蛋白(美国Peprotech公司)。18 mm细胞爬片(江苏世泰公司),超净工作台(香港力康公司HFsafe-1200LC Healforce),细胞培养箱(美国希尔顿公司),手术解剖显微镜(奥林巴斯SZ51,日本),荧光显微镜(尼康80i,日本)。SPF级SD新生乳鼠购自安徽省实验动物中心。
1.2NSCs的培养取1只24 h内新生SD乳鼠,用70%酒精消毒后断头,依次剪开皮肤、颅骨,迅速取出脑组织置于冰上含有预冷PBS液的培养皿中。弃去小脑部分,在解剖显微镜的帮助下,彻底去除每个皮层的脑膜以及血管,将清理好的脑组织用眼科剪剪成约1 mm3小碎块,加入1.5 ml胰酶,将组织和胰酶混悬液置于细胞培养箱中消化7 min,用2 ml含有10% FBS的DMEM/F12终止消化,用微量移液枪轻轻吹打使细胞尽可能分散,200目滤网滤过去除未消化组织,将细胞悬液移入15 ml离心管,然后1 000 r/min离心5 min,再次加入适量PBS吹打悬浮细胞,然后1 000 r/min离心5 min,尽量去除上清液,将其沉淀重新悬浮于5 ml的NSC增殖培养基中(DMEM/F12培养基,加入2% B27补充剂、20 ng/ml EGF和20 ng/ml FGF以及1%青/链霉素溶液)。将细胞以1×105/ml的密度接种于T25细胞培养瓶中。然后将细胞放在37 ℃、5% CO2温箱中培养,每3 d更换1次培养液,直至第7天,当NSCs增殖形成悬浮球,进行传代。
1.3NSCs体外分化实验将预先灭菌的细胞爬片置于6孔细胞培养板中,用1%多聚赖氨酸包被60 min,吸去多余的多聚赖氨酸,蒸馏水洗2遍每次5 min,将包被好的细胞爬片,连同6孔细胞培养板放在37 ℃细胞培养箱中晾干,选取生长状况良好的2代或者3代细胞进行下一步的实验,1 000 r/min离心5 min,弃去上清液,用不含EDTA的胰酶将细胞消化1 min,用2 ml含10% FBS的DMEM/F12终止消化,1 000 r/min离心5 min,弃去上清液,吹散细胞,将细胞用增殖培养液培养24 h,待细胞完全贴壁,吸去培养液,重新加入分化培养基中培养,分为3组:BMP4组(分化培养基为DMEM/F12基础培养液,添加20 ng/ml BMP4蛋白以及1%青/链霉素溶液)、BMP4+Noggin组(分化培养基为DMEM/F12基础培养液,添加20 ng/ml BMP4蛋白以及200 ng/ml Noggin蛋白以及1%青/链霉素溶液)、Control组(分化培养基为DMEM/F12基础培养液以及1%青/链霉素溶液),待到分化第7天进行下一步实验。
1.4NSCs分化的鉴定取爬片7 d后分化状态良好的细胞,吸出培养基,沿培养板侧壁轻轻加入适量PBS清洗2次,每次5 min(为了防止细胞被吹离爬片以后每步加液均按此步骤进行),用经预热的4%多聚甲醛固定细胞20 min,PBS洗3次,每次5 min,用预先配好的0.3% Triton X-100,洗1次、5 min,TBS清洗1次、5 min,PBS清洗2次,每次5 min,5%BSA在37 ℃温箱孵育封闭1 h,尽量吸去多余的BSA,孵育1抗,兔抗鼠GFAP 1 ∶1 000,4 ℃湿盒内孵育过夜,第2天取出在室温下放置40 min,TBS洗1次、5 min,PBS洗3次,每次5 min。加二抗:山羊抗兔IgG-Cy3(1 ∶100);室温下,避光孵育1 h,以后操作都在避光下进行,TBS洗1次,PBS洗2次,每次5 min,用Dapi染核10 min,PBS洗3次,每次5 min。用吸水纸吸光玻片周围水使玻片干燥,加抗荧光淬灭剂封片,4 ℃避光保存,荧光显微镜(日本尼康80i)拍照。
1.5Westernblot检测将 NSCs接种在经0.1%多聚赖氨酸包被的玻片上,其中BMP组加入20 ng/ml BMP4,BMP4+Noggin组加入20 ng/ml BMP4和200 ng/ml Noggin,Control组加入等量的PBS,贴壁培养7 d。提取各组细胞分化后的总蛋白,用BCA蛋白定量检测试剂盒测定各组蛋白含量,确定电泳上样量为20 μg, 蛋白行10% SDS-PAGE凝胶电泳,PVDF转膜,非特异性封闭。加入一抗pSmad1/5/8、Id2兔多抗,所使用抗体稀释浓度为GAPDH(鼠单抗,1 ∶1 000)、GFAP(兔多抗,1 ∶1 000)、pSmad1/5/8(兔多抗,1 ∶500)、Id2(兔多抗,1 ∶1 000)。4 ℃ 冰箱内孵育过夜,加入对应的二抗; 4 ℃孵育1 h,用ECL发光剂时间为5 min,通过进行曝光、显影、定影一系列操作后使用数码分析成像软件对实验结果进行统计分析,用目的蛋白的灰度值表示相对表达的目的蛋白水平。
1.6细胞计数荧光显微镜用于检查免疫染色的细胞。 为了确定表达GFAP的细胞数量,由未参与该项试验,并且熟悉统计学方法的人员,随机选择每个玻片的20个视野进行细胞计数。 结果表示为GFAP阳性细胞(星形胶质细胞)数量相对于DAPI阳性细胞总数的百分比。
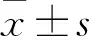
2 结果
2.1BMP4对NSCs分化的影响用GFAP进行特异性荧光免疫染色,鉴定不同分组星形胶质细胞的分化,红色为GFAP特异性标记星形胶质细胞(图1A)。细胞计数检测GFAP阳性细胞的表达,与Control组(阳性率64.9%±2.04%)相比,BMP4组(阳性率94.6%±1.49%)的GFAP表达显著增加。与BMP4组相比,BMP4+Noggin组(阳性率31.6%±1.21%)中表达GFAP的细胞的阳性率显著降低(F=381.1,P<0.01)(图1B)。同时用Western blot检测GFAP蛋白的表达,发现与Control组相比,BMP4组的蛋白表达明显升高;与BMP4组相比,BMP4+Noggin组的蛋白表达明显减少(F=126.2,P<0.01),见图2。
2.2BMP4对pSmad1/5/8蛋白表达的影响用蛋白质免疫印迹技术检测分化7 d的Control组、BMP4组和BMP4+Noggin组中pSmad1/5/8蛋白的表达。发现BMP4组中pSmad1/5/8的表达显著高于对照组和BMP+Noggin组(F=2 149,P<0.01),见图3。

图1不同分化条件下NSCs免疫荧光GFAP阳性表达
A:星形胶质细胞的免疫荧光染色鉴定 ×200;红色:GFAP标记星形胶质细胞;蓝色:Dapi标记细胞核;合成:将细胞与细胞核进行融合;B:NSCs分化为星形胶质细胞的阳性率表达比较;与Control组比较:**P<0.01;与BMP4+Noggin组比较:##P<0.01

图2 NSCs分化后GFAP蛋白表达量的比较
与Control组比较:**P<0.01;与BMP4+Noggin组比较:##P<0.01
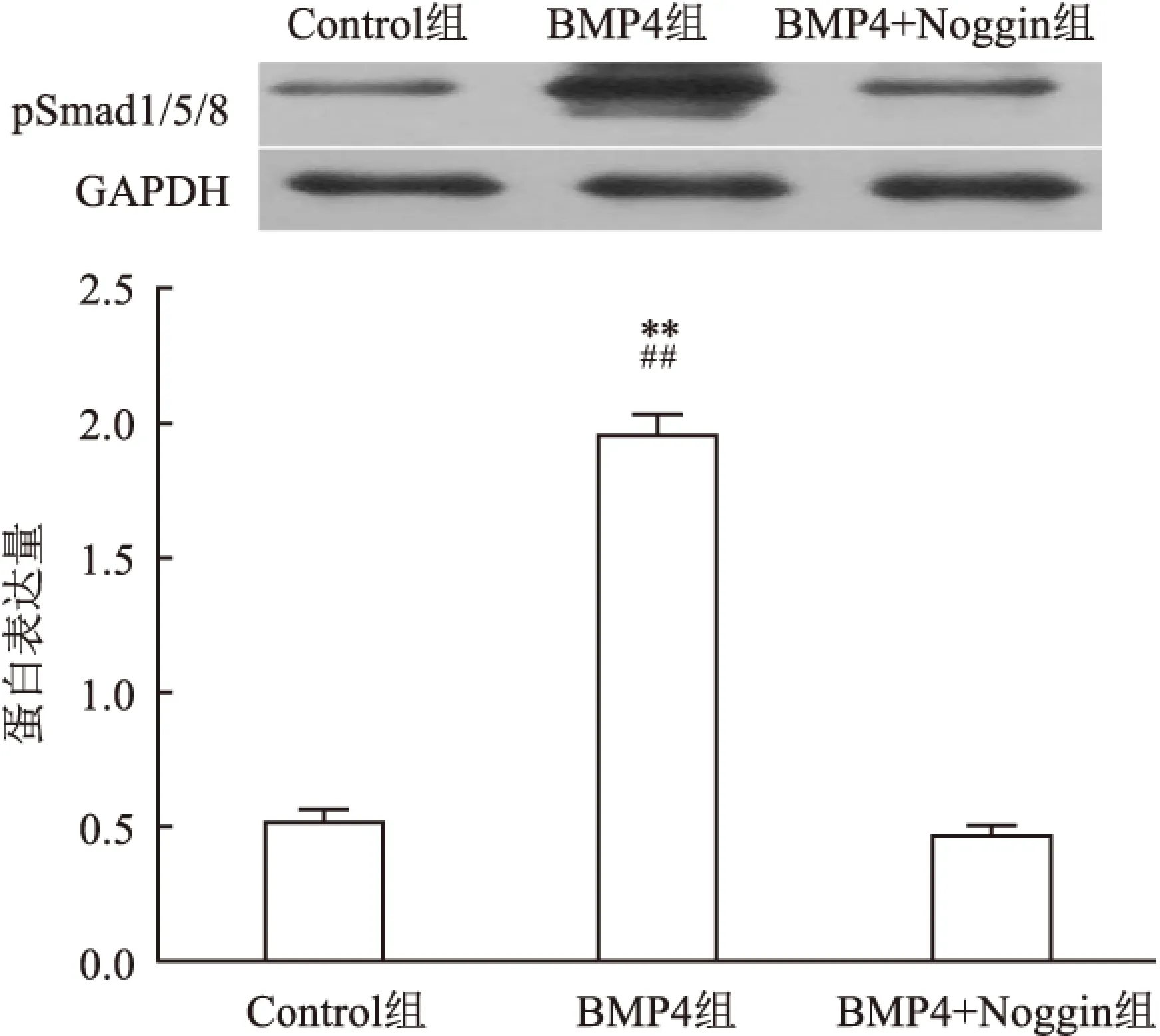
图3 NSCs分化后pSmad1/5/8蛋白表达量的比较
与Control组比较:**P<0.01;与BMP4+Noggin组比较:##P<0.01
2.3BMP4对Id2蛋白表达的影响通过Western blot 检测不同分组中Id2蛋白的表达水平。 BMP4组Id2蛋白的表达显著高于Control组和BMP4+Noggin组(F=978.9,P<0.01),见图4。

图4 NSCs分化后Id2蛋白表达量的比较
与Control组比较:**P<0.01;与BMP4+Noggin组比较:##P<0.01
3 讨论
本实验检测了BMP信号通路中pSmad1/5/8及其下游Id2蛋白的表达,同时用星形胶质特异性抗体、GFAP进行免疫荧光染色,检测星形胶质细胞的表达。证实了BMP4在NSCs分化过程中通过上调Id2的表达,促进了星形胶质细胞的分化。
BMP是信号传导配体转化生长因子β(transforming growth factor-β,TGF-β)超家族的成员。其通过信号转导进入细胞核进行转录调控,BMP在神经发生和星形胶质发生过程中起着动态的作用[4]。BMP4作为BMPs家族中重要的一员,在体内外的实验中被证实可以抑制NSCs向神经功能细胞分化,抑制了神经功能的恢复[3],研究[6]显示,BMP的应用可以减少NSCs向少突胶质细胞的分化,并促进其向星形胶质细胞的分化。这与本研究结果BMP4增加NSCs分化中星形胶质细胞的表达是一致的。然而BMP是通过何种途径增加星形胶质细胞的分化,其具体机制并不十分清楚,因此探索其可能的分子机制十分必要,这也是本实验重点。
骨形态发生蛋白通过BMP信号通路和信号通路下游受体(Smad1/5/8)发挥生物学作用,其中受体的磷酸化发挥着不可或缺的作用,当BMP信号通路激活,其使下游受体Smad1/5/8磷酸化,同时磷酸化的Smad1/5/8(pSmad1/5/8)可以进入细胞核内调控目的基因的转录。本研究通过免疫荧光染色检测星形胶质的细胞表达,以及Western blot检测GFAP蛋白和pSmad1/5/8蛋白的表达,结果表明BMP4的应用可以促进NSCs分化为星形胶质细胞,同时pSmad1/5/8蛋白表达增加,加入BMP受体拮抗剂Noggin后,随着pSmad1/5/8的表达减少,GFAP表达显著降低。此结果与其他研究的结果一致,因此认为BMP4可以通过BMP-Smad1/5/8信号通路促进了星形胶质细胞的分化[7],初步探索了其可能的分子机制。
Id家族是细胞命运的重要调节因子,包括增殖、分化和凋亡,Id蛋白的高表达可以抑制神经元的分化,促进星形胶质细胞的分化[8]。Id2是Id家族中最重要的成员之一,在调节细胞增殖和维持细胞多样性和分化方面起着至关重要的作用[9]。 研究[10]表明,在SCI早期,Id蛋白的表达显著增加,这与损伤后BMP表达的增加是相一致的,同时Id蛋白的高表达促进了损伤部位星形胶质细胞的分化。有研究[11]表明BMP2可以上调下游基因Id2的表达,促进少突胶质前体细胞向星形胶质细胞的分化,同时抑制了这些细胞分化为少突胶质细胞。因此推测BMP使体外培养的NSCs星形胶质细胞分化增多,是由Id蛋白表达增加介导的。为了探索Id蛋白在NSCs分化过程中的作用,本研究通过Western blot检测不同组中Id2蛋白的表达。发现随着BMP信号通路的激活,Id2蛋白表达增加。然而使用Noggin抑制BMP信号通路时,Id2的表达显著减少。因此BMP4可以通过BMP-Smad1/5/8信号通路调节Id2基因的表达,这相关研究[12]结果是一致的。本实验证实BMP4能够通过BMP-Smad1/5/8信号通路上调Id2的表达,促进NSCs分化为星形胶质细胞,同时确定了Id基因在NSCs分化中的作用。
综上所述,本实验通过NSCs体外分化证实了BMPs可以激活BMP-Smad1/5/8信号通路上调Id2的表达,从而促进星形胶质细胞的分化,确定了其可能的分子机制。本实验的结果为如何调控SCI后星形胶质细胞的分化进而调控胶质瘢痕大小提供了新的思路。本研究的局限性是没有进行动物实验来进一步证实本实验的结论,这将是下一个研究重点。
