中药消水方对Lewis肺癌小鼠恶性胸腔积液生成及水通道蛋白1表达的影响
2018-11-07颜琳琳关江锋胡作为
王 兵,颜琳琳,关江锋,胡作为,王 珊,侯 炜
恶性胸腔积液(malignant pleural effusion,MPE)是肺癌常见的并发症之一[1]。可以导致患者胸闷、气促、咳嗽、胸痛、呼吸困难,影响心肺功能,加快肿瘤扩散,严重时可危及生命。据统计肺腺癌MPE患者的中位总生存期仅为14.3~21.4个月[2]。临床上恶性肿瘤一旦合并胸腔积液,就意味着病变已局部或全身扩散,预后极差,是手术不能治愈的晚期疾病标志,此时治疗的主要目的是有效地控制胸腔积液,缓解临床症状,提高生活质量,延长生存期。中医药以其独特的优势,在MPE的治疗中逐渐发挥了重要作用,近年来许多学者进行了大量中医药治疗MPE的临床研究[3-4],表明中医药在治疗MPE方面确实具有一定优势,但是有关作用机制研究却较少开展。
中药消水方是中国中医科学院广安门医院肿瘤科沿用多年的经验方,前期临床研究显示中药消水方口服联合顺铂胸腔灌注治疗MPE 65例,有效率达72.3%,并能明显缓解临床症状,提高免疫功能,延长生存时间[5-6]。水通道蛋白(aquqporin,AQPs)是近年来发现的在机体水液代谢中起着重要作用的跨膜转运蛋白[7],到目前为止共发现13个亚型,AQP 0~12存在于人体的多个组织器官[8],研究[9-10]显示AQP1在小鼠胸膜间皮细胞上广泛表达,且在MPE的产生中也发挥了重要作用。因此推测消水方可能通过影响AQP1表达从而发挥抑制MPE的作用, 该研究通过建立小鼠肺癌MPE模型,采用消水方干预后检测胸膜AQP1表达,深入探讨中药抑制MPE的可能机制。
1 材料与方法
1.1动物及细胞株SPF级6~8周龄雄性C57BL/6小鼠,(20±2)g,由中国医学科学院医学实验动物研究所提供,许可证号:SCXK(京)2004-0001。饲养于中国中医科学院广安门医院清洁级动物中心,许可证号:SYXK(京)2005-0001。所有动物在进行实验前均环境适应性饲养1周以上。带有荧光标记的小鼠Lewis肺癌细胞株(C57BL/6来源)由美国国立癌症研究所惠赠。
1.2药物中药消水方组成:葶苈子30 g,生黄芪15 g,刺五加15 g,醋莪术10 g,炒白术15 g,黄芩10 g,大枣15 g,全瓜蒌15 g,徐长卿15 g,半枝莲30 g,车前子30 g,茯苓15 g等。各药物均由中国中医科学院广安门医院中药房提供,并经该院药剂科王丽霞主任药师鉴定为正品。分别5、2.5倍水量煎煮2次,混合过滤,蒸发浓缩制成1 g生药/ml药液于4 ℃冰箱保存备用。
1.3试剂荧光素酶底物D-Luciferin购自冷泉港生物科技股份有限公司;异氟烷购自河北九派制药有限公司;TRIzol Reagent、UltraPure Agarose、High Capacity RNA-to-cDNA Kit、TapMan Gene Expression Master Mix、TaqMan Gene Expression Assays均购自美国Life Technologies公司;兔抗鼠AQP1抗体、β-actin内参抗体均购自美国Abcam公司;山羊抗兔IgG-HRP、BCA蛋白浓度测定试剂盒(增强型)、PVDF膜、BeyoECL Plus均购自江苏碧云天生物技术研究所。
1.4主要仪器IVIS Lumina II小动物活体成像系统购自美国Caliper公司;NanoDrop 2000超微量分光光度计购自美国Thermo Scientific公司;Progene PCR 扩增仪购自英国Techene公司;Applied Biosystems 7500 Fast实时荧光定量PCR仪购自美国ABI公司;水平电泳槽、垂直电泳槽、电转移槽、电泳仪、Bio-Rad ChemiDoc XRS凝胶成像系统购自美国Bio-Rad公司;DYY-12型电脑三恒多用电泳仪购自北京六一仪器厂;Synergy HT型酶标仪购自美国Biotek公司;3-30K型高速冷冻离心机购自美国Sigma公司;TS100型光学倒置显微镜购自日本Nikon公司;MCO-18AIC CO2细胞培养箱购自日本Sanyo公司。
1.5方法
1.5.1小鼠肺癌胸腔积液模型建立及实验分组 小鼠肺癌胸腔积液模型参照文献[11-12]方法并加以改良:Lewis肺癌细胞复苏后加入培养液置于CO2培养箱培养,收集处于对数生长期生长状态良好的细胞,加入PBS缓冲液调整细胞终浓度为2.5×106/ml。接种前用75%酒精消毒小鼠胸部右侧皮肤,用1 ml注射器吸取细胞悬液,轻轻摇动使细胞混匀,从小鼠右侧胸部靠近腋中线,约平第6肋间隙,针头向上与胸壁成30°夹角,注射入胸腔,接种量为2.5×106/ml的细胞悬液0.2 ml/鼠。空白组小鼠于同一位置胸腔内注射相同体积的PBS缓冲液。活体成像可见小鼠胸腔荧光随着时间推移逐渐增强,并且解剖发现小鼠右侧胸腔存在血性胸水及鱼肉色肿瘤结节即为造模成功。取45只C57BL/6小鼠,随机分为中药组、模型组、空白组,按照上述方法造模,建模第3天后按如下给药:中药组:以33.5 g/(kg·d)生药药液,调整至0.2 ml予小鼠灌胃,1次/d;模型组:给予0.2 ml的生理盐水灌胃,1次/d;空白组:给予0.2 ml的生理盐水灌胃,1次/d。建模当天为第1天,3 d后即第4天起开始给药,总共用药10 d,第14天处死取材。
1.5.2活体成像动态观察胸腔荧光变化 三组各随机选取5只小鼠,分别于第3、8、13天时进行小鼠活体成像观察。实验时将荧光素酶底物置于室温融化,小鼠称重后,以10 μl底物/1g 鼠浓度计算每只小鼠所需底物体积,然后将相应体积荧光素酶底物注入小鼠腹腔内,35 min后置于小动物活体成像仪器内测量胸腔积液及胸壁荧光值。以肿瘤接种天数为横坐标,单位面积荧光值为纵坐标,绘制胸腔积液及移植瘤体内生长曲线。
1.5.3取材并测定胸腔积液体积 给药观察期结束后,过量麻醉处死小鼠,仰卧位进行解剖,沿腹中线暴露腹腔,剥离肝脏,暴露横膈膜,观察有无胸水形成,沿胸骨中线剪开胸壁,以1 ml注射器抽取双侧胸腔积液并准确记录其体积。将整个胸壁剪下,固定于解剖板上,手术尖刀切割壁层胸膜,置于-80 ℃冰箱保存用于后续检测。
1.5.4RT-PCR检测壁层胸膜AQP1 mRNA表达 取100 mg壁层胸膜组织,采用TRIzol法,通过匀浆、裂解、分离相、沉淀、洗涤、溶解等步骤提取胸膜中总RNA,使用超微量分光光度计测定RNA的浓度与纯度,并进行琼脂糖凝胶电泳验证其完整性。配制逆转录反应体系,按照实时荧光定量PCR仪操作手册进行转录成 cDNA,然后进行实时荧光定量PCR扩增。检测基因采用TapMan Gene Expression Assays的预混基因,包括待测基因AQP1(ID:Mm01326466_m1),内参基因GAPDH(ID:Mm99999915_g1)。将cDNA、待测基因与TapMan Gene Expression Master Mix混匀,转移至光学反应板上,覆盖光学反应膜,运行PCR反应程序,导出相对定量数据。以相对表达量(2-ΔΔCt)值表示目的基因mRNA表达。
1.5.5Western blot检测壁层胸膜AQP1蛋白表达 取壁层胸膜组织100 mg,加入RIPA裂解液,提取总蛋白,采用BCA法测定蛋白浓度并调整蛋白浓度一致,取等量蛋白上样,进行SDS-PAGE电泳,湿转至PVDF膜上,脱脂奶粉封闭2 h,加AQP1(β-actin作为内参)一抗4 ℃孵育过夜,洗涤,二抗室温孵育1 h,洗涤,ECL超敏化学发光法显色,置于凝胶成像系统拍照,Quantity One软件导出图片,并对各组条带光密度值进行分析。相对光密度值=处理组目标蛋白光密度值/处理组内参蛋白光密度值。
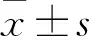
2 结果
2.1各组小鼠不同时间胸腔荧光水平空白组小鼠胸腔全程未见荧光出现,中药组和模型组小鼠在第3天时行活体成像观察可见两组荧光强度基本一致,差异无统计学意义(P>0.05);第8天成像时两组荧光强度开始表现出一定差异,但也无统计学意义(P>0.05);第13天成像时中药组荧光强度明显低于模型组荧光强度,差异有统计学意义(P<0.05)。见图1、2。
2.2各组小鼠胸腔积液量各组小鼠在给药观察期内均未见死亡,解剖发现空白组小鼠胸腔内壁光滑,未发现胸腔积液及胸壁移植瘤,如图3A、3B所示。而模型组和中药组小鼠胸腔均可见油腻性的血性胸腔积液,胸壁上多发肿瘤结节,小者呈颗粒样聚集,大者呈团块状生长,如图3C、3D、3E、3F所示。测量小鼠胸腔积液体积,结果显示中药组明显小于模型组,差异具有统计学意义(P<0.01),空白组无胸腔积液生成。见图4。
2.3各组小鼠壁层胸膜AQP1mRNA表达水平中药组和模型组小鼠壁层胸膜AQP1 mRNA表达水平较空白组均显著升高,差异有统计学意义(P<0.01);而中药组相比于模型组小鼠能明显降低AQP1 mRNA表达水平,差异有统计学意义(P<0.01)。见图5。

图1 各组小鼠活体成像时胸腔荧光图
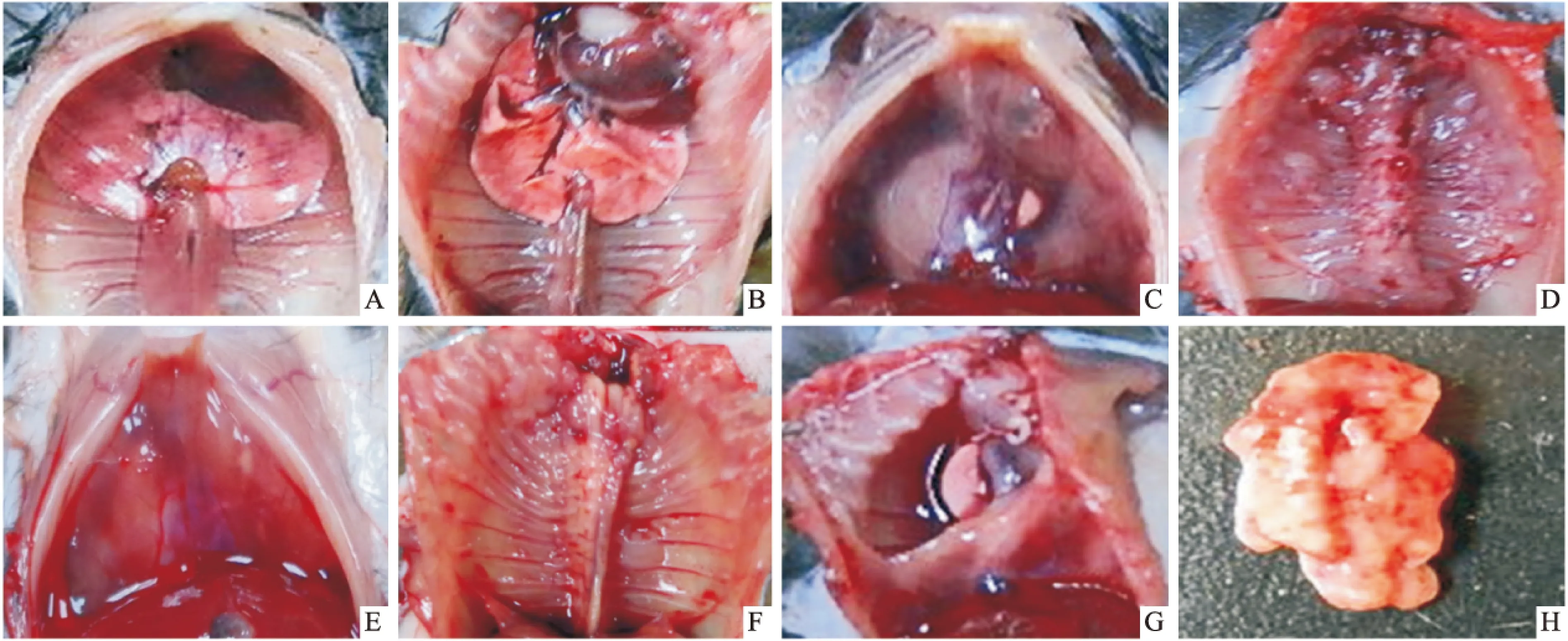
图3 各组小鼠胸腔解剖图
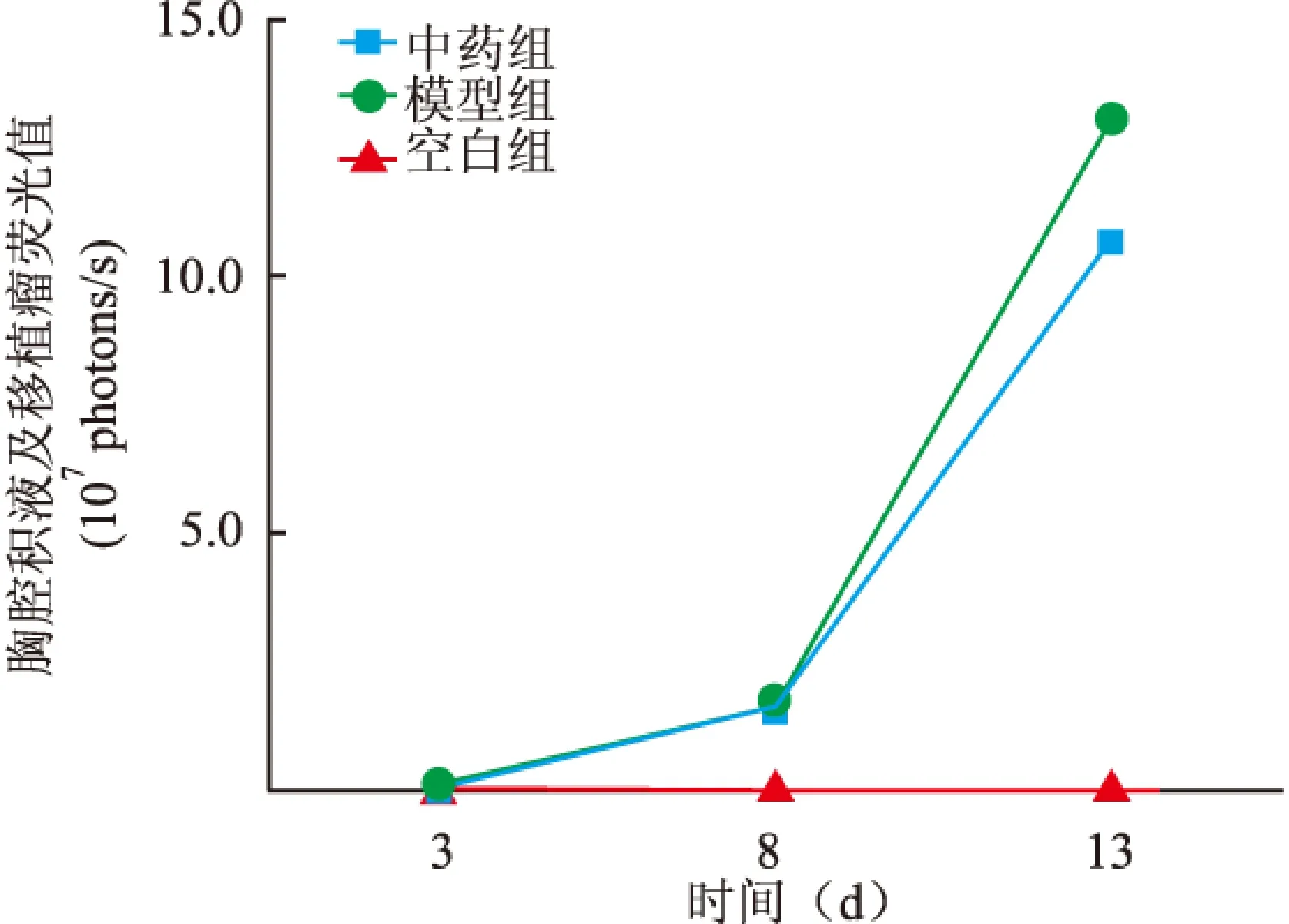
图2 各组小鼠胸腔荧光值变化折线图
1:中药组;2:模型组;3:空白组;与模型组比较:*P<0.01
2.4各组小鼠壁层胸膜AQP1蛋白表达水平模型组小鼠壁层胸膜AQP1蛋白表达水平显著高于空白组小鼠,差异具有统计学意义(P<0.01);中药组与模型组相比,能显著下调壁层胸膜AQP1蛋白表达,差异有统计学意义(P<0.01)。见图6。
图5 各组小鼠壁层胸膜AQP1 mRNA表达情况
1:中药组;2:模型组;3:空白组;与空白组比较:*P<0.01;与模型组比较:#P<0.01
3 讨论
传统观点认为MPE形成的主要机制为肿瘤转移至胸膜,刺激胸膜引起炎性反应,使脏壁层毛细血管通透性增高,大量液体渗出,或肿瘤组织阻塞淋巴管,而致淋巴液流体静压升高,影响淋巴液的回流[13]。但随着现代分子生物学以及免疫学的迅猛发展,研究者发现胸膜自身以及胸膜腔局部肿瘤细胞、免疫细胞、微血管等相互作用形成的微环境在MPE的发生、发展中扮演了重要角色,主要机制包括Ang1/2(血管生成素1/2)[14]、IL-6/Stat3通路[15]、CXCR4/CXCL12趋化轴[16]、AQPs[10]、血管内皮生长因子(VEGF)[17]、Th17/Treg[18-19]细胞平衡等。
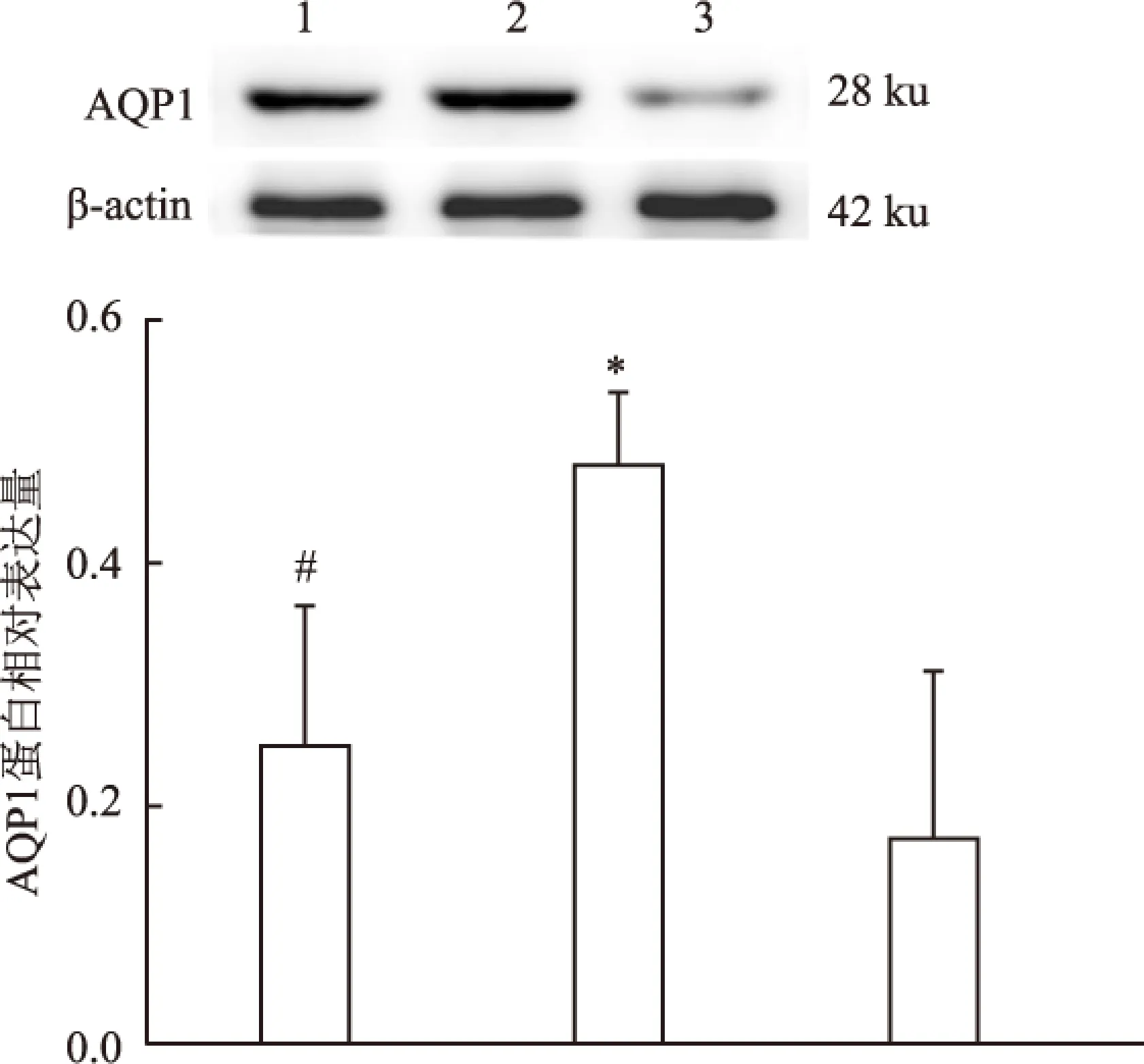
图6 各组小鼠壁层胸膜AQP1 蛋白表达情况
1:中药组;2:模型组;3:空白组;与空白组比较:*P<0.01;与模型组比较:#P<0.01
其中AQPs家族中的AQP1是一类分子质量相对较低的膜内嵌蛋白,其所介导的自由水快速被动的跨生物膜转运是水进出细胞的主要途径。AQP1表达在壁层和脏层胸膜表面,基本功能是维持胸膜腔中的液体流入与流出平衡,肿瘤微环境可能导致AQP1表达异常,影响毛细血管和间质的液体交换,引起胸腔渗透压改变,形成MPE,并且AQP1表达量与肿瘤恶性程度呈正相关性。因此本研究通过建立肺癌胸腔积液小鼠模型,发现模型组小鼠壁层胸膜AQP1 mRNA及蛋白表达相比于空白组小鼠均显著升高,这与文献[9-10]研究结果相符,证实肺癌MPE小鼠胸膜存在AQP1表达的失常。
MPE的中医治疗手段比较丰富,主要有中药复方口服、中药注射剂静滴或胸腔灌注及中药外敷等,而中药口服最能体现中医特色,具有多层次、多靶标的特点,在治疗MPE中发挥着整体调节作用。如王珏 等[20]发现泻肺逐饮汤可以降低MPE大鼠胸水和胸膜组织中转化生长因子-β1(TGF-β1)、AQP1、细胞毒T淋巴细胞相关抗原4(CTLA-4)、VEGF等的含量,同时提高穿孔素(PFP)的表达,从而抑制MPE生成。吴君 等[21]发现解氏肺癌二号方一方面可能通过降低小鼠血清VEGF和碱性成纤维细胞生长因子(bFGF)含量,阻断肿瘤血管生成,并降低血管通透性,减少积液渗出;另一方面还可上调白介素-2(IL-2)和γ干扰素(IFN-γ)表达,提高其免疫活性,增强免疫功能,达到防治MPE作用。
中药消水方是一张临床治疗MPE的有效经验方,本方主要由生黄芪、白术、茯苓、葶苈子、大枣、车前子、刺五加、醋莪术、全瓜蒌、徐长卿、半枝莲、黄芩等组成,以扶正培本为主,同时兼顾治气、治水、治血、抗癌四个层面,具有益气健脾、泻肺利水、祛瘀抗癌功用,适用于正虚邪盛,水湿瘀结为患之MPE。采用该方对肺癌小鼠MPE进行干预,结果显示消水方具有良好的抑制MPE生成的作用,相比于模型组(715±61)μl,中药组MPE体积仅为(268±79)μl,且中药组胸腔活体成像荧光强度明显低于模型组荧光强度,表明消水方不仅能够减少MPE,同时还可能对Lewis肺癌细胞本身具有一定抑制作用。
研究[22]显示本方的主要利水组分葶苈大枣泻肺汤可显著降低肺癌MPE模型小鼠壁层胸膜间皮细胞AQP1及其mRNA表达水平,从而减少MPE形成。该研究在此基础上进一步探讨了消水方抑制MPE的分子机制,采用RT-PCR及Western blot检测了各组小鼠壁层胸膜AQP1 mRNA以及蛋白表达情况,结果显示中药组相比于模型组小鼠能明显降低壁层胸膜AQP1 mRNA表达,同时下调AQP1蛋白表达。表明中药消水方可能通过下调壁层胸膜间皮细胞AQP1表达,促进胸腔MPE的转运,抑制MPE的形成。
