柴葛口服液对毛细支气管炎模型小鼠的免疫调节作用
2018-11-02秦小菀惠晓霞高伟霞郭洁金志鹏
秦小菀,惠晓霞,高伟霞,郭洁,金志鹏
(1.河南省南阳市中心医院 儿科急诊,河南 南阳 473000;2.郑州儿童医院 儿科,河南 郑州 450053)
毛细支气管炎多发生在2岁以内小儿,是婴幼儿常见的呼吸道疾病之一,多由呼吸道合胞病毒(respiratory syncytial virus,RSV)感染引起,咳嗽、喘憋和“三凹征”为其主要临床表现,是肺炎的一种特殊类型,临床治疗上尚无特效药物[1- 2]。柴葛口服液(葛根、柴胡、板蓝根、金银花、菊花、连翘、甘草、竹叶等组成)中的中药成分对细菌、病毒感染引起的腮腺炎、上呼吸道感染等疗效确切[3]。柴葛口服液对毛细支气管炎免疫功能的作用尚不清楚。本研究采用RSV感染建立毛细支气管炎小鼠模型,并给予柴葛口服液治疗,以利巴韦林为阳性对照,观察柴葛口服液对毛细支气管炎小鼠的治疗作用及对免疫功能的调节作用。
1 材料与方法
1.1 材料
实验动物:雌性、清洁级BALB/c小鼠60只,体重19~23 g,购自北京市医疗器械检验所,许可证号:SYXK(京)2015- 0006,饲养于河南省南阳市中心医院动物实验中心。病毒和细胞:RSV病毒A亚型(首都儿科研究所),Hep- 2细胞株(西京医院儿科实验室)。主要药物:柴葛口服液(重庆医科大学附属儿童医院临床药学室研制,批号20170122,含葛根素10 mg·ml-1、柴胡皂苷3 mg·ml-1),利巴韦林注射液(上海现代哈森药业有限公司,批号20150326,规格5 ml∶0.5 g)。主要试剂和仪器:RPMI 1640培养液、多聚甲醛、胰蛋白酶、小牛血清(美国Sigma公司),ELISA试剂盒、流式细胞仪(美国R&D公司)。
1.2 研究方法
1.2.1 小鼠分组及毛细支气管炎模型制备 将60只小鼠根据随机数字表法分为对照组、模型组、柴葛低剂量组、柴葛高剂量组、利巴韦林组,每组12只。除对照组外,其它各组均建立毛细支气管炎小鼠模型。建模方法:小鼠麻醉成功后顺小鼠鼻腔滴入RSV病毒液100 μl,滴鼻后保持小鼠头部后仰1 min使RSV病毒液流入小鼠支气管、气管部位,1次·d-1,共2 d;对照组同法用等量生理盐水滴鼻,1次·d-1,共2 d。
1.2.2 各组小鼠处理 感染病毒后,柴葛低剂量组和柴葛高剂量组分别给予柴葛口服液低剂量(根据柴葛中葛根素含量按临床用量计)(5.18 mg·kg-1·d-1)和高剂量(23.1 mg·kg-1·d-1)灌胃治疗,1次·d-1;利巴韦林组给予利巴韦林10 mg·kg-1·d-1灌胃治疗,1次·d-1;对照组和模型组给予0.5 ml生理盐水灌胃,1次·d-1;共7 d。7 d后采集各组小鼠外周血,然后处死小鼠用于实验。
1.2.3 肺组织病毒滴度测定 取小鼠肺组织匀浆,匀浆液2 500 r·min-1离心15 min,收集上清液,用病毒维持液稀释肺组织上清液成不同梯度,将Hep- 2细胞接种到96孔板中,每孔细胞接种10-1~10-8浓度上清液,并设立阴性对照,每天显微镜下观察细胞情况,计算第7天时病毒滴度。
1.2.4 肺指数测定 处死前称取小鼠体重,取各组小鼠肺组织称肺组织重量,小鼠肺指数=小鼠肺组织重量/小鼠体重。
1.2.5 肺组织病理学评分测定 取各组小鼠肺组织,采用常规HE染色,光镜下观察小鼠肺组织HE染色情况并拍照,计算小鼠肺组织病理学评分(1~2分不可能,3~4分可能,5~6分很可能,7分极可能,8~9分明确):分别从肺实质肺炎程度、血管周围浸润范围、细支气管腔渗出程度、细支气管及支气管周围浸润程度及范围对小鼠肺组织划分等级和累计评分,总分0~26分,评分越高,小时肺部炎性损伤程度越重。
1.2.6 外周血辅助性T细胞17(helper T cells 17,Th17)和调节性T细胞(regulatory T cells,Treg)测定 采用流式细胞仪检测各组小鼠外周血Th17和Treg细胞表达水平。
1.2.7 血清白细胞介素- 4(Interleukin- 4,IL- 4)、白细胞介素- 10(Interleukin- 10,IL- 10)、白细胞介素- 17(Interleukin- 4- 17,IL- 17)、转化生长因子- β(transforming growth factor- beta,TGF- β)水平测定 采用酶联免疫吸附测定(enzyme- linked immunosorbent assay,ELISA)法测定各组小鼠血清IL- 4、IL- 10、IL- 17、TGF- β水平。
1.3 统计学处理
2 结 果
2.1 各组肺组织病毒滴度和肺指数比较
模型组、柴葛低剂量组、柴葛高剂量组、利巴韦林组肺指数均高于对照组(P<0.05),柴葛低剂量组、柴葛高剂量组、利巴韦林组病毒滴度和肺指数均低于模型组(P<0.05),柴葛高剂量组病毒滴度和肺指数低于柴葛低剂量组和利巴韦林组(P<0.05),柴葛低剂量组和利巴韦林组病毒滴度和肺指数差异无统计学意义(P>0.05)。见表1。
2.2 各组肺组织病理学评分比较
模型组、柴葛低剂量组、柴葛高剂量组、利巴韦林组肺病理学评分均高于对照组(P<0.05),柴葛低剂量组、柴葛高剂量组、利巴韦林组肺病理学评分均低于模型组(P<0.05),柴葛高剂量组肺病理学评分低于柴葛低剂量组和利巴韦林组(P<0.05),柴葛低剂量组和利巴韦林组肺病理学评分差异无统计学意义(P>0.05)。见表2。
表1各组肺组织病毒滴度和肺指数比较
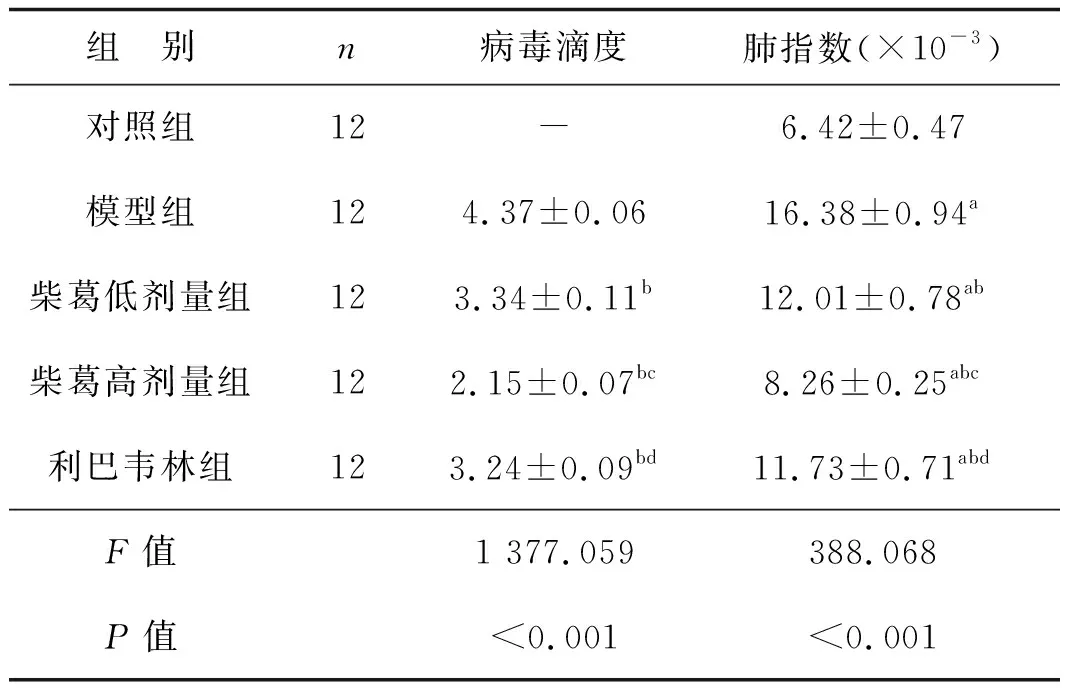
组 别n病毒滴度肺指数(×10-3)对照组12-6.42±0.47模型组124.37±0.0616.38±0.94a柴葛低剂量组123.34±0.11b12.01±0.78ab柴葛高剂量组122.15±0.07bc8.26±0.25abc利巴韦林组123.24±0.09bd11.73±0.71abdF值1 377.059388.068P值<0.001<0.001
与对照组比较,aP<0.05;与模型组比较,bP<0.05;与柴葛低剂量组比较,cP<0.05;与柴葛高剂量组比较,dP<0.05
表2各组肺组织病理学评分比较
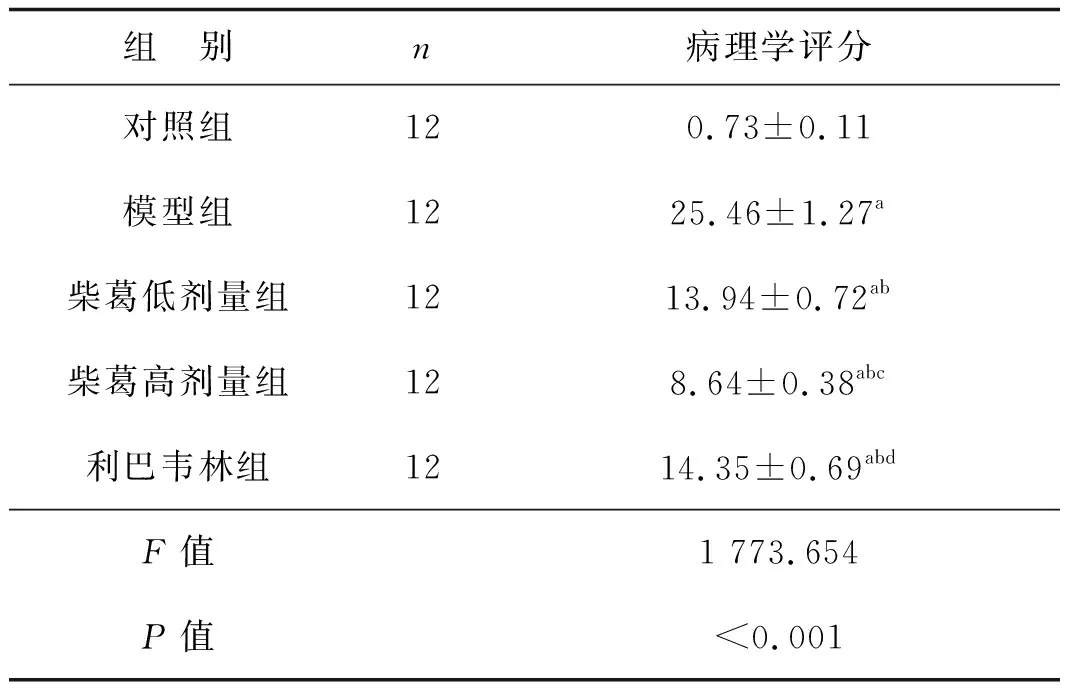
组 别n病理学评分对照组120.73±0.11模型组1225.46±1.27a柴葛低剂量组1213.94±0.72ab柴葛高剂量组128.64±0.38abc利巴韦林组1214.35±0.69abdF值1 773.654P值<0.001
与对照组比较,aP<0.05;与模型组比较,bP<0.05;与柴葛低剂量组比较,cP<0.05;与柴葛高剂量组比较,dP<0.05
2.3 各组外周血Th17和Treg细胞表达水平比较
模型组、柴葛低剂量组、柴葛高剂量组、利巴韦林组Th17细胞表达水平高于对照组(P<0.05),Treg细胞表达水平低于对照组(P<0.05);柴葛低剂量组、柴葛高剂量组、利巴韦林组Th17细胞低于模型组(P<0.05),Treg细胞高于模型组(P<0.05);柴葛高剂量组Th17细胞低于柴葛低剂量组和利巴韦林组(P<0.05),Treg细胞高于柴葛低剂量组和利巴韦林组(P<0.05);柴葛低剂量组和利巴韦林组Th17、Treg细胞差异无统计学意义(P>0.05)。见表3。
表3各组外周血Th17和Treg细胞表达水平比较
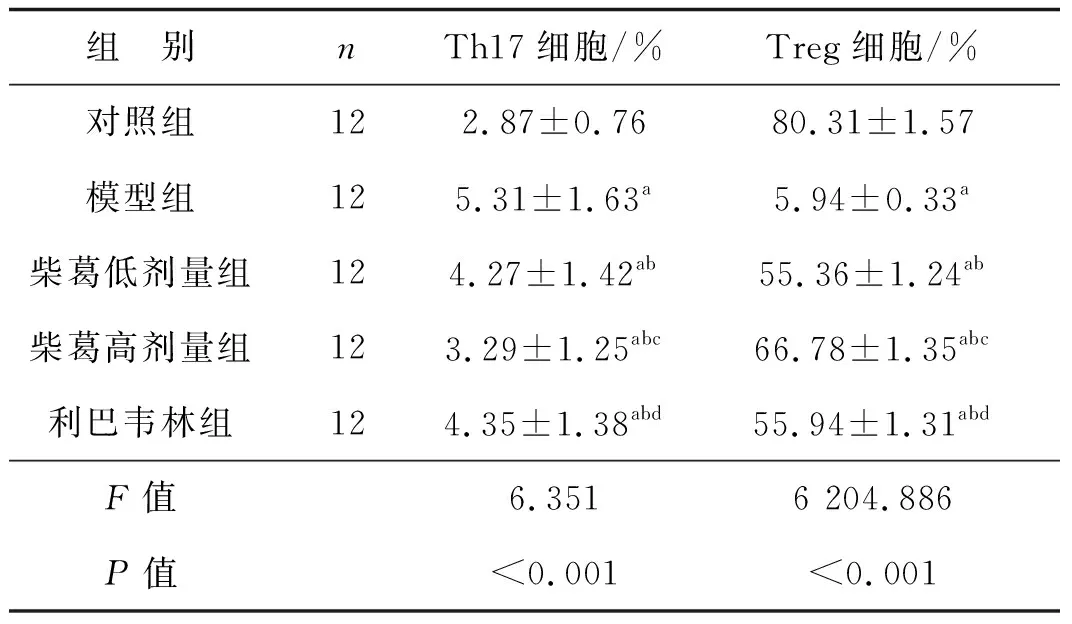
组 别nTh17细胞/%Treg细胞/%对照组122.87±0.7680.31±1.57模型组125.31±1.63a5.94±0.33a柴葛低剂量组124.27±1.42ab55.36±1.24ab柴葛高剂量组123.29±1.25abc66.78±1.35abc利巴韦林组124.35±1.38abd55.94±1.31abdF值6.3516 204.886P值<0.001<0.001
与对照组比较,aP<0.05;与模型组比较,bP<0.05;与柴葛低剂量组比较,cP<0.05;与柴葛高剂量组比较,dP<0.05
2.4 各组细胞因子水平比较
模型组、柴葛低剂量组、柴葛高剂量组、利巴韦林组IL- 4、IL- 17水平高于对照组(P<0.05),IL- 10、TGF- β水平低于对照组(P<0.05);柴葛低剂量组、柴葛高剂量组、利巴韦林组IL- 4、IL- 17水平低于模型组(P<0.05),IL- 10、TGF- β水平高于模型组(P<0.05);柴葛高剂量组IL- 4、IL- 17水平低于柴葛低剂量组和利巴韦林组(P<0.05),IL- 10、TGF- β水平高于柴葛低剂量组和利巴韦林组(P<0.05);柴葛低剂量组和利巴韦林组IL- 4、IL- 10、IL- 17、TGF- β水平差异无统计学意义(P>0.05)。见表4。
表4各组细胞因子水平比较
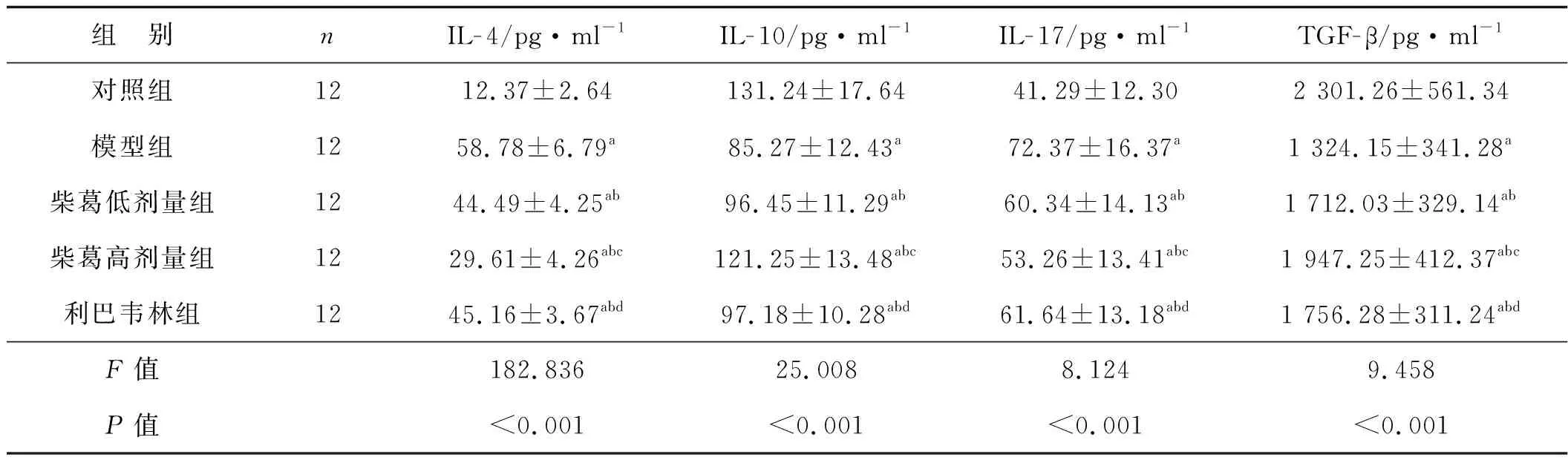
组 别nIL-4/pg·ml-1IL-10/pg·ml-1IL-17/pg·ml-1TGF-β/pg·ml-1对照组1212.37±2.64131.24±17.6441.29±12.302 301.26±561.34模型组1258.78±6.79a85.27±12.43a72.37±16.37a1 324.15±341.28a柴葛低剂量组1244.49±4.25ab96.45±11.29ab60.34±14.13ab1 712.03±329.14ab柴葛高剂量组1229.61±4.26abc121.25±13.48abc53.26±13.41abc1 947.25±412.37abc利巴韦林组1245.16±3.67abd97.18±10.28abd61.64±13.18abd1 756.28±311.24abdF值182.83625.0088.1249.458P值<0.001<0.001<0.001<0.001
与对照组比较,aP<0.05;与模型组比较,bP<0.05;与柴葛低剂量组比较,cP<0.05;与柴葛高剂量组比较,dP<0.05
3 讨 论
婴幼儿RSV感染可引起严重的毛细支气管炎,患儿大多1岁以前感染过RSV病毒,RSV病毒感染是引起儿童反复发生哮喘和喘息的重要因素,不仅是婴幼儿,RSV病毒可引起所有年龄段人群呼吸道感染[4]。RSV病毒侵入人体后既是过敏原,又是感染原,RSV病毒感染可引起气道高反应性和气道变异性炎症反应,并可引起机体免疫状态发生变化,加重哮喘的发生[5]。
RSV感染引起的毛细支气管炎尚无安全的特效药,中医药在RSV感染的防治方面具有明显优势,中药毒副作用小、疗效确切、价格低廉、药源丰富,在调节免疫功能、阻止病毒引起细胞病变、抑制病毒复制、改善临床症状等方面具有独特优势[6- 7]。柴葛口服液是在“小柴胡汤”和“银翘散”化载的“柴葛退热汤”的基础上改良制成,其成分为葛根、柴胡、板蓝根、金银花、菊花、连翘、甘草、竹叶等,其中柴胡、板蓝根、金银花、菊花、连翘、甘草都有抗RSV感染的作用[8]。柴葛退热汤具有宣肺通窍、清热解表等功效,对细菌或病毒引起的腮腺炎、上呼吸道感染等疗效确切,但汤剂质量不稳定,应用不方便,针对儿童服药困难的特点将其改良为柴葛口服液,柴葛口服液口感好、服用方便、质量稳定[9]。本研究用RSV建立小鼠毛细支气管炎模型,给予柴葛口服液治疗,并以常用抗病毒药利巴韦林作为阳性对照,观察柴葛口服液对毛细支气管炎的治疗效果,结果发现:模型组小鼠病毒滴度、肺指数、肺组织病理学评分均明显升高,柴葛口服液和利巴韦林治疗可明显降低模型小鼠的病毒滴度、肺指数和肺组织病理学评分,其中低剂量柴葛口服液和利巴韦林疗效相当,高剂量柴葛口服液疗效优于低剂量柴葛口服液和利巴韦林,可见,柴葛口服液对毛细支气管炎的治疗效果确切。
免疫反应在RSV病毒感染中具有重要作用,其中Th1/Th2平衡假说占据主导地位,Th1细胞可分泌IFN- γ、IL- 2等细胞因子引起细胞毒作用和活化巨噬细胞,介导细胞免疫反应[10- 11];Th2细胞可分泌IL- 4,活化免疫球蛋白,参与体液免疫;RSV感染可使特异性T细胞获得Th2细胞,分泌IL- 4,增强IgE抗体的产生,表明Th1/Th2细胞因子免疫平衡失调在RSV感染中发挥重要作用[12- 14]。Treg/Th17平衡在免疫调节中也具有重要作用,Th17细胞主要分泌IL- 17,可引起多种细胞表达IL- 6、TGF- β、粒细胞集落刺激因子等多种细胞因子和炎症趋化因子。在RSV感染中Th17及其分泌的细胞因子IL- 17水平上升[15- 16];Treg主要分泌IL- 10和TGF- β,在RSV引起毛细支气管炎的发生发展中,Treg可能引起Th2应答增强,促进Th17分泌IL- 17,从而引起炎症反应的发生[17]。本研究结果表明:模型组小鼠Th17细胞、IL- 4、IL- 17水平升高,Treg细胞、IL- 10、TGF- β水平降低;柴葛口服液和利巴韦林可降低模型小鼠Th17细胞、IL- 4、IL- 17水平,升高Treg细胞、IL- 10、TGF- β水平,其中柴葛口服液低剂量和利巴韦林对免疫的调节作用相当,柴葛口服液高剂量对免疫的调节作用优于柴葛口服液低剂量和利巴韦林。柴葛口服液对毛细支气管炎的治疗作用可能与其对免疫功能的调节作用有关,毛细支气管炎存在Th1/Th2平衡失调和Treg/Th17平衡失调,柴葛口服液可通过降低Th17细胞、IL- 4、IL- 17水平,升高Treg细胞、IL- 10、TGF- β水平,发挥对免疫功能的调节作用,从而起到治疗毛细支气管炎的效果。
