ERS标志物PDI表达对肝癌细胞迁移的影响
2018-11-02李利波曹辉张红丽潘娅
李利波,曹辉,张红丽,潘娅
(1.贵州省人民医院 肿瘤科,贵州 贵阳 550002;2. 贵州医科大学,贵州 贵阳 550002)
肿瘤侵袭和转移是肿瘤恶化的一个重要标志。而在肿瘤转移中起关键作用的就是肿瘤细胞突破基底膜(basement membrane,BM)和细胞外基质(extracellular matrix ECM)组成的屏障[1]。内质网是细胞中脂质和蛋白质合成的场所,当内质网内出现发生错误折叠或者没有折叠的蛋白质超量积累时,会激活细胞中一些信号通路,引发内质网应激(endoplasmic reticulum stress,ERS)[2]。许多癌症相关的病理与内质网稳态的失衡以及诱导ERS和未折叠蛋白反应(unfolded protein response UPR)途径有关[3- 4]。目前,肿瘤细胞内的葡萄糖调节蛋白78(glucose- regulated protein 78,GRP78)常被视为肿瘤治疗反应的一种特异性标志物[5- 6],生长停滞及DNA损伤诱导基因153(CHOP)为ERS凋亡途径被激活的主要标志之一[7- 9],X- 盒- 结合蛋白- 1(X box- binding protein- 1,XBP- 1)的表达上调为ERS标志[10- 11]。蛋白质二硫键异构酶(protein disulfide isomerase,PDI)是内质网中含量最丰富的蛋白质之一[12],它是促进蛋白质结构中二硫键形成的蛋白酶。当PDI减少时,错误折叠的蛋白质增多且细胞凋亡程序启动,促进细胞死亡[13- 14]。
1 材料与方法
1.1 细胞系、试剂及设备
正常肝细胞LO2、人肝癌细胞系SMMC- 7721细胞和HepG2细胞(上海生命科学研究所),RIPA裂解液和BCA Protein Assay KitP0010S(上海碧云天生物技术有限公司),CHOP和PDI以及GRP78抗体和XBP- 1抗体(ABCAM公司),P- 40裂解液和RIPA裂解液WB- 0071(上海鼎国生物技术有限公司),KitM3121/1859022/ECL- PLUS和Prestained protein marker 00161543(Termo)。X线胶片显影粉和定影粉(上海冠龙照相材料厂),医用X光片038401501(Crestream),PVDF膜IPVH00010(Mllipore),SDS- PAGE蛋白电泳仪VE- 180、稳压电源(电泳用)EPS- 300和蛋白转膜仪VE- 186(上海天能公司)。荧光显微镜IX71(奥林帕斯公司),离心机Fresco 21为赛默飞世尔科技(中国)有限公司产品,倒置显微镜XDS- 100为上海蔡康光学仪器有限公司产品,CO2培养箱MCO- 15A为SANYO产品,96 Wounding和Replicator VP408FH为VP scientific公司产品。
1.2 实验方法
1.2.1 细胞培养 人正常肝细胞LO2培养条件:在37 ℃ 5%CO2细胞培养箱中培养,培养基为DMEM+10%胎牛血清;人肝癌细胞系HepG2培养条件:在37 ℃ 5%CO2细胞培养箱中培养,培养基为DMEM+10%胎牛血清;人肝癌细胞系SMMC- 7721细胞培养条件:在37 ℃ 5%CO2细胞培养箱中培养,培养基为RMPI 1640+10%胎牛血清。3种细胞均按照1∶3~1∶6传代后提取细胞样品,PBS洗涤两次后转移入EP管中,在冰上裂解15 min,裂解结束后用超声波将细胞打碎,用离心机离心15 min,得到的上清液即为蛋白样品。
1.2.2 诱导ERS 取培养获得的正常肝细胞LO2及肝癌细胞系HepG2细胞和SMMC- 7721细胞,将浓度为150 mmol·L-1的无水乙醇加入到HepG2、LO2和SMMC- 7721细胞中,作用48 h。将无水乙醇弃掉,然后用PBS洗涤2次,从而得到经过无水乙醇进行诱导发生ERS的HepG2、LO2和SMMC- 7721细胞。
1.2.3 细胞裂解液中GRP78、CHOP、XBP- 1及PDI表达的测定 分别将获得的正常肝细胞LO2、人肝癌细胞系HepG2及SMMC- 7721细胞,以及无水乙醇诱导发生ERS的3种细胞样品,用PBS洗涤两次后转移入EP管中,在冰上进行裂解,裂解时间为15 min,裂解结束后用超声波将细胞打碎,用离心机离心15 min,得到的上清液即为蛋白样品。将蛋白样品上样,恒压80 V电泳2 h,4 ℃、 恒流为300 mA的条件下进行电转150 min,然后将蛋白转移到PVDF膜上,在室温下用封闭液(封闭液为含5%脱脂牛奶的TBST溶液)封闭PVDF膜,封闭时间为1 h,然后4 ℃过夜;用TBST洗膜3次,每次洗涤时间为10 min;用Western blotting system试剂盒进行显色,检测GRP78、CHOP、XBP- 1及PDI表达。
1.2.4 LV- PDIA2(9923- 1)病毒转染 取培养获得的正常肝细胞LO2、肝癌细胞系HepG2细胞和SMMC- 7721细胞,分别加LV- PDIA2(9923- 1)10 μl和病毒CON145(阴性对照)感染细胞。在感染16 h后将培养基更换为常规培养基,然后继续培养,以绿色荧光蛋白(green fluorescent protein,GFP)为荧光标记慢病毒感染,72 h时用荧光显微镜观察报告基因的表达情况,荧光率即为阳性感染率。
1.2.5 细胞迁移能力检测 取感染前LO2、HepG2及SMMC- 7721细胞及病毒转染后的3种细胞约3×104个分别加入含有胎牛血清培养基的96孔板上,次日将培养基换成血清浓度较低的培养基,保持划痕仪和96孔板的下端中央部位对齐,用力向上轻轻一推形成划痕。然后用无血清培养基进行漂洗,漂洗2~3遍后在培养基中加入血清浓度较低的培养基(如0.5% FBS),于37 ℃、5%CO2培养箱培养,0、8、24 h拍照,观察细胞迁移能力。
1.3 统计学处理
所有数据采用SPSS 21软件进行统计分析,采用非参数检验和one- way ANOVA法分析无水乙醇处理前后3种细胞中GRP78和PDI、CHOP、XBP- 1蛋白表达,t检验分析3种细胞的迁移能力在病毒转染前后改变,P<0.05为差异具有统计学意义。
2 结 果
2.1 GRP78、CHOP、XBP- 1在ERS前后的表达
Western blotting检测发现,无水乙醇处理后LO2、HepG2及SMMC- 7721细胞中GRP78、XBP- 1光密度值升高(图1、2,表1),差异具有统计学意义(P<0.05),提示3种细胞经无水乙醇处理后发生了ERS;无水乙醇处理后,LO2及SMMC- 7721中CHOP的光密度值也增高(图3、4,表1),差异具有统计学意义(P<0.05);但无水乙醇处理前后HepG2细胞中均无CHOP表达。
2.2 PDI在ERS前后的表达
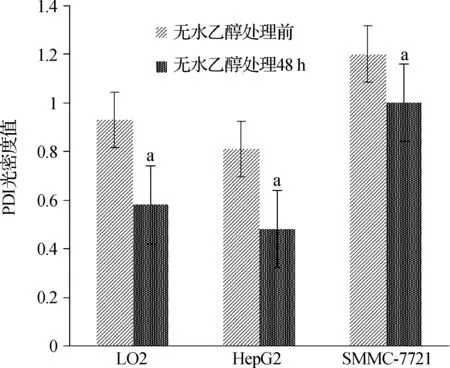
Western blotting检测发现无水乙醇处理前,在SMMC- 7721细胞中PDI的光密度值最高,其次LO2细胞,在HepG2细胞中最低,3种细胞比较差异具有统计学意义(P<0.01)。在无水乙醇处理48 h后,PDI在3种细胞中的光密度值均下降,光密度值从高到低仍然是SMMC- 7721、LO2、HepG2,3种细胞分别与无水乙醇处理前比较,差异具有统计学意义(P<0.05)。见图5、6,表2。

图1无水乙醇处理前后3种细胞中GRP78、XBP-1表达
Fig1TheexpressionofGRP78andXBP-1inthreekindsofcellsbeforeandafterethanoltreatment
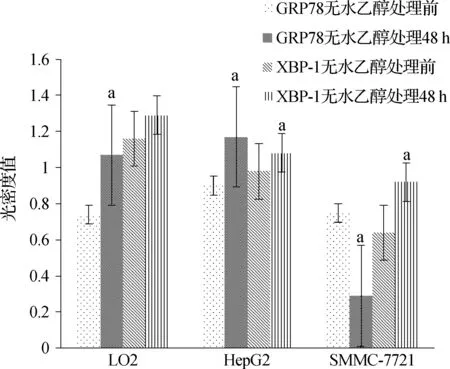
与无水乙醇处理前相比,aP<0.05
图2无水乙醇处理前后3种细胞中GRP78、XBP-1表达
Fig2TheexpressionofGRP78inthreekindsofcellsbeforeandafterethanoltreatment
表1无水乙醇处理前后3种细胞GRP78、XBP-1、CHOP光密度值
Tab1ThedensityofGRP78、XBP-1、CHOPinthreekindsofcellsbeforeandafterethanoltreatment

细 胞蛋 白光密度值无水乙醇处理前无水乙醇处理48 hP值LO2GRP780.74±0.181.07±0.24<0.05HepG20.90±0.141.17±0.17<0.05SMMC-77210.75±0.170.29±0.06<0.05LO2XBP-11.16±0.221.29±0.250.087HepG20.98±0.171.08±0.280.028SMMC-77210.64±0.210.92±0.170.030LO2CHOP0.98±0.160.99±0.170.042SMMC-77210.89±0.160.95±0.170.042

图3无水乙醇处理前后2种细胞中CHOP表达
Fig3TheexpressionofCHOPintwokindsofcellsbeforeandafterethanoltreatment

与无水酒精处理前相比, aP<0.05
图4无水乙醇处理前后LO2和SMMC-7721细胞中的CHOP表达
Fig4TheexpressionofCHOPinLO2cellandSMMC-7721cellbeforeandafterethanoltreatment
2.3 PDI对肝癌细胞迁移能力的影响
病毒转染前3种细胞中HepG2细胞迁移能力最弱,其次为LO2,迁移能力最强的为SMMC- 7721细胞。感染病毒使PDI过表达后,SMMC- 7721细胞迁移能力最强,其次为LO2细胞,HepG2细胞迁移能力最弱;与PDI过表达前比较,LO2细胞迁移能力受到了抑制,而HepG2细胞与SMMC- 7721细胞迁移能力得到了增强。见图7、8,表3。
3 讨 论
原发性肝癌是严重危害人类健康的常见恶性肿瘤之一,肿瘤细胞侵袭迁移能力的改变是恶性肿瘤转移的前提。由于肿瘤处于一种高度细胞分裂增殖的状态,细胞内营养供应不够,导致肿瘤细胞长期处于缺氧状态。而肿瘤细胞缺氧正是ERS的一种强诱导剂,所以,肿瘤组织中有ERS。内质网是蛋白质合成、折叠、组装、运输以及参与脂质代谢的场所,并且也储存细胞内Ca2+离子,细胞中存在一完整机制来促进内质网内蛋白质发生折叠和修饰。当内质网内生理功能发生紊发生紊乱等。内质网还可通过促进凋亡反应诱导肿瘤细胞发生凋亡,内质网也可以通过抗凋亡作用而导致肿瘤细胞发生无限增殖。肿瘤细胞还可以激活未折叠蛋白反应,从而增强生长因子、血管生成因子和细胞因子分泌的能力,从而促进肿瘤细胞的迁移和侵袭[15- 16]。ERS发生时UPR还可以通过影响血管因子的表达促进肿瘤新生血管的生成,许多癌症相关的病理与内质网稳态的失衡以及诱导ERS和UPR途径有关,这使得ERS成为近年来肿瘤治疗的一个新靶点,目前通常采用参与未折叠蛋白反应的标志性分子,如GRP78、CHOP、XBP- 1等表达水平上调来提示ERS的发生[15- 16]。本研究结果提示,正常肝细胞LO2、肝癌细胞HepG2及高转移肝癌细胞SMMC- 7721经无水乙醇处理48 h,细胞中ERS标志物GRP78、CHOP、XBP- 1的表达都发生改变(HepG2细胞中CHOP除外),提示经无水乙醇处理48 h的3种细胞都发生了ERS。PDI是附着在内质网膜腔面上的一种氧化还原酶,它可以切断二硫键,形成自由能最低的蛋白质构象,从而帮助新生蛋白质产生正确折叠的构象,还可充当分子伴侣,是内质网中的一种重要的折叠催化剂[17]。PDI可以通过介导氧化蛋白的折叠来维持细胞稳态,研究表明,PDI在多种癌症的生存和发展中起到重要作用[18]。在本研究中,无水乙醇处理前3种细胞中都有PDI表达,表达量高低依次是SMMC- 772、LO2、HepG2细胞,说明肿瘤细胞的恶性程度越高,PDI表达越明显。处理48 h后PDI的表达水平均明显下调,表达量高低顺序仍然依次是SMMC- 772、LO2、HepG2细胞,提示PDI表达可能影响SMMC- 7721的转移能力,表明在肝癌细胞中ERS可以促使PDI进入细胞质,使得PDI减少,增加错误折叠的蛋白质,进而使癌细胞保持在ERS状态,启动凋亡程序,从而促进细胞死亡。处理前后PDI表达水平不同与肝癌细胞的转移能力相关,因此需要观察PDI过表达对肝癌细胞的迁移率的影响。在病毒转染前3种细胞细胞迁徙能力顺序依次是SMMC- 772、LO2、HepG2细胞,病毒感染后3种细胞迁徙能力顺序依次是SMMC- 772、LO2、HepG2细胞。与感染前比较,LO2细胞迁移能力受到了抑制,而HepG2细胞与SMMC- 7721细胞迁移能力得到了增强,且随着细胞恶性程度的增加而增强。这提示肝癌细胞的迁移能力受到PDI的影响,PDI过表达可以促进肝癌细胞的迁移能力,因此这两种肝癌细胞都表现出迁移倾向加强。有文献显示,PDI静默可以通过降低氧自由基而降低血管平滑肌细胞的迁移能力。内质网正常的生理功能与氧化还原状态密切相关,越来越多的研究证明ROS和RNS在内质网应激过程中起着介导和调节作用[19- 20]。内质网提供一个独特的氧化环境促进蛋白质二硫键形成,进而在内质网形成ROS,肿瘤细胞的微环境呈现出低氧、低营养和低pH值的状态,存在错误折叠的蛋白质,PDI可切断错误折叠的蛋白质二硫键,形成自由能最低的蛋白质构象,帮助形成新的二硫键并产生正确折叠的构象,蛋白质的折叠和重折叠需要消耗大量ATP,ATP耗竭导致蛋白质错误折叠刺激线粒体氧化磷酸化增加ATP和ROS的产生,进而增加肿瘤细胞迁移能力[21- 22]。且PDI增加越多,ROS形成越多,肝癌细胞迁移能力增强的程度越大。而在正常肝细胞中,稳定的内质网环境的可以使PDI介导错误氧化的蛋白质进行二硫化物重组,使ROS减少,从而抑制细胞迁徙能力[23]。
图5无水乙醇处理前后3种细胞中PDI表达
Fig5TheexpressionofPDIinthreekindsofcellsbeforeandafterethanoltreatment
与无水酒精处理前相比,aP<0.05
图6无水乙醇处理前后3种细胞中PDI表达
Fig6TheexpressionofPDIinthreekindsofcellsbeforeandafterethanoltreatment
表2无水乙醇处理前后3种细胞PDI光密度值
Tab2ThedensityofPDIinthreekindsofcellsbeforeandafterethanoltreatment

细 胞PDI光密度值无水乙醇处理前无水乙醇处理48 hP值LO20.93±0.100.58±0.170.049HepG20.81±0.210.48±0.140.003SMMC-77211.20±0.281.00±0.290.032

图7病毒感染前后3种细胞迁移能力(0h,24h)
Fig7Themigrationabilityofthreekindsofcellsbeforeandaftervirustransfection(0h,24h)

与转染前相比,aP<0.05
图8病毒感染前后3种细胞迁移能力
Fig8Themigrationabilityofthreekindsofcellsbeforeandaftervirustransfection
表3病毒转染前后3种细胞迁移率
Tab3Themigrationabilityofthreekindsofcellsbeforeandaftervirustransfection

细胞迁移率转染前0 h转染后24 hP值LO20.25±0.050.23±0.070.03HepG20.04±0.010.06±0.010.03SMMC-77210.74±0.210.95±0.070.028
乱时,将导致ERS一系列反应出现,包括蛋白质翻译停滞、蛋白质折叠能力增强、蛋白质的降解加速或者细胞内Ca2+
ERS标志物GRP78、CHOP、XBP- 1及PDI在正常肝细胞LO2中都具有一定的表达,而无论是在肝癌HepG2细胞还是高转移能力的肝癌SMMC- 7721细胞中ERS标志物的表达水平均与正常肝细胞不同,提示正常肝细胞和恶性肿瘤细胞的ERS反应程度不同。无水乙醇处理前后SMMC- 7721的PDI表达水平在3种细胞中最高,转染病毒使PDI过表达时,SMMC- 7721细胞的迁移能力明显增强,提示PDI表达水平升高与肿瘤的高转移能力有关[24- 29]。
