外用芍药苷对银屑病小鼠的治疗作用研究*
2018-11-02白小翠党二乐
俞 晨,白小翠,党二乐,王 刚
第四军医大学西京皮肤医院(西安 710032)
主题词 银屑病/中医药疗法 芍药苷/治疗应用 动物实验 小鼠
银屑病俗称“牛皮癣”,是一种常见的慢性炎症性皮肤病,临床以鳞屑性红斑或斑块为主要表现,我国是银屑病“大国”,人群患病率约为0.5%,患者总数超过600 万[1]。该病确切的病因和发病机制尚不清楚,目前认为异常活化的角质形成细胞与T细胞为主的免疫细胞在皮肤局部相互作用是银屑病发病机制中的重要环节,角质形成细胞的异常增殖既是疾病主要的病理改变,又是疾病发生发展中的关键因素[2-3]。银屑病固有的长久病程和易于反复,使其成为临床难治的疾病之一,目前的治疗方法在疗效和安全性方面虽有优势,但也都还存在疗效难以维持、不良反应较多的问题,令人不尽满意[4-7]。中医学认为银屑病属于“白疕”范畴,经过后世医家的传承及发挥,形成从血论治、从脏腑论治、从邪论治等多种辨证施治的方法[8],临床实践中体现了疗法多样、方药丰富、剂型多种、副作用少等优势,在口服及外用中药制剂的临床疗效观察及实验研究等方面均取得了一定成绩,尤其在提高疗效、减少复发、降低副反应及经济实用等方面优势明显。在各类型中药复方中,白芍等清热凉血类药物最为常用,我们的前期临床研究也证实,以芍药苷(Paeoniflorin, PF)为主要成分的白芍总苷(Total glucosides of paeonia,TGP)可有效改善中重度银屑病症状。现代药理学研究已证实这类药物有效活性成分具有显著且可靠的抗炎和抗增殖作用,并从参与银屑病发病的免疫细胞紊乱角度解释了TGP/PF治疗银屑病的作用机理,但对影响银屑病角质形成细胞的作用仍不明确,限制了对单味中药剂型及用法更有效地开发和应用。本研究拟通动物模型观察外用芍药苷对银屑病表型的缓解及治疗作用,以此初步探讨芍药苷对银屑病角质形成细胞异常增殖的影响,以期为进一步开发芍药苷在皮肤科的应用奠定基础。
材料与方法
1 动物模型制备及给药 于空军军医大学动物实验中心购买12只体重30 g左右雌性近交系BALB/c小鼠,培养于本校动物实验中心饲养在恒温恒湿的SPF级屏障环境内。随机分为空白、IMQ造模、治疗低剂量及高剂量四组。BALB/c小鼠耳部剃毛后,后三组小鼠连续7 d每天上午耳部涂抹250 mg∶12.5 mg咪喹莫特乳膏一次,制备咪喹莫特诱导银屑病小鼠模型。治疗组在建模过程中同时给小鼠耳部皮肤连续外用涂抹不同浓度的PF,低剂量组给予PF 10 μg/(次·鼠),高剂量组给予PF1mg/(次·鼠),观察各组小鼠模型局部出现红斑鳞屑后,进行取材
2 实验药品 芍药苷原料由宁波朗生医药有限公司提供;咪喹莫特乳膏有英国3M Health Care Limited生产,注册证号H2016007。
3 观察方法 银屑病样小鼠模型外用芍药苷治疗对比分析:观察小鼠大体变化,对比红斑、鳞屑程度。将收集的小鼠皮损梯度酒精脱水,二甲苯透明后进行HE染色,NDP.view软件测量鼠耳表皮厚度,对比炎症细胞浸润程度。
结 果
1 四组小鼠表型比较 给予BALB/c小鼠连续外用咪喹莫特乳膏7 d进行银屑病建模,大体观察耳部皮肤发现小鼠耳部变红,增大,表面附有鳞屑,血管扩张明显。在建模过程中,同时给小鼠皮肤连续外用涂抹不同浓度的PF,低剂量组10μg/(次·鼠)及高剂量组1 mg/(次·鼠),7 d后观察小鼠表型,与IMQ组相比较,外用涂抹PF后小鼠红斑鳞屑明显减轻,表皮厚度明显减轻(图1)。
2 四组小鼠耳缘表皮厚度比较 通过测量耳缘厚度发现,空白组、咪喹莫特组、PF低剂量组及PF高剂量组的表皮厚度分别为0.27 mm、0.58 mm、0.52 mm、0.41 mm,治疗组与咪喹莫特组相比具有统计学意义(P<0.001)(图2)。
3 四组小鼠皮肤组织病理检查比较 将耳朵进行皮肤组织病理检查,HE染色显示:与空白组相比,咪喹莫特组小鼠耳部出现角化不全、角化过度,表皮棘层增厚明显,真皮浅层血管扩张,炎细胞浸润,而两组PF治疗组均显著的缓解了以上银屑病的表型,真皮浸润淋巴细胞数量明显减少(图3)。
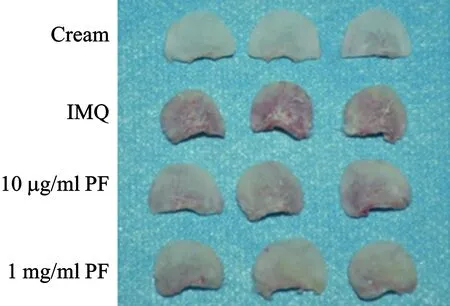
图1 小鼠模型银屑病表型(红斑、鳞屑)变化
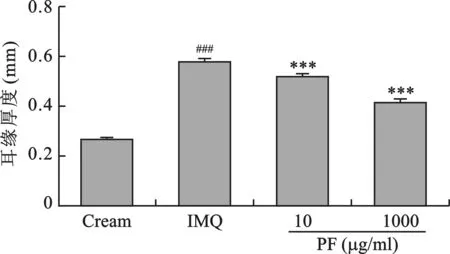
图2 大体组织耳缘厚度变化
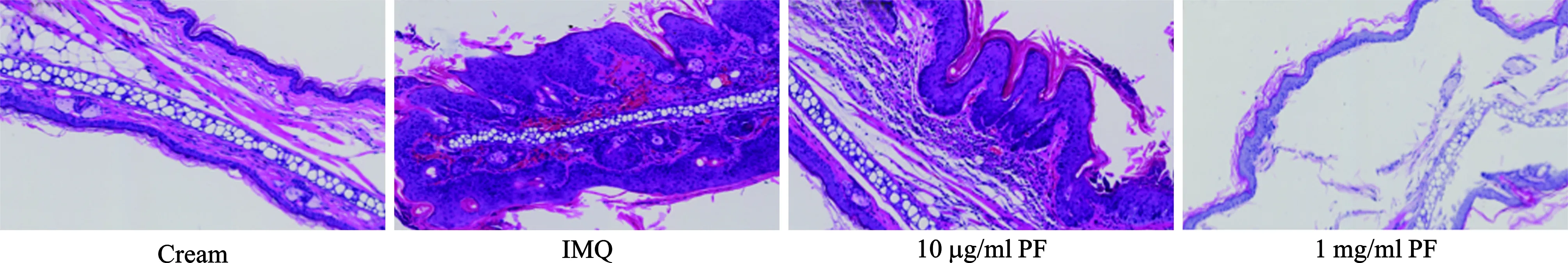
图3 皮肤组织病理学改变( HE染色 ×10 )
4 四组小鼠组织病理表皮厚度比较 将病理切片中表皮厚度进行量化发现空白组组、米喹莫特组、PF低剂量组及PF高剂量组的表皮厚度分别为15.54 μm、77.92 μm、40.86 μm、32.3 μm,芍药苷治疗组与米喹莫特组相比具有统计学意义(P<0.001)(图4)。
以上结果均提示外用PF能够直接作用于角质形成细胞缓解银屑病表型,并且PF的治疗作用随剂量的增加而增强,从而达到治疗银屑病的作用。
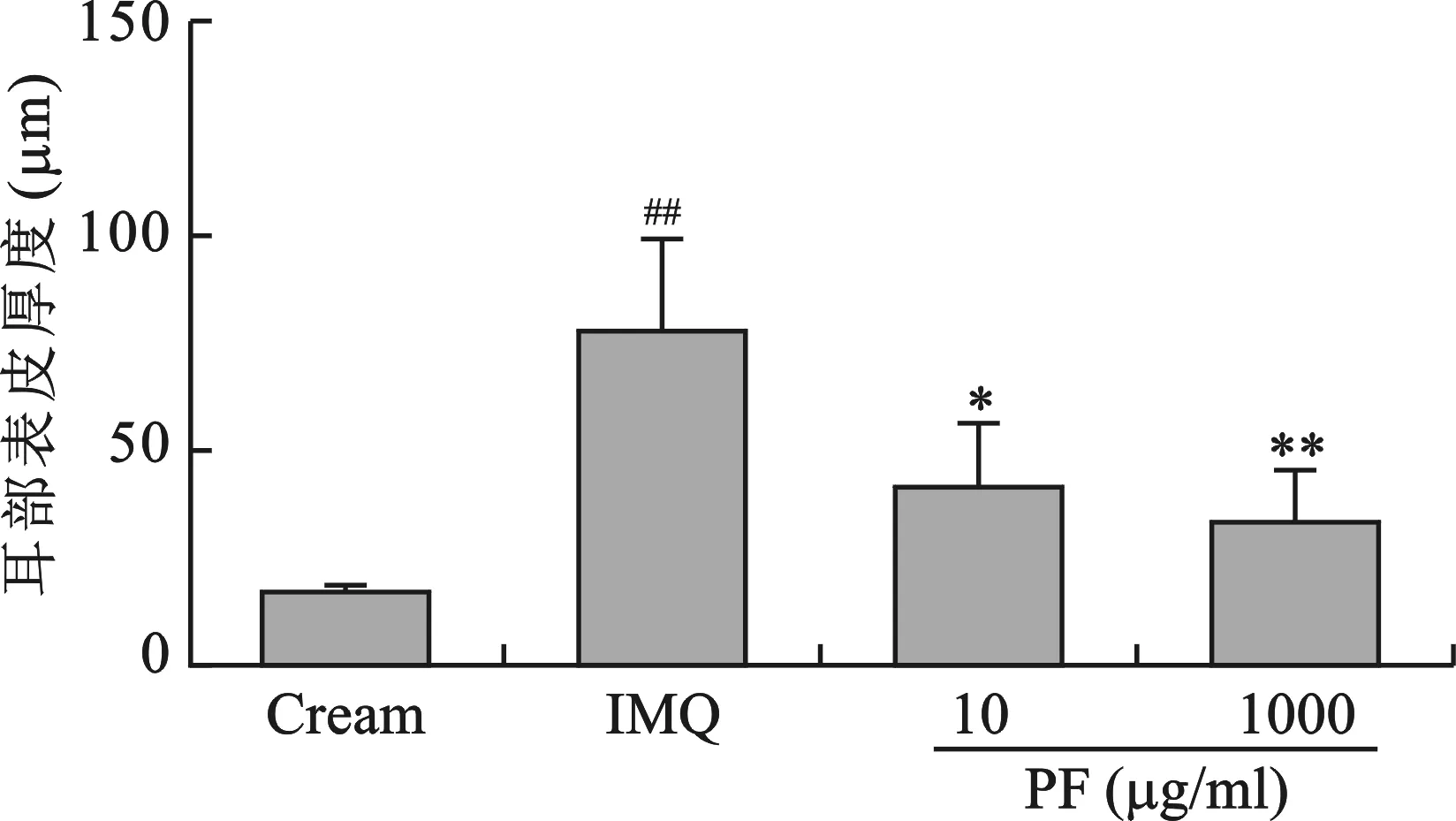
图4 组织病理表皮厚度
讨 论
银屑病的发病机制非常复杂,尚未完全阐明,目前比较公认的银屑病的发病机制为,在皮肤应激、损伤等诱因的作用下,遗传易感性个体的表皮角质形成细胞被激活,激活的角质形成细胞表达、产生多种免疫活性物质[2],这些免疫活性物质通过介导角质形成细胞进一步活化,或趋化、活化中性粒细胞、树突状细胞等固有免疫成分[3],启动异常的免疫应答并进一步诱导T细胞发生异常的分化、活化。被活化的T细胞作为适应性免疫应答的主要效应细胞,通过分泌大量细胞因子,如IFN-γ、TNF-α、IL-23和IL-17A等作用于表皮,进一步激活角质形成细胞,促进其增殖发生银屑病的病理改变。
白芍总苷(Total glucosides of paeonia,TGP)是从中药白芍中提取的有效成分,包括芍药苷、羟基芍药苷、芍药花苷、芍药内酯苷以及苯甲酰芍药苷等,其中芍药苷(Paeoniflorin, PF)占90%,是其主要有效成分。近年来,国内外学者对TGP/PF的药理作用展开了较为深入的研究,发现其具有抗炎、止痛、保肝、调节免疫以及影响细胞增殖等多种药理作用,被认为是一种高效的抗炎免疫调节药,在多个环节影响自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮等)的免疫细胞功能、抗原提呈过程和炎症因子表达[9-10]。因此,TGP/PF被皮肤科医生所认可,并尝试用于治疗银屑病、特应性皮炎等免疫相关性慢性皮肤病的治疗,临床报道疗效确切[11-12]。我们牵头开展的多中心、随机、双盲、平行对照临床研究(ClinialTrials.gov 注册登记号: NCT02191020)发现,TGP联合阿维A治疗中重度斑块状银屑病,在有效性和安全性方面均优于单用阿维A治疗,在明显提高疗效的同时还显著降低了肝功能损害等不良反应的发生[13]。
对于TGP/PF治疗银屑病的作用机理研究,目前多围绕其免疫调节作用展开。已有研究发现,①TGP/PF可明显降低Th17细胞相关细胞因子水平[14-15],抑制银屑病动物模型炎细胞浸润[16];②TGP/PF通过NF-κB和ERK通路抑制TNF-α诱导的血管内皮细胞趋化因子产生和白细胞迁移从而发挥抗炎作用[17];③TGP/PF可在体内体外抑制血管新生[18],从参与银屑病发病的免疫细胞紊乱角度解释了TGP/PF治疗银屑病的作用机理。目前针对TGP/PF作用于角质形成细胞的研究较少。有学者报道[19-20],TGP能明显抑制INF-γ诱导的角质形成细胞的增殖活力,同时明显降低IL-23、VEGF等银屑病相关细胞因子的水平,提示TGP/PF可直接作用于角质形成细胞发挥其抗炎功能,但是其具体作用靶点及调控机制尚不明确。
我们的研究从动物实验入手,尝试使用芍药苷外用涂抹于银屑病模型小鼠,观察其对银屑病表型的缓解及治疗作用,结果显示外用PF能够以剂量依赖性的方式有效缓解银屑病样表型,真皮浸润的淋巴细胞数量也受到明显的抑制,提示芍药苷可作用于银屑病表皮的角质形成细胞,抑制其异常增殖,从而达到治疗银屑病的作用。为进一步开发芍药苷在皮肤科的应用奠定基础。其具体的作用靶点及调控信号通路机制尚有待进一步研究。
