人SLC25A13基因内含子突变IVS6-11A>G导致转录子剪接异常
2018-10-29陈君霖李海清刘妍霖李冰肖张占会
陈君霖, 李海清, 刘妍霖, 李冰肖, 张占会
(1.暨南大学 生物医学转化研究院, 广东 广州 510632; 2.暨南大学 附属第一医院临床 医学研究院, 广东 广州 510632)
人SLC25A13基因位于7号染色体长臂(7q21.3),基因总长度约160 kb,包含18个外显子,转录子长度约3.4 kb,基因编码由675个氨基酸组成的Citrin蛋白[1].Citrin 是人线粒体载体蛋白家族(mitochondrial carrier family, MCF)天冬氨酸/谷氨酸载体 (aspartate/glutamate carrier, AGC)两种亚型 (isoform)之一, Citrin又被称为AGC2,是特异性表达于肝脏中的 AGC 蛋白亚型[1-2].Citrin功能单位为二聚体结构,可将线粒体基质合成的天冬氨酸与细胞胞浆内的谷氨酸进行交换,并向线粒体内提供一个H+质子[3-5].
SLC25A13 基因突变会导致Citrin 蛋白活性异常,导致一系列复杂的生化代谢紊乱和临床表现,形成常染色体隐性遗传病-Citrin 缺陷病(citrin deficiency, CD).目前CD包括3种临床表型:Citrin 缺陷导致的新生儿肝内胆汁淤积症(neonatal intrahepatic cholestasis caused by Citrin deficiency, NICCD, OMIM#605814);成人发病瓜氨酸血症 Ⅱ 型(adult-onset type Ⅱ citrullinemia, CTLN2, OMIM #603471)与Citrin 缺陷导致的生长发育落后和血脂异常(failure to thrive and dyslipidemia caused by citrin deficiency, FTTDCD).NICCD 主要发病于新生儿或小婴儿,以肝大、黄疸和肝功能异常为主要临床表现,而 CTLN2 主要发病于成年人或较大儿童,意识障碍和行为异常等神经系统表现比较突出[6-9],FTTDCD 是介于上述两者之间过渡状态[6,10-11].有研究报道我国Citrin 缺陷病的临床表型主要为NICCD[11-12].
由于NICCD缺乏临床或生化诊断标准,SLC25A13基因分析是其确诊的可靠手段.根据人类基因突变数据库(The Human Gene Mutation Database)最新数据(http://www.hgmd.cf.ac.uk/ac/gene.php?gene=SLC25A13), 目前已确认SLC25A13突变100多种.据统计,包括错误突变、无义突变、剪接突变在内的点突变居多,而位于内含子以内导致剪接异常的突变有多种,多位于与内含子相邻的5个内含子碱基内[13-14].位于内含子较深内部的突变,目前仅发现1例IVS6-11A>G报道,且文献未能确切证实该突变会引起异常剪接及剪接异常形式[15].本研究通过pSPL3外显子捕获质粒设计实验,确认SLC25A13基因IVS6-11A>G (c.615-11A>G) 会导致出现新的剪接位点.
1 材料与方法
1.1 材料
胎牛血清,DMEM培养基购自美国Gibco公司;TRIzolTMReagent试剂,青链霉素混合液,转染试剂Lipofectamine 2000 购自美国Invitrogen公司;高保真酶PrimeSTAR® HS DNA Polymerase,逆转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)购自大连宝生物公司;胶回收试剂盒(PureLinkTMQuick Gel Extraction Kit)购自Thermo Fisher Scientific公司;T4连接酶,XhoI,NheI两种内切酶购自New England Biolabs公司.
1.2 方法
1.2.1 生物信息学分析
为了预测突变位点变异是否影响前体mRNA剪接,应用Human Splicing Finder(HSF, http://www.umd.be/HSF3/)、NetGene2(http://www.cbs.dtu.dk/services/NetGene2)等在线软件工具进行分析[16].
1.2.2 minigene外显子捕获载体构建
为了探究SLC25A13基因IVS6-11A>G突变是否影响mRNA剪接,采用pSPL3外显子捕获质粒进行验证,能有效验证内含子突变对mRNA剪接的影响[17-19],主要包括空载体pSPL3 (BioVector NTCC),正常对照质粒pSPL3-N,包含SLC25A13基因Exon7 139 bp,intron6 661 bp, intron7 285 bp,突变质粒pSPL3-Mu,包含IVS6-11G(图1).套式PCR构建正常对照质粒,以100 ng正常人gDNA为模板,使用高保真酶(PrimeSTAR® HS DNA Polymerase),以引物citrin-IVS6F1,citrin-IVS7R1进行第1次PCR扩增,94 ℃预变性5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30个循环,最后再72 ℃延伸10 min;再以1 μL上述第1步PCR产物为模板,引物IVS6F-XhoI,IVS7R-NheI扩增(扩增条件为94 ℃预变性5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30个循环,最后再72 ℃延伸10 min.胶回收1 105 bp PCR产物,其5′包含XhoI酶切位点,3′包含NheI酶切位点,用于质粒构建. XhoI酶,NheI酶双酶切37℃,2 h胶回收产物及pSPL3质粒,两种酶切产物胶回收后使用T4连接酶连接.连接液热激转染感受态细胞E.coliDH5α,在含质量浓度为100 μg/mL 氨苄青霉素的LB培养基上涂板过夜培养,以引物IVS6F-XhoI,IVS7R-NheI进行菌落鉴定,阳性克隆送广州天一辉远基因科技有限公司进行质粒测序.将构建好的正常对照质粒命名为pSPL3-N.
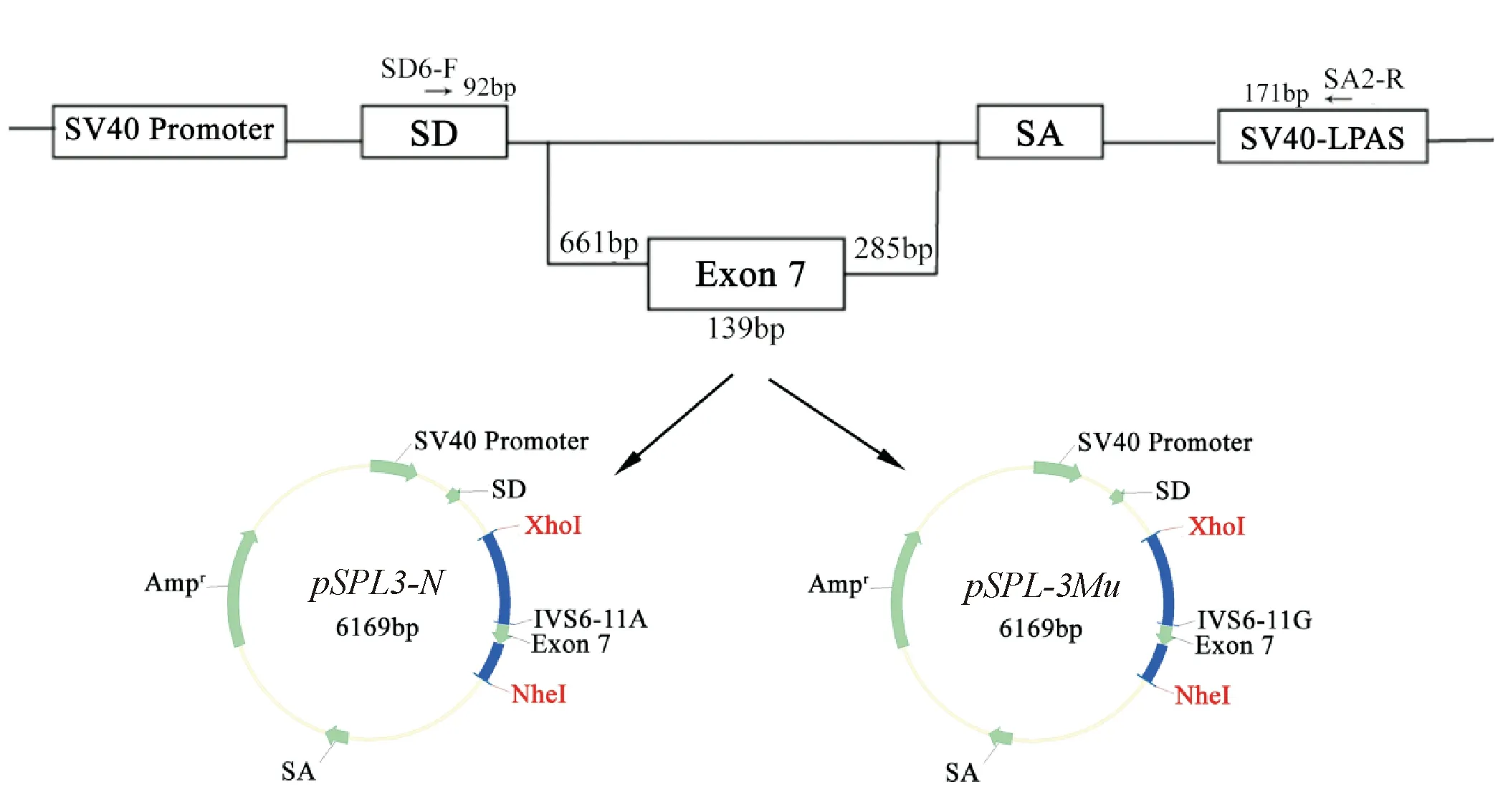
图1 pSPL3-N和pSPL3-Mu质粒设计
重叠延伸PCR构建点突变质粒过程(图2),以pSPL3-N作为模板,分别以引物组合IVS6F-XhoI+ IVS6-11MR和IVS6-11MF+ IVS7R-NheI扩增, 94℃预变性5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环,最后再72 ℃延伸10 min,进行切胶回收.然后各取100 ng产物混合进行PCR, 94 ℃预变性5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环,最后再72 ℃延伸10 min,产物作为第3次PCR的模板,再以引物组合IVS6F-XhoI+ IVS7R-NheI扩增,94 ℃预变性5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环,最后再72 ℃延伸10 min,扩增目的条带为1 105 bp,再按上述步骤进行酶切连接反应,转染的感受态细胞为E.coliDH5α,测序筛选构建成功质粒,构建好含有IVS6-11A>G突变点的质粒命名为pSPL3-Mu,上述引物序列(表1).
1.2.3 细胞培养,质粒转染
HEK 293 T细胞(human epithelial kidney 293 T,购自中山大学动物实验中心),培养条件为使用含质量浓度为10%胎牛血清,青霉素、链霉素质量浓度均为100 mg/L,DMEM培养基37 ℃,体积分数为5%的CO2培养箱培养.转染前1 d,6孔板接种细胞50 000/孔,过夜培养24 h.按照Lipofectamine 2000 说明书方法分别转染质粒3 μg/孔,Lipofectamine 2000溶液9 μL与质粒3 μg,转染后36 h,收集细胞,提取总RNA.

红色表示引入的酶切位点
Fig.2 Construction fragment with IVS6-11A>G mutation by overlap extension PCR

表1 扩增插入片段和逆转录 PCR(reverse transcription PCR, RT-PCR)分析用引物序列Table 1 The primers used in amplification of insert fragments and RT-PCR analysis
1)下划线碱基示引入的XhoI 和NheI酶切位点,小写字母单碱基为定点引入突变位点.
1)The underlined bases indicated the introduced restriction enzyme sites of XhoI and NheI, and lowercase letters indicated the introduced mutation sites.
1.2.4 总RNA抽提、逆转录PCR
用Trizol法抽提转染细胞总RNA,然后进行逆转录获得cDNA,逆转录试剂盒操作方法详见说明书.以cDNA为模板,利用引物SD6, SA2进行PCR,引物序列(表1).扩增产物Sanger测序,与SLC25A13正常基因序列和mRNA序列进行比对分析.
2 结果
2.1 IVS6-11A>G突变的生物信息学预测及结果分析
网上在线软件HSF预测结果显示,IVS6-11A>G突变导致原来的剪接位点可能被沉默,激活1个新的内含子剪接受体位点.HSF Matrices数据库预测显示,产生1个新剪接位点的概率为47.74%,在数据库中当预测概率大于10%说明极大可能产生1个新的剪接位点,其导致Exon7前段插入10 bp,即新的剪接位置在IVS6-11G.NetGene2 Server预测显示IVS6-11A>G突变形成新的剪接受体位点,位置在IVS6-11G,原来Exon7 5′端位点被沉默,与HSF预测相一致.
2.2 包含IVS6-11A>G突变的pSPL3-N和pSPL3-Mu载体的构建和验证
为了验证IVS6-11A>G突变是否导致SLC25A13 mRNA剪接异常,利用pSPL3外显子捕获质粒构建质粒pSPL3-N和pSPL3-Mu(图1).构建的质粒pSPL3-N和pSPL3-Mu的酶切验证结果(图3),其测序结果(图4).通过酶切验证以及测序鉴定,证实质粒构建成功,pSPL3-Mu质粒已经引入突变位点11G,pSPL3-N该位点为11A.
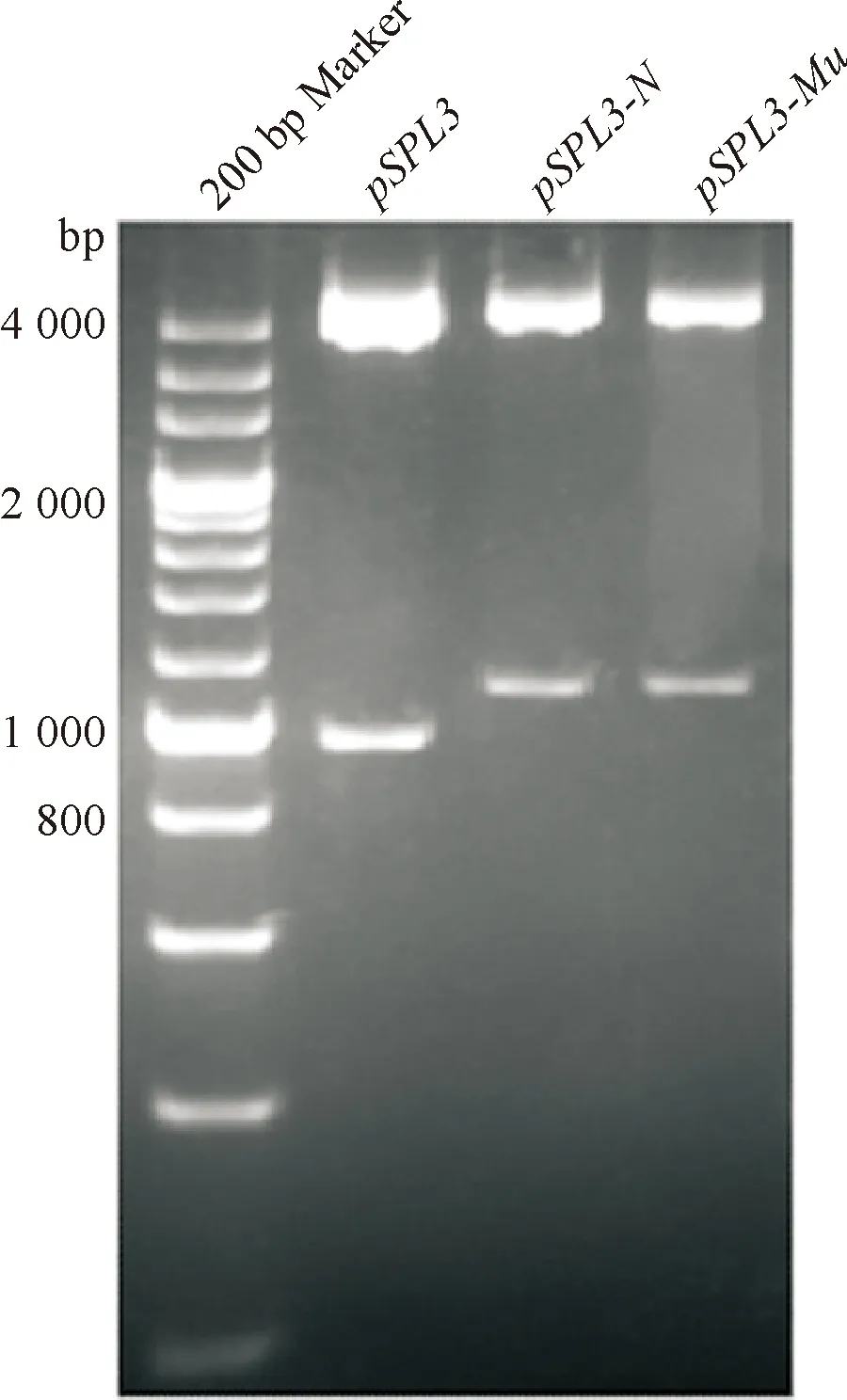
图3 pSPL3-N和pSPL3-Mu质粒XhoI、NheI酶切验证图
Fig.3 Verification of constructed plasmidspSPL3-NandpSPL3-Muby double-digestion with XhoI、NheI
2.3 IVS6-11A>G突变对SLC25A13基因表达剪接产物的影响
为了研究IVS6-11A>G突变对SLC25A13基因表达剪接产物的影响,将构建的pSPL3-N和pSPL3-Mu质粒分别转入HEK293T细胞,然后利用引物SD6和SA2进行RT-PCR扩增目标cDNA,从而分析mRNA剪接情况.测序结果显示对照组pSPL3质粒在293T细胞中SD与SA两个外显子正确拼接,扩增验证片段大小为263 bp (图5).正常对照pSPL3-N质粒瞬转HEK293T细胞后,插入的Exon 7与SD及SA正确的拼接,扩增片段大小为402 bp;而pSPL3-Mu扩增片段大小与pSPL3-N相接近,通过测序分析发现,在SD与Exon7中有突变点后原内含子6的10 bp(-TTTATTTGAG-)碱基保留.可见,IVS6-11A>G突变导致SLC25A13基因内含子6的3′端10个碱基保留于转录子中(r.615_616ins615-10_615-1),分析显示会导致蛋白翻译提前终止(p. Ala206 Phefs*3).

图4 pSPL3-N和pSPL3-Mu质粒测序结果

pSPL3: 263 bp; pSPL3-N: 402 bp(263+139 bp); pSPL3-Mu: 412 bp(263+149)
3 讨论
林壹明等[15]报道的人SLC25A13基因内含子突变IVS6-11A>G是目前发现的唯一1例位于内含子内部的可疑剪接突变[13-15].本研究中借助于minigene剪接实验,证实IVS6-11A>G导致剪接位点发生改变,Exon7原来的剪接位点被沉默,在突变点IVS6-11G位置形成新的剪接位点,致使内含子6的3′ 10个碱基保留在成熟mRNA中,导致蛋白翻译在插入碱基后不远处终止 (p.Ala206Phefs*3),使得citrin蛋白的部分N 端部分EF-hands基序(第1~319位氨基酸)、中部的整个跨膜的载体结构域(第320~612位氨基酸),和C端两性分子螺旋结构(第613~675位氨基酸)丢失[4],citrin蛋白的AGC功能完全丧失,结果可明确突变IVS6-11A>G是致病突变.以往,常规分析SLC25A13致病突变时,包括二代全外显子测序,多与外显子和与其相邻的内含子序列的5个碱基相关,导致内含子中的致病突变被忽视遗漏.因此,在临床诊断过程中,对于临床和生化指标高度疑似citrin缺陷病的患者,如果不能在外显子和相邻内含子序列中发现致病突变时,要考虑通过mRNA分析或者蛋白分析来筛查可导致剪接异常的内含子突变.
分析位于内含子内部的突变,尤其是剪接位点保守序列GT-AG以外的突变是否影响前体mRNA (pre-mRNA)剪接,是判定内含子突变是否致病的难点之一.对于SLC25A13基因来说,借助于活检肝组织或培养患者皮肤组织进行mRNA分析即可分析判断[1,13].在我国因为肝组织活检和皮肤成纤维细胞培养较难被患者接受,较为容易可以进行剪接分析的替代方法之一就是分析携带者外周血淋巴细胞(peripheral blood lymphocytes,PBLs)中SLC25A13 cDNA[20].分析可以在常规DNA分析未能找到突变的情况下,借助于mRNA的异常剪接情况提供的线索,结合内含子突变的家系遗传方式、人群携带率以及内含子变异的生物信息学分析等综合评估内含子突变对剪接的影响方式.本研究利用患者的PBMC的mRNA分析确认SLC25A13基因突变IVS6+5G>A (c.615+5G>A)[14];而由于未能及时采集到患者血液或肝活检组织时,如果发现可疑的内含子突变,则采用本研究使用的minigene剪接分析检测是一种可靠的替代方法.
