瓜蒌薤白半夏汤促进2型糖尿病合并急性心肌缺血大鼠内皮祖细胞动员的作用及其机制
2018-10-29郑梦梦赵启韬周继栋傅旎旎胡超群荀丽英
郑梦梦, 赵启韬, 周继栋, 傅旎旎, 胡超群, 荀丽英
(1.山东中医药大学药学院, 山东 济南 250355; 2. 山东中医药大学中医学院, 山东 济南 250355)
目前,糖尿病已经成为继肿瘤、心血管病变之后第三大严重威胁人类健康的慢性疾病,我国糖尿病的患病率呈快速上升的趋势[1].高血糖引起的血管内皮损伤,可引致一系列心血管疾病,如高血压、冠心病、动脉粥样硬化、心力衰竭及心肌梗死等.糖尿病患者患冠心病的危险程度是非糖尿病人群的2~4倍[2-3].
内皮祖细胞(endothelial progenitor cells, EPCs)是修复机体血管内皮层的重要力量,其功能状态反映了机体修复血管损伤的能力.EPCs动员能力的负性调节是导致糖尿病血管病变的关键因素.糖尿病患者外周血中内皮祖细胞(circulating endothelial progenitor cells,CEPCs)的数目随病变的程度而下降[4].EPCs动员功能的低下是导致糖尿病患者CEPCs水平低下、血管损伤修复能力减弱的直接原因,也是糖尿病血管并发症的关键致病因素.
现代中医临床研究证明,瓜蒌薤白半夏汤(Gualou Xiebai Banxia decoction,GXB)可用于痰浊壅塞胸膈、胸阳痹阻、胸背疼痛和不得安卧的胸痹证[5-7].对应西医临床的糖尿病合并冠心病心绞痛、心肌梗死、慢性心力衰竭和急性脑梗死等心脑血管疾病,均显示出显著的疗效,且不良反应轻微[8-9].然而,目前相关其分子机制和细胞信号调控靶点的研究尚处于初步阶段.本研究以2型糖尿病合并急性心肌梗死(type 2 diabetes complicated with acute myocardial ischemia,T2DM-AMI)大鼠模型为研究对象,经GXB干预,连续检测模型大鼠AMI后7 d外周血中CEPCs含量以及血管内皮生长因子(vascular endothelial growth factor,VEGF)、一氧化氮合成酶(nitric oxide synthetase,eNOS)、一氧化氮(nitric oxide,NO)含量变化,绘制7 d动态变化曲线,以明确GXB对EPCs的动员作用及机制,并从祖细胞层次阐明中药祛痰散结的可能作用机制.
1 材料与方法
1.1 实验动物
雄性 Wistar 大鼠,220~250 g,SPF级,由山东鲁抗动物实验中心提供,许可证编号:SCXK(鲁)20130001.饲养环境:室温 23~25 ℃,相对湿度为35%~65%.
适应性饲养一周后,168只大鼠随机分为3组,对照、模型、GXB组,每组56只.每组再分为7个亚组,即1~7亚组,每亚组8只大鼠.GXB组每天给予质量分数20 g/kg的GXB灌胃给药,对照组和模型组给予同容积生理盐水.T2DM造模成功后,各组大鼠连续给药7 d.第7天给药30 min后,实施冠状动脉结扎手术,对照组实施假手术.手术后各组大鼠继续灌服GXB或生理盐水,直至被处死.
1.2 药品与试剂
瓜蒌薤白半夏汤(GXB):瓜蒌240 g、薤白900 g、半夏120 g、黄酒250 mL,加水至盖过药材浸泡2~3 h,水开后小火煎煮20 min,倒出第1份药液.加热水浸过药物煎煮15 min倒出第2份药液,合并两次的水煎液浓缩至为生药质量浓度1 g/mL的煎液.
PE标记的小鼠抗大鼠CD34单克隆抗体(Abcam,ab187284), FITC标记的小鼠抗大鼠VEGFR-2抗体(Abcam,ab184903);链脲佐菌素(Streptozotocin, STZ):SIGMA 公司;总胆固醇(TC)测定试剂盒、甘油三酯(TG)测定试剂盒、高密度脂蛋白(HDL)测定试剂盒、低密度脂蛋白(LDL)测定试剂盒:北京信利来生物科技有限公司,20131212;肌酸激酶(CK)试剂盒、肌酸激酶同工酶 MB(CK-MB)试剂盒、乳酸脱氢酶(LDH)试剂盒、α剂羟丁酸脱氢酶试剂盒、天门冬氨酸氨基转移酶(AST)试剂盒:中生北控生物科技股份有限公司(20130612).
高脂乳配制:参考石鹤坤等[10]方法,胆固醇、猪油、胆酸钠、丙基硫氧嘧啶、吐温-80、丙二醇、水体积比为10∶20∶2∶1∶20∶20∶30.方法是将猪油加热融化,加入胆固醇、胆酸钠和丙基硫氧嘧啶,搅拌均匀,再加入吐温-80、丙二醇和蒸馏水,待固体完全溶解后,冷却至室温,得乳剂.
1.3 造模方法
高血脂模型大鼠制备:造模组大鼠灌服每天高脂乳,用量为10 mL/kg同时喂以普通饲料.空白对照组灌服相当剂量的生理盐水并喂以普通饲料.分别于灌服高脂乳后第 14、21天,乙醚麻醉大鼠后眼眶取血,连续两次测定血浆 TC,TG,LDL,HDL.测试数据取平均值,其中 TC,TG,LDL 升高,HDL 降低,与对照组比较有统计学差异(P<0.05),即视为高脂血症动物模型制作成功.
2型糖尿病大鼠模型制备:将造模成功的高脂血症大鼠,过夜禁食后称体质量. 大鼠腹腔注射质量分数为40 mg/kg STZ.3 d后,大鼠空腹18 h,尾静脉采集血样,检测血空腹葡萄糖含量.同时,所有大鼠给予葡萄糖水(质量分数2 g/kg)灌胃,进行口服葡萄糖耐量实验(oral glucose tolerance test, OGTT),2 h后测取餐后血糖.将空腹血糖浓度大于10 mmol/L或者餐后血糖浓度大于16.7 mmol/L 的大鼠视为高血糖造模成功大鼠.
T2DM-AMI模型的制备:糖尿病大鼠模型成立后,进行冠状动脉结扎,并在手术后停止给予高脂乳.参考赵启韬等[11]的方法,大鼠质量分数10%水合氯醛0.3 mL/100 g腹腔麻醉后,连接生物机能实验系统,进行气管插管,行人工呼吸.左侧第3、4 肋间开胸,剪开心包,暴露心肌,并将圆形无创伤缝合针6/0丝线置于左冠状动脉前降支起始部下2 mm处,结扎,以心肌颜色变暗红色为结扎成功的标志.
1.4 5项心肌酶谱检测
腹腔动脉取血5~8 mL,低温分离血浆(4 ℃,3 000 r/min,15 min),取上层血浆,按各试剂盒说明书进行操作,用半自动生化分析仪分别测定血浆5项心肌酶(CK、CK-MB、LDH、AST、α-HBDH)含量.
1.5 内皮祖细胞动员检测
在冠脉结扎手术后的1~7 d,分别对上述3组的1~7亚组大鼠,连续实施水合氯醛麻醉、腹主动脉取血、处死、取心脏,并利用流式细胞仪检测每只大鼠每毫升血液中CEPCs的数量.
1.6 流式细胞仪检测
CEPC细胞表面既表达干细胞的标志蛋白,如CD34等,也表达血管内皮细胞的标志蛋白,如vWF等[12].因此,本研究将表面同时表达CD34、vWF的单核细胞(MNC)作为内皮祖细胞.取新鲜全血,质量分数4%的乙二胺四乙酸二纳(ethylenediaminetetra acetic acid disodium salt,EDTA-2Na)抗凝,以PE-CD34抗体和异硫氰酸荧光素标记的血管假性血友病因子(FITC-vWF)抗体共同孵育30 min;溶血素(双蒸水1∶10稀释)室温避光裂解10 min.然后加入磷酸缓冲盐溶液(PBS)终止反应,1 200 r/min离心5 min,弃上清.重复清洗后PBS重悬,流式细胞仪检测.
1.7 酶联免疫检测
ELISIA 试剂盒检测血浆中 VEGF、eNOS、NO的水平,具体操作按照试剂盒说明进行.
1.8 统计方法
采用 SPSS 21.0 软件进行两独立样本t检验,两独立样本校正t检验和完全随机设计资料的方差分析,进一步两两比较采用LSD检验,P<0.05为差异有统计学意义.
2 结果
2.1 大鼠血脂水平测定
于灌服高脂乳后第 14天、 21天,对各组大鼠乙醚麻醉后眼眶取血,连续两次测定血浆 TC、TG、LDL和HDL,测试数据取平均值.结果如表1所示,与对照组比较,模型大鼠血浆 TC、TG和LDL 含量显著升高,血浆 HDL 浓度水平均有明显下降(P<0.01),说明高脂模型造模成功.

组别 nTCTGLDLHDL对照组81.38±0.142.16±0.130.39±0.110.78±0.12模型组89.14±1.019.63±1.201)3.56±1.431)0.34±0.061)
1)与对照组比较P<0.01
2.2 大鼠血糖浓度的测定
连续3 d注射SZT,最后一次注射SZT后的18 h,以及OGTT实验后2 h, 大鼠尾静脉取血.结果如下所示,模型组大鼠空腹血糖和餐后血糖升高极为显著,说明糖尿病模型造模成功.

组别n空腹18 hOGTT 2 h对照组84.69±0.8710.32±1.21模型组818.33±3.451)29.44±2.761)
1)与对照组比较P<0.05
2.3 各组大鼠心肌酶水平
利用生化试剂盒检测各组大鼠血浆中5项心肌酶活性,检测数据表明,与对照组相比,模型组大鼠血清5项心肌酶活性均显著升高(P<0.01).GXB可明显降低该模型鼠血清心肌酶活性.

组别nCKCK-MBASTLDHα-HBDH对照组8278.65±14.02219.56±18.1160.84±23.40136.23±16.40132.21±10.26模型组8898.71±26.551)672.32±35.561)203.56±32.121)535.20±14.281)275.09±28.151)GXB组8391.11±73.812)407.03±64.422)74.75±29.042)303.46±49.962)137.62±24.242)
1)与对照组比较P<0.01;2)与模型组比较P<0.01
1)与对照组比较P<0.01;2)与模型组比较P<0.01
2.4 GXB对T2DM-AMI大鼠CEPCs动员的作用
流式细胞仪检测结果如表4,图2所示,对照组CEPCs含量7 d内无明显变化.模型组大鼠该细胞含量手术后第3天急剧升高,第4天达到峰值,随即迅速下降.GXB组大鼠CEPCs数量心肌缺血后前4 d升高幅度和模型组相似,同样是在缺血后第4天达到峰值,但达到峰值后仍一直维持在较高水平,下降幅度很小(P<0.05).从冠状动脉结扎手术后第5天起,GXB组大鼠血液中CEPCs的含量就一直显著高于模型组(P<0.05).
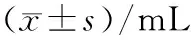

组别n1 d2 d3 d4 d5 d6 d7 d对照8569.42±48.22352.13±46.23462.79±103.5429.86±79.16479.83±39.87376.94±46.26448.47±86.47模型8569.42±48.22450.37±76.55331.05±49.461751.14±186.441)987.80±106.351)616.99±84.47607.07±59.35GXB8390.26±65.12607.46±49.31498.08±28.251605.43±158.331)1467.67±165.351)2)1239.72±145.21)2)1271.51±187.41)2)
1)与对照组比较P<0.05; 2)与模型组比较P<0.05
1)与模型组比较P<0.05;2)与对照组比较P<0.05
Fig.2 Changes of circulating endothelial progenitor cells in the blood of rats in each group within 7 days
2.5 大鼠血浆VEGF质量浓度变化
采用用ELISIA试剂盒检测各组大鼠血浆VEGF含量,数据表明,对照组含量一直无明显变化,处于基线水平,平稳波动;模型组含量整体呈现上升趋势,其中第4天达到顶峰并开始下降,而GXB组大鼠血浆VEGF含量上升幅度大、速度快,AMI后第5天即达到峰值,从第4天起就一直显著高于模型组大鼠(表5、图3,P<0.05).
2.6 大鼠血浆eNOS活性变化
血浆eNOS活性检测数据表明,对照组含量一直无明显变化,平稳波动.模型组大鼠血浆eNOS活性逐步上升,于AMI后第3天达到峰值并开始下降,但从 AMI 后第2天起一直显著高于对照组大鼠.GXB组大鼠血浆该酶活性 AMI 手术后第2天即显著高于模型组大鼠,而且该酶活性于AMI第3天后仍持续升高,第4天达到峰值并开始下降;但直至处死前一直显著高于对照组和模型组(图4、表6,P<0.05).
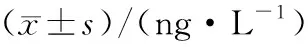

组别n1 d2 d3 d4 d5 d6 d7 d对照8304.66±36.21310.12±49.25324.68±26.54331.46±31.11312.41±26.40301.08±19.20310.95±27.44模型8297.97±29.87328.46±65.30357.52±45.211)386.60±54.691)368.03±16.541)309.12±59.501)309.19±64.111)GXB8310.20±24.23346.66±36.14402.40±48.52486.76±43.102)506.87±56.112)538.19±34.332)518.80±47.122)
1)与对照组比较P<0.05; 2)与模型组比较P<0.05
1)与模型组比较P<0.05;2)与对照组比较P<0.05
Fig.3 Changes of plasma VEGF levels in rats in each group
2.9 大鼠血浆NO含量变化
对照组大鼠血浆NO含量一直无明显变化,平稳波动.模型组含量整体呈现上升趋势,其中第4天达到顶峰并开始下降,但AMI后7 d内一直显著高于对照组大鼠.GXB组大鼠血浆NO含量变化曲线与模型组大鼠类似,即从第2天即明显升高,第4天达到峰值,其后开始下降,但整体处于较高水平,且显著高于模型组 (表7、图5,P<0.05).
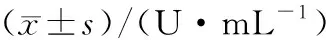

组别n1 d2 d3 d4 d5 d6 d7 d对照组81.75±0.241.88±0.331.59±0.251.72±0.361.47±0.061.80±0.111.67±0.21模型组82.19±0.252.39±0.351)2.92±0.251)2.42±0.341)2.83±0.361)2.67±0.151)2.39±0.181)GXB组82.94±0.251)3.40±0.361)2)3.32±0.441)4.61±0.121)2)4.18±0.341)2)3.82±0.251)2)3.69±0.311)2)
1)与对照组比较P<0.05; 2)与模型组比较P<0.05
1)与模型组比较P<0.05;2)与对照组比较P<0.05
Fig.4 Changes of plasma eNOS activity in each group of rats
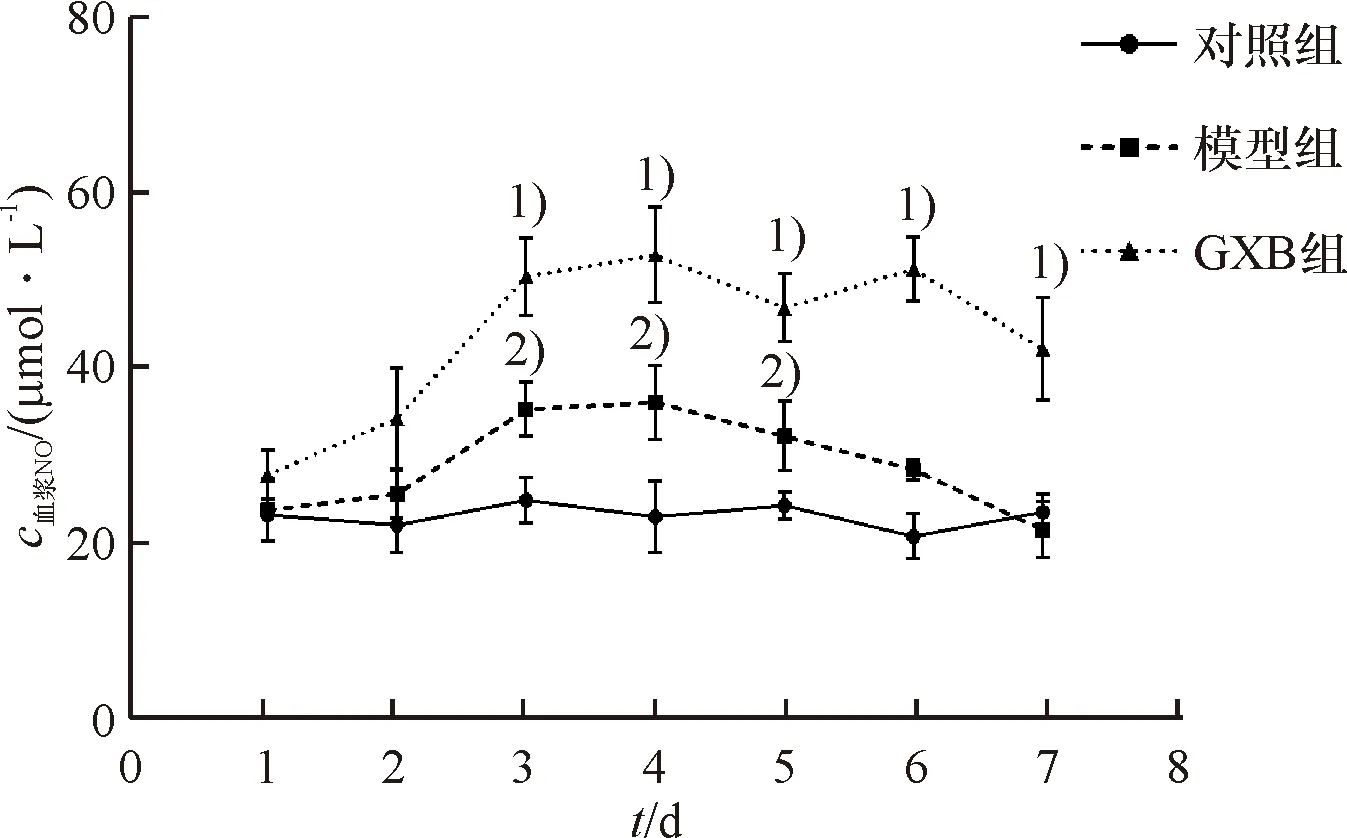
1)与模型组比较P<0.05;2)与对照组比较P<0.05
图5 各组大鼠血浆NO含量变化
Fig.5 Changes of plasma NO in rats in each group
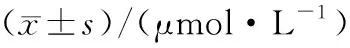

组别n1 d2 d3 d4 d5 d6 d7 d对照组823.54±0.6622.45±3.1025.23±2.5523.34±3.9824.62±1.5821.18±2.5523.89±1.97模型组824.11±3.4725.91±2.6635.36±2.981)36.14±4.121)32.39±3.871)28.61±1.1121.91±3.14GXB组828.07±2.6834.37±5.661)50.22±4.321)2)52.65±5.361)2)46.70±3.781)2)51.08±3.651)2)42.13±5.781)2)
1)与对照组比较P<0.05; 2)与模型组比较P<0.05
3 讨论
随着疾病谱的逐渐演变,2型糖尿病已经成为当代社会的常见病.在诸多并发症中,心血管疾病是糖尿病患者致死的主要原因.关于心血管疾病的发病机制,“内皮损伤反应学说”被多数学者接受.现代研究证明,骨髓中EPC动员的过程与VEGF、eNOS和NO等细胞因子有关[13-14].对eNOS-/-小鼠注入野生型EPCs后,被阻断的血管新生恢复正常,表明EPC的动员依赖于eNOS[15].2型糖尿病患者骨髓内皮祖细胞动员呈现负性调节,患者 CEPCs数目随病变的程度而下降.研究发现,2型糖尿病患者外周血中EPCs的数量与患者空腹血糖及糖化血红蛋白呈负相关,表现为EPCs数量减少,这种减少与EPCs寿命缩短或骨髓EPCs动员减少有关,其中寿命缩短可能由于细胞增殖减少和细胞死亡加速所致[16].
关于中药对EPCs动员的体内研究,多数是静态研究,即选取某一时间点,检测对照组、模型组、药物干预组患者或模型动物组细胞含量,分析各组间的差异.而骨髓EPCs的动员是一个动态变化的过程,静态的研究不能全面反应药物对该过程的干预作用.而本实验对T2DM-AMI模型大鼠7 d内EPCs动员的动力学进行了描述,更加准确地反映EPCs动员情况.
GXB是防治AMI、冠心病和高脂血症的常用的复方中药,它安全、有效而且价格低廉,因而被中医临床广泛使用.本课题组前期研究表明GXB对高血脂合并急性心肌梗死大鼠干预效果显著[17].本课题通过设计高血糖、高血脂伴急性心肌缺血大鼠模型,以GXB干预,不同时间点采集外周血,测定CEPCs含量,绘制其变化曲线,明确GXB对EPCs动员功能的影响.检测各组动物体内 EPCs动员的关键细胞因子的表达水平,研究GXB对EPCs动员关键细胞因子的调控作用.本研究发现GXB可以增加T2DM-AMI大鼠外周血CEPCs的浓度,上调血浆VEGF,eNOS和NO表达水平.该发现表明GXB可能通过上调血浆中VEGF,eNOS,NO的表达或分泌来调节骨髓EPCs的动员.
