黄连解毒汤对健康大鼠肠道菌群结构影响的研究
2018-10-29
中国中医科学院中药研究所 北京 100700
苦寒类中药是中药的重要组成部分,常用于中医临床,中医学认为“辛甘发散为阳,酸苦涌泻为阴”。传统的苦寒类中药例如黄连、黄芩、黄柏、栀子、大黄等,具有清热燥湿、泻火解毒等功效,其药性寒凉伤阳,苦则化燥伤津,耗伤胃液[1]。有关“苦寒伤胃”之说一直被历代中医药学家探讨,有动物实验表明长期大量使用苦寒中药会造成小鼠脾胃功能受损,肠道菌群失调[2-3]。
黄连解毒汤是清热解毒代表方剂,由黄连、黄芩、黄柏和栀子4味中药按3:2:2:3的比例配伍而成,主治实热火毒、三焦热盛之证[4]。有研究显示,长期高剂量应用黄连解毒汤复方会导致小鼠出现肠道益生菌(双歧杆菌和乳酸杆菌)数量减少等情况,表现出类似滥用抗生素的破坏作用[5];还有研究发现,黄连解毒汤低剂量使用或许有调节肠道菌群平衡的作用[5-6]。本实验采用Illumina高通量测序技术检测黄连解毒汤对健康大鼠肠道菌群结构的影响,以期为临床合理使用清热解毒方剂提供参考资料。
1 材料和方法
1.1 仪器与试剂 GeneAmpR9700型PCR仪为美国ABI公司产品,Illumina MiSeq platform基因组分析平台为美国Illumina公司产品,QuantiFluorTMST蓝色荧光定量系统为美国Promega公司产品。AxyPrep DNA凝胶回收试剂盒(AxyPrep DNA Gel Extration Kit)为美国 Axygen 公司产品(批号:19415KE1);2%琼脂糖凝胶与Tris-HCl均为美国Thermo Fisher公司产品(批号:16500500、15506017);EZNA stool DNA kit为美国Omega Bio-tek公司产品 (批号:D4015-00)。
1.2 方法
1.2.1 黄连解毒汤提取物制备 黄连(Rhizoma Coptidis Franch.,产地为重庆石柱县)、黄芩(Radix Scutellariae Georgi,产地为河北省承德围场县)、黄柏(Phellodendri Chinensis C.K.Schneid.,产地为重庆新都县)、栀子(Gardeniae jasminoides J.Ellis,产地为江西省樟树市),均购于北京仟草中药饮片有限公司,经中国中医科学院中药研究所何希荣教授鉴定可用于实验研究。粉碎后,黄连、黄芩、黄柏、栀子按比例3:2:2:3混匀,依次用10倍量、8倍量水,分别提取两次,每次1.5h,过滤,合并滤液,浓缩,80℃减压干燥成粉。
1.2.2 标本的采集与处理 雄性SPF级Wistar大鼠20 只,体质量(200±20)g,购自北京维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(京)2016-0011],饲养于中国中医科学院医学实验中心[实验动物使用许可证号:SYXK(京)2015-0041]。动物适应期为7d。大鼠按体重分为两组,空白对照组10只,分别以C1~C10表示;黄连解毒汤组10只,分别以H1~H10表示。
两组大鼠第1次给药前禁食12h,黄连解毒汤组按照700mg/kg的剂量给予黄连解毒汤提取物粉末溶液灌胃,使用剂量按临床使用剂量进行折算,折合生药剂量约为3.5g/kg;空白对照组给予相同体积的0.9%氯化钠溶液灌胃。两组均连续给药7d,自由饮食。腹部挤压法收集两组大鼠第7天的粪便,粪便取出后装入5mL离心管中,立即放入干冰转移至-80℃保存。
1.2.3 肠道基因DNA的提取 采用试剂盒EZNA stool DNA kit提取细菌总DNA。具体操作按照试剂盒说明书进行,DNA提取完成后,利用1%琼脂糖凝胶电泳检测基因组DNA完整性和DNA总量。
1.2.4 PCR扩增16S rRNA基因V3-V4区 16S rRNA基因V3-V4区PCR扩增所用引物为338F(5’-ACTCCTACGGGAGGCAGCA-3’),806R (5’-GGACTACHVGGGTWTCTAAT-3’),引物由生工生物工程(上海)有限公司合成。反应体系为:5×Fast Pfu Buffer 4μL,2.5mmol·L-1dNTPs 2μL,5μmol·L-1上游引 物 0.6μL,5μmol·L-1下 游 引 物 0.6μL,Fast Pfu Polymerase 0.4μL,Template DNA 10ng。反应条件:95℃ 2min,95℃ 0.5min,27个循环。55℃ 0.5min,72℃0.75min,72℃ 10min,10℃结束。每个样本重复3次,将同一样本的PCR产物混合后以2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收,Tris-HCl洗脱,2%琼脂糖凝胶电泳检测。
1.2.5 荧光定量 PCR产物采用QuantiFluorTMST蓝色荧光定量系统进行定量检测,之后按照每个样本的测序量要求,进行相应比例混合。
1.2.6 Miseq文库构建 连接“Y”字形接头;使用磁珠筛选去除接头自连片段;利用PCR扩增进行文库模板的富集;氢氧化钠变性,产生单链DNA片段。
1.2.7 Miseq上机测序 DNA片段的一端与引物碱基互补,固定在芯片上;另一端随机与附近的另外一个引物互补,固定形成“桥 (bridge)”;PCR扩增,产生DNA簇;DNA扩增子线性化成为单链;加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3'末端粘性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
1.3 统计学分析 采用SPSS 19.0统计软件进行统计学分析,对属于正态分布的数据资料进行对数处理后(log copies/g)以±s表示,组间两两比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肠道细菌总DNA完整性、纯度测定 采用NanoDrop超微量分光光度法测定总DNA的OD260/OD280的比值均在1.6~1.9,说明提取的DNA纯度较高,无蛋白质及RNA污染。所提取的DNA样品取2μL进行1.0%琼脂糖凝胶电泳可见清晰条带,提示DNA样品完整性良好。见图1。
2.2 PCR扩增结果 PCR产物目的条带大小正确,浓度合适,可进行后续实验。见图2。
图1 大鼠肠道细菌总DNA琼脂糖电泳图Fig.1 DNA glue diagram of intestinal flora in rats
2.3 两组大鼠肠道菌群门和属水平上的结构差异采用两独立样本t检验对两组大鼠肠道菌群门、属水平进行统计学分析。两组样本中以厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)丰度较高。经t检验和FDR校正提示,服用黄连解毒汤临床剂量7d后可以显著降低正常大鼠肠道中放线菌门和厚壁菌门细菌占总菌的比例,两组差异均有统计学意义(P<0.05)。见图3、表1。

图2 16S rRNA基因V3-V4区PCR扩增结果Fig.2 PCR amplification results of V3-V4 area of 16S rRNA
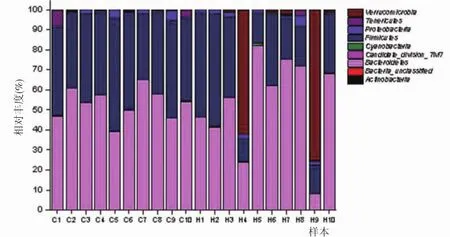
图3 两组大鼠肠道菌群门水平比较Fig.3 Comparison of intestinal flora between two groups on the levels of phylum
属水平分析结果提示,黄连解毒汤组大鼠肠道中Adlercreutzia菌属、克里斯滕森菌属(Christensenellaceae)、消化链球菌属(Peptococcaceae)比例低于空白对照组,而嗜胆菌属(Bilophila)比例则高于空白对照组,差异均有统计学意义(P<0.05,P<0.01)。见图 4、表2。
表1 两组大鼠肠道菌群门水平比较(±s,%)Tab.1 Comparison of intestinal flora between two groups on the levels of phylum(±s,%)

表1 两组大鼠肠道菌群门水平比较(±s,%)Tab.1 Comparison of intestinal flora between two groups on the levels of phylum(±s,%)
名称 n 黄连解毒汤组放线菌门(Actinobacteria)厚壁菌门(Firmicutes)10 10 0.027±0.025 29.783±16.041空白对照组 P值0.070±0.043 43.772±6.630 0.013 0.020

图4 两组大鼠肠道菌群属水平比较Fig.4 Comparison of intestinal flora between two groups on the level of genus
表2 两组大鼠肠道细菌属水平菌群比较(±s,%)Tab.2 Comparison of intestinal flora between two groups on the level of genus(±s,%)

表2 两组大鼠肠道细菌属水平菌群比较(±s,%)Tab.2 Comparison of intestinal flora between two groups on the level of genus(±s,%)
?
3 讨论
肠道菌群被视为人体的一个重要“器官”[7],能够调节宿主的三大物质代谢。健康大鼠的肠道菌群结构受到宿主遗传表型、饮食、性别等因素的影响。当宿主各方面相对稳定的情况下,宿主肠道菌群结构的变化很大程度上与机体的生理及病理状态有关。本实验通过单变量分析,采用Illumina高通量测序方法对黄连解毒汤组和空白对照组大鼠肠道的菌群进行定量检测,结果显示在临床剂量下,连续服用黄连解毒汤7d能够引起健康大鼠部分肠道菌群比例的明显变化。
在门水平菌群变化中,与空白对照组比较,服用黄连解毒汤临床剂量7d后可以显著降低健康大鼠肠道中放线菌门和厚壁菌门细菌所占的比例,两组差异具有统计学意义。其中,放线菌能产生丰富的生物活性物质,是天然药物的重要来源,其代谢活性物质具有抗菌、抗肿瘤、抗病毒等活性,至今发现的天然抗生素中有三分之二是由放线菌产生,放线菌已被认为是新抗生素产生的主要来源[8-9]。服用黄连解毒汤临床剂量7d后,放线菌门比例显著下降,说明一定剂量的黄连解毒汤可能能够调节菌群比例,这与文献报道低剂量黄连解毒汤或许有调节肠道菌群平衡的作用相符合[5-6]。
厚壁菌门是人体及高等哺乳动物肠道内最有优势的一大类细菌,比例约占总菌群的50%~60%,厚壁菌门是一类与肥胖有关的肠道菌,能够降解不溶性纤维。研究证实,肠道正常菌群可能参与饮食引起的肥胖,当肠道内厚壁菌门的含量超过拟杆菌门,对食物中热量的吸收会更有效,从而导致机体肥胖[10]。文献报道,“中满内热”是肥胖2型糖尿病的核心病机,以苦寒类中药治疗,清热燥湿、泻火解毒能够重折其热、护卫阴液[11]。另有研究发现黄连解毒汤除了解热、抗菌、抗炎外,还具有抗氧化、改善脑缺血、降血糖、降血脂、抗肿瘤等作用[4,12]。研究发现,一定剂量的黄连解毒汤持续给药能有效调节高脂血症大鼠的血脂代谢和炎症因子;可对抗高脂所致的大鼠血糖升高,降低大鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C) 水 平 及 脂 肪 组 织CCAAT增强子结合蛋白α(CCAAT enhancer binding protein α,CEBPα)水平,升高血清高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平,使得大鼠体重减轻[13-15]。本研究提示,黄连解毒汤可显著降低大鼠肠道厚壁菌门细菌的比例,提示黄连解毒汤对体重可能会有一定的改善作用,与文献报道结果相符。
在属水平上,本研究发现黄连解毒汤能够引起大鼠肠道4个关键菌属发生变化,其中Adlercreutzia菌、消化链球菌和克里斯滕森菌所占总菌的比例显著降低,而嗜胆菌所占比例增加。Adlercreutzia菌具有一定的免疫调节作用;克里斯滕森菌与肥胖指数有关[16];消化链球菌是革兰阳性厌氧球菌中最常见的菌种,易变为革兰阴性菌,是人体口腔、上呼吸道、肠道和女性生殖道的正常菌群[17],常和其他菌混合感染,也可单独感染;嗜胆菌会引发小鼠结肠炎,以动物制品为主要食物的动物肠道中丰度会显著增加[18]。消化链球菌等致病菌的丰度显著性下降,说明黄连解毒汤在抗菌及抗炎方面存在一定疗效,而对Adlercreutzia菌、嗜胆菌、克里斯滕森菌等菌属的具体作用机制仍待进一步研究。一定剂量的黄连解毒汤给药后通过调节关键菌属的丰度比例,从而调整肠道微生物稳态,由此可能进一步影响到大鼠的正常生长,这可能与菌属本身具有免疫调节作用,易致炎症产生等特点有关,同时也取决于大鼠本身的生理状态。
综上所述,本研究发现一定剂量的黄连解毒汤可能通过调节肠道菌群的种类、数量、比例等,影响肠道微生物稳态。本研究为黄连解毒汤的临床应用提供了参考,而黄连解毒汤影响肠道菌群的具体机制有待于进一步研究。
