“上火”人群的肠道微生物结构特征研究
2018-10-29
浙江中医药大学基础医学院中医临床基础研究所 杭州 310053
“上火”是中医学上特有的病名,属于“火热证”范畴。调查显示在中国91%的成年人有过“上火”经历[1]。“上火”症状表现形式多样,包括口腔溃疡、牙龈红肿、唇周面部疱疹、双目红赤、口干眼干、尿赤、便秘等。现代医学把“上火”视为“亚健康”状态和代偿范围内的急性应激反应,是免疫功能下降时出现的炎症和局部感染[2]。现代医学对“上火”相关病证的研究发现,其发病多与环境、饮食、情志、遗传、免疫、微生物等因素相关[3]。
情志刺激、过食辛辣燥热、劳累过度和微生物感染等因素可引起体内微环境变化,导致黏膜上皮组织的糖酵解功能活跃,从而导致能量代谢紊乱,进一步引起黏膜损伤,使黏膜免疫系统中Th17/Treg细胞比例上调,分泌型免疫球蛋白A(immunoglobulin A,I-gA)分泌减少,局部黏膜免疫力下降,易继发感染,进而加重黏膜损伤[4]。因此,“上火”人群中普遍存在着体内能量代谢的紊乱及黏膜免疫的异常。
近年来,研究证实肠道微生物在机体能量代谢和黏膜免疫方面发挥重要作用[5-6]。肠道微生物通过多条途径参与机体的能量代谢,包括对不能被人体细胞消化的膳食纤维进行酵解、对肽类或蛋白质进行无氧酵解、胆汁酸的生物转化和草酸盐复合物的降解等[7]。另外,肠道菌群可通过在肠道中定植,构建肠道免疫屏障;肠道细菌在死亡或增殖时,不断向外界释放脂多糖、肽聚糖或磷脂壁酸等刺激物,这些物质进入血液,从而引起全身黏膜免疫反应[6]。综上所述,肠道菌群可通过影响能量代谢和黏膜免疫,参与“上火”的发生。
为明确“上火”人群的肠道菌群结构特征,本研究采用Illumina MiSeq测序技术检测“上火”人群和健康人群的肠道菌群结构,进一步了解“上火”相关的肠道菌群种类的变化。
1 材料和方法
1.1 样本来源 样本采集时间为2016年8月至2017年5月,采集对象为浙江中医药大学全日制各专业在读本科生。所有研究对象均自愿加入“上火”项目研究,均符合相应的中医诊断标准、“上火”人群和健康人群的纳入标准及排除标准。
1.2 诊断标准、纳入标准和排除标准
1.2.1“上火”人群诊断标准 采用专家咨询法,确定“上火”的诊断标准:1个主症(头面部症状)或2个次症(至少1个为头面部症状)。主症:牙龈肿痛、咽喉肿痛、口臭、口腔溃疡、鼻疮疖、热疮(颜面部疱疹)、口苦和目赤干涩。次症:口角糜烂、目眵增多、口渴、舌痛、痤疮、鼻腔干燥、齿衄、鼻衄、声音嘶哑、头痛、大便干结、小便黄、心烦、五心烦热、多食易饥、痔疮发作、潮热和失眠。
1.2.2 健康人群入选标准 正常对照组为健康的大学生,近半年内无“上火”病史(根据前文提到的“上火”诊断标准),无心脑血管病史及其他重大内科疾病史,无结核、伤寒或肝炎等传染病史;三大常规、肝肾功能、胸片、B超、心电图等指标无明显异常;体格检查无明显异常;近1个月内无腹泻或胃肠病史,无用药及服用微生态制剂史;无吸烟、饮酒等不良嗜好;舌质淡红,苔薄白,脉象正常。
1.2.3 纳入标准 (1)符合“上火”的诊断标准;(2)符合上述标准的健康体检者;(3)年龄18~35岁;(4)自愿参加本实验并签署临床研究知情同意书。
1.2.4 排除标准 (1)由于抗生素、激素等药物的使用引起“上火”表现者;(2)有重大内科疾病、消化道疾病者或精神疾病不能配合者;(3)妊娠或哺乳期妇女;(4)存在研究者认为不适合纳入的其他情况。
1.3 样本采集 样本采集前,采用调查问卷形式详细记录受试者的年龄、性别、身高、体质量、饮食习惯及饮食结构等特征,记录中医证候。粪便样本采集前,先排净小便,防止尿液污染粪便。用无菌一次性采样杯采集新鲜粪便样本后置于冰盒内,迅速将粪便运回实验室进行按20mg/管分装,随即置于-80℃冰箱中保存。
1.4 标本收集及检测
1.4.1 粪便DNA提取、扩增和测序 采用粪便DNA提取试剂盒QIAamp Fast DNA Stool Mini Kit(德国Qiagen公司产品,批号:51304)抽提粪便DNA。检查DNA浓度,并用1%琼脂糖凝胶电泳检测。合格后,采用16S rRNA基因的V3-V4区引物对基因组进行扩增。扩增引物上下游分别是上游5’-X-ACTCCTACGGGAGGCAGCA-3’ 和 下 游 5’-GGACTACHVGGGTWTCTAAT-3’,引物由Invitrogen公司合成,“X”为区别不同样本的8个随机组合的核苷酸碱基片段(barcode)。PCR扩增前,模板浓度统一稀释到 20ng·μL-1。扩增体系如下:5×反应缓冲液 5μL、5×GC 缓冲液 5μL、100mmol·L-1dNTP 5μL、10μmol·L-1上游引物 1μL、10μmol·L-1下游引物 1μL、DNA 模板2μL、ddH2O 6μL。反应总体系共 25μL。反应条件:初始变性 98℃ 2min,变性 98℃ 15s,退火 55℃ 30s,延伸72℃ 30s,共25个循环。72℃延伸5min,10℃保存。
PCR扩增产物质检合格后,进行文库构建,采用Illumina MiSeq测序平台进行250bp×2双末端测序;下机进行测序原始数据整理、过滤及质量评估;序列进行质控过滤后,接下来进行操作分类单元(operational taxonomic units,OTUs)列表生成及注释。
1.4.2 数据整理、过滤及质量评估 测序完成后,对原始数据进行处理,步骤如下:(1)采用滑动窗口法对双端的FASTQ序列进行质量过滤,截掉质量低的数据;(2)利用FLASH软件(v1.2.7)对通过质量初筛的双端序列根据重叠碱基进行配对连接,并根据barcode序列将序列拆分,各自回归到对应样品;(3)运用QIIME软件(v1.8.0)识别疑问序列,保留长度>150bp和不存在模糊碱基N的序列,并调用USEARCH(v5.2.236)检查并剔除嵌合体序列,从而获得最后用于分析的序列。
1.4.3 多样性和群落结构分析 调用QIIME软件中的UCLUST程序,对获得的序列按97%的序列相似度进行归并和OTU划分,根据OTU在每个样本中所包含的序列数,构建OTU在各样本中丰度的矩阵文件。采用QIIME软件对样品序列进行Alpha多样性分析,包括ACE指数和Chao1指数,并采用SPSS 16.0统计软件进行两类人群间单因素方差分析。选择OTUs中的一条代表序列(默认丰度最高),采用Ribosomal数 据 库 (Ribosomaldatabase project,RDP)进行OTU分类地位鉴定。使用R软件,根据OTU丰度矩阵和样本分组数据构建PCoA分析,评估微生物群落的整体差异;根据OTU丰度矩阵表,使用在线分析软件LEfSe(http://huttenhower.sph.harvard.edu/galaxy)分析健康人群与“上火”人群间差异的肠道菌群种类,线性判别分析(linear discriminant analysis,LDA)得分大于 2,且 Kruskall-Wallis检验值小于0.05即为差异显著。
2 结果
2.1 受试者临床样本信息统计分析 根据上述诊断、纳入及排除标准,共纳入35例“上火”人群,男女比例为0.84:1,平均年龄为24.4岁,平均体重指数(body mass index,BMI)为 23.2kg/m2。为匹配“上火”人群的样本信息,同时收集了健康人群35例,男女比例为0.67:1,平均年龄为23.7岁,平均BMI为22.3kg/m2。见表1。两组基本信息采用方差分析比较,结果显示组间差异无统计学意义(P>0.05)。

表1 临床研究人群基本信息Tab.1 Basic information of clinical study population
2.2 两组受试者Alpha多样性指数比较分析 本研究采用Chao1和ACE两种Alpha多样性指数反映健康人群和“上火”人群的肠道菌群多样性。“上火”人群的肠道微生物多样性平均指数均低于健康人群,但两组之间无统计学差异(P>0.05)。一般来说,Alpha多样性指数值越高,表明群落的多样性越高。因此,“上火”可能会导致肠道菌群多样性略微降低。见图1。
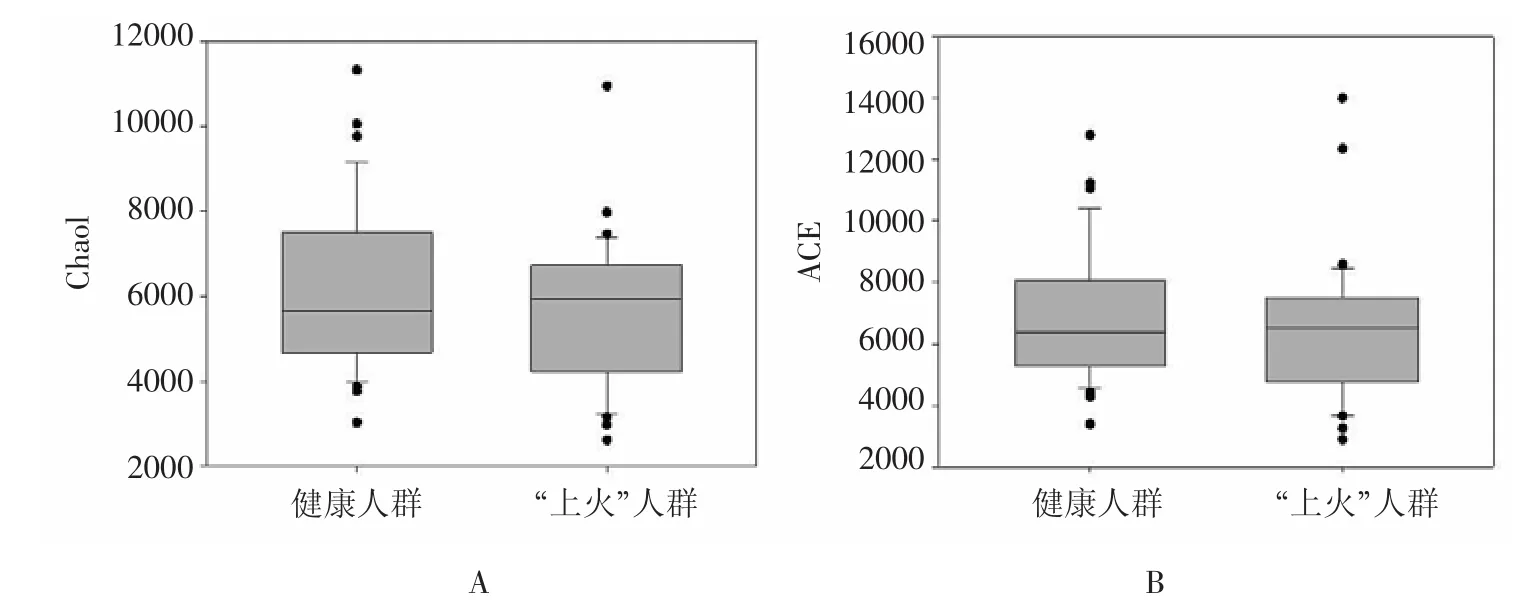
图1 健康人群与“上火”人群的Alpha多样性指数比较Fig.1 Comparison of Alpha indices between healthy and“Shanghuo”individuals
2.3 两组受试者Beta多样性比较分析 健康人群和“上火”人群的肠道菌群差异可以通过PCoA分析进行归类,PC1和PC2分别为12.94%和6.26%。两种人群在PCoA图上均能各自聚类,但有部分重叠,说明两类人群的肠道菌群Beta多样性具有差异。见图2。
2.4 健康人群与“上火”人群的差异肠道菌群分析图3展示了健康人群和“上火”人群之间的差异肠道菌群发育树图,由LEfSe在线分析程序获得,其中显著差异的logarithmic LDA score设为3。绿色节点代表健康人群高于“上火”人群的肠道菌群种类,红色节点代表“上火”人群显著高于健康人群的肠道菌群种类。
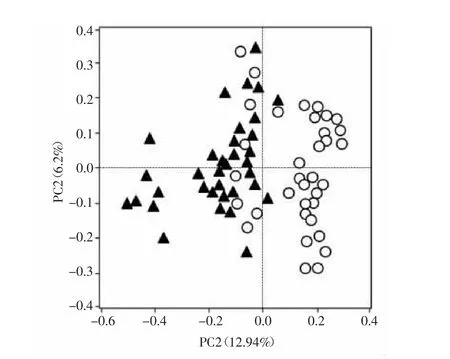
图2 基于OTU丰度矩阵表的PCoA判别分析Fig.2 PCoA analysis based on OTU abundance of gut microbiome individuals.
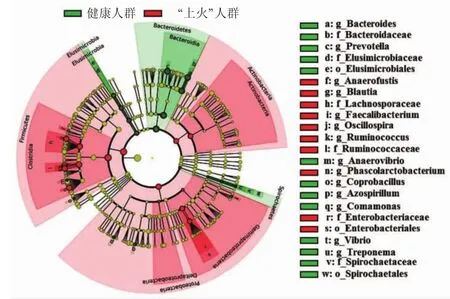
图3 健康人群与“上火”人群间差异肠道菌群的LEfSe分析Fig.3 LEfSe analysis reveals the significantly different gut microbiota between healthy and“Shanghuo”individuals
在微生物门水平上,健康人群与“上火”人群间显著差异的种类包括6个,分别是放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、螺旋体门(Spirochaetes)、拟杆菌门(Bacteroidetes)和迷踪菌门(Elusimicrobia),前三个门在“上火”人群肠道内含量显著上调,后三个门在“上火”人群肠道内含量显著下调。
在微生物属水平上,LEfSe共鉴定出13个属在两种人群中存在显著差异。在放线菌门(Firmicutes)中,包括8个显著差异属,分别是厌氧管状菌属A(Naerofustis)、布劳特菌属(Blautia)、栖粪杆菌属(Faecalibacterium)、颤螺菌属(Oscillospira)、瘤胃球菌属(Ruminococcus)、厌氧弧菌属(Anaerovibrio)、考拉杆菌属(Phascolarctobacterium) 和粪芽孢菌属(Coprobacillus),它们均在“上火”人群中显著上调。变形菌门(Proteobacteria)包括2个在“上火”人群肠道内显著上调的属,分别是固氮螺菌属(Azospirillum)和丛毛单胞菌属(Comamonas)。除了在“上火”人群中上调的微生物属,还包括“上火”人群中下调的微生物属,分别是拟杆菌门(Bacteroidetes)中的B拟杆菌属(Acteroides)和普氏菌属(Prevotella),及螺旋体门(Spirochaetes)中的密螺旋体属(Treponema)。在放线菌门(Actinobacteria)和迷踪菌门(Elusimicrobia)中未发现显著差异的属。
3 讨论
中医认为“上火”者体内会出现阴阳失衡、火热旺盛,导致能量代谢紊乱及黏膜免疫失调。肠道微生物可参与机体能量的产生、转化、储存和利用,并通过改变组织对能量的利用方式和AMP依赖的蛋白激酶(adenosine 5’monophosphate activated protein kinase,AMPK)磷酸化等途径来影响机体的能量代谢[8];同时,肠道菌群可调控免疫效应因子,如sIgA的产生,以及模式识别受体如Toll样受体(toll-like receptor,TLR)等的活化,从而影响机体的肠道黏膜免疫[9]。因此,本研究结果揭示的“上火”人群肠道微生物的变化,有助于解析“上火”能量代谢物紊乱和黏膜免疫失调的现象。
在肠道微生物中,厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)是两个占主要地位的门,两者比例在90%以上[6]。厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)比例的上调指示了肥胖患者肠道内的慢性炎症发生[10]。在“上火”人群肠道内,厚壁菌门/拟杆菌门的比例也出现明显上调,这说明“上火”人群的肠道内可能存在炎症。除此之外,食用肉类增加或食用纤维素下降可上调厚壁菌门/拟杆菌门的比例[11],上述饮食习惯也是“上火”的主要诱因。
在微生物属水平上,某些变化的肠道微生物属与“上火”相关的能量代谢紊乱相关。颤螺菌属(Oscillospira)能帮助宿主细胞降解糖类物质,从而提供能量[12];瘤胃球菌属(Ruminococcus)通过产生短链脂肪酸类物质为宿主细胞提供能量[13];考拉杆菌属(Phascolarctobacterium)在肠道内可通过降解琥珀酸盐为宿主提供能量[14]。因此,这些与宿主能量代谢相关的菌属在“上火”人群中上调,可能是引起能量代谢紊乱的因素之一。另外,某些变化的肠道微生物属也与“上火”相关的免疫失调相关:瘤胃球菌属(Ruminococcus)丰度上调,可导致肠道黏膜层降解,肠道屏障不稳定和轻度黏膜免疫失调[15];普氏菌属(Prevotella)通过活化TLR2,调控Th17细胞相关的免疫因子,从而引起黏膜免疫失调[16];栖粪杆菌属(Faecalibacterium)可通过调控核因子-κB(nuclear factor-κB,NF-κB)途径,抑制炎症反应,帮助宿主机体抵抗炎症[17]。
综上所述,本研究结果证实“上火”发生与肠道菌群改变相关,变化的肠道菌群在一定程度上能反映“上火”导致的能量代谢紊乱和黏膜免疫失衡。
