LPS诱导斑马鱼炎症实热模型构建及脂质生物标志物筛选研究
2018-10-29
中国中医科学院中药研究所 北京 100700
细菌内毒素,又称脂多糖(lipopolysaccharide,LPS),是所有革兰阴性细菌细胞壁外膜的主要结构成分,由多糖和脂质A组成,能够引起动物机体发热、免疫功能紊乱、微循环障碍及多器官炎症等[1-2]。LPS引起机体损伤的机制通常首先是激活单核-巨噬细胞系统,诱导分泌多种炎性介质分子,然后通过这些介质分子在局部或机体其它部分引发炎症反应,造成损伤。另外,LPS还可直接作用于内皮细胞、成纤维细胞等靶细胞,使其表面分子表达异常,细胞膜通透性增加,而造成损伤[3-4]。LPS具有很强的致炎活性,根据中医理论,内毒素属于“热邪”。现代医学的“炎”与中医的“火”较相似,中医所讲的实热证也属于“炎症”范畴[5-6],因此推测LPS在诱导产生感染性炎症的同时也会引发机体实热症状。目前,对于LPS诱导炎症的机制研究主要集中于抗炎药物药效的评价筛选,然而从内源性脂质分子层面的研究鲜有报道。
本实验采用荧光标记转基因中性粒细胞斑马鱼,建立LPS诱导的炎症斑马鱼模型,结合活体成像系统实时监测中性粒细胞炎症迁移过程;计算荧光下斑炎症马鱼中性粒细胞的个数。通过超高效液相色谱串联质谱(ultra performance liquid chromatography-Q exactive-mass spectrometry,UPLC-QE-MS)技术进行脂质组学检测,根据多元统计分析比较模型组和正常对照组斑马鱼的代谢图谱,寻找潜在生物标志物,以期为LPS诱导的炎症及可能引发的实热症状的早期诊断和预防提供帮助。
1 材料和方法
1.1 主要仪器及试剂 DionexTMUltiMateTM3000超快速液相色谱、Q ExactiveTM四极杆轨道离子阱质谱、SavantTMSPD131DDA SpeedVacTM真空离心浓缩仪均为Thermo Fisher Scientific公司产品;Mix-3000震荡混匀器购于杭州米欧仪器有限公司;Mikro 220R台式高速冷冻离心机购于Hettich公司;SMZ645解剖显微镜、AZ100电动聚焦连续变倍荧光显微镜、与显微镜相连的相机(TK-C1481EC)均为日本Nikon公司产品;CP214精密电子天平为奥豪斯公司产品。
二甲基亚砜(dimethyl sulfoxide,DMSO)、甲基纤维素、LPS均购于Sigma公司(批号:BCBV2983、079K0054V、017M4112V)。甲酸、甲醇、乙腈均购于Fisher Scientific公司(批号:A117-50、A456-4、A955-4);乙酸铵为Sigma-Aldrich公司产品(批号:238074-25G)。以上化学品和试剂均为分析纯。
1.2 斑马鱼品系及饲养方法 荧光标记的转基因中性粒细胞斑马鱼(3 dpf)60尾、28℃养鱼用水(水质:每1L反渗透水加入200mg速溶海盐,电导率为480~510μS/cm;pH 为 6.9~7.2;硬度为 53.7~71.6mg·L-1Ca-CO3)均由杭州环特生物科技股份有限公司养鱼中心繁殖饲养并提供,实验动物使用许可证号:SYXK(浙)2012-0171。饲养管理符合国际AAALAC认证的要求。
1.3 实验方法
1.3.1 斑马鱼炎症模型建立 3 dpf转基因中性粒细胞斑马鱼中随机选择30尾,以卵黄囊注射LPS的给样方式建立斑马鱼炎症模型,余下30尾以养鱼用水处理的斑马鱼设为正常对照组。两组分别置于28℃培养箱中培养3h后,每组随机取10尾斑马鱼在荧光显微镜下观察、拍照并保存图片;用尼康NIS-Elements D 3.10高级图像处理软件进行图像分析,计算斑马鱼炎症中性粒细胞个数(N),以斑马鱼炎症中性粒细胞个数的统计学分析结果来评价LPS诱导的炎症斑马鱼模型是否建立成功[7-8]。
1.3.2 样品预处理 建模成功后,收集斑马鱼正常对照组和模型组样本,向1.5mL EP管中加入氯仿:甲醇为3:1的混合物1mL,超声15min震荡提取;取下层氯仿500μL浓缩干燥,加入异丙醇:乙腈为1:1的混合物200μL复溶;涡旋15s,4℃下12 000r/min离心10min;取上清液100μL,置于内衬管中,进样待测。
1.3.3 液相色谱-质谱联用 (liquid chromatographymass spectrometry,LC-MS)检测方法 液相色谱条件:采用DionexTMUltiMateTM3000快速液相色谱,色谱 柱 为 WatersUPLC HSST3(1.8μm,2.1mm ×100mm),流动相为 A(乙腈:水 4:6、0.1%甲酸、10mmol·L-1乙酸铵)和 B(乙腈:异丙醇 9:1、0.1%甲酸、10mmol·L-1乙酸铵);流速为 0.3mL·min-1;进样量为 1.0μL;柱温:50℃;梯度洗脱条件为 0~2min,20~30 B%;2~5min,30~45 B%;5~6.5min,45~60 B%;6.5~12min,60~65 B%;12~14min,65~85 B%;14~17.5min,85~100 B%;17.5~18min,100~100 B%;18~18.1min,100~20 B%;18.1~19.5min,20~20 B%。
质谱条件:电喷雾离子源,正负离子检测模式采集,离子源电压分别为3.7kV和3.5kV;毛细管加热温度320℃;鞘气压力30psi,辅助气压力10psi;容积加热蒸发温度300℃;鞘气和辅助气均为N2,碰撞气为N2,压力为1.5mTorr。一级全扫描参数:分辨率70 000,自动增益控制目标为1×106,最大隔离时间50ms,质荷比扫描范围50~1 500。
1.4 数据处理 采用Xcalibur 2.2 SP1.48软件对采集的数据进行色谱峰识别、校正和归一化处理,然后导入SIMCA 14.1软件(Umetrics),对数据进行分组和正交偏最小二乘法-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),O-PLS-DA模型下的S-plot图上距原点越远的点表明该差异物对模式识别模型的贡献越大。以变量投影重要性指标(variable importance in the projection,VIP)>1的脂类化合物作为对模型有贡献度的标志物,模型组和正常对照组的组间比较采用Progenesis QI中的t检验,按P<0.05及模型组与正常对照组之间的变化倍数(fold change,FC)来寻找正常对照组和模型组之间的差异变量。差异性代谢物的定性方法为:搜索HMDB(网址为http://www.hmdb.ca/)和 LIPIDMAPS(网址为http://www.lipidmaps.org/)等在线数据库,比较一级质谱信息精确分子质量,误差限制为0.01Da,通过多级质谱信息碎片推测代谢物结构。
2 结果
2.1 模型建立的评价 模型组斑马鱼炎症部位中性粒细胞个数(18个)与正常对照组(2个)比较,差异具有统计学意义(P<0.001),显示LPS诱发转基因中性粒细胞荧光斑马鱼炎症模型建立成功。见图1。
2.2 数据分析 利用ESI正负离子模式分别采集正常对照组和模型组样本数据,采集过程中每间隔6~8个样本插入1个质控样本,用于监测整个液质系统的稳定性和重复性,同时计算质控样本中提取的代谢特征的变异系数值,变异系数超过15%的代谢特征被删除。采用监督性的多维统计方法即OPLS-DA对代谢物进行分析,在正负离子模式下模型参数R2Y分别为0.911和0.770,表明炎症模型建立成功。见图2-3。根据VIP值、P值及FC值等指标衡量两组之间差异脂质的变量权重,结果显示正常对照组和模型组明显分离,说明LPS对斑马鱼脂质代谢网络产生较大影响。见图4-5和表1。
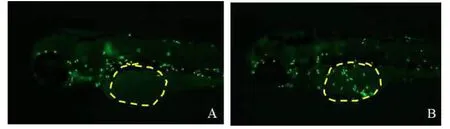
图1 斑马鱼正常对照组与模型组表型图(80×)Fig.1 Zebrafish normal control group and model group phenotype map(80×)
2.3 组间潜在生物标志物鉴定 通过分析两组间发生变化的内源性脂质差异物有助于推测疾病的发病机制,为临床上对疾病的预防和治疗奠定基础。本研究共筛选鉴定出28个潜在生物标志物,包括16个磷脂酰胆碱、7个磷脂酰乙醇胺、2个磷脂酰丝氨酸、1个磷脂酸、1个磷脂酰肌醇、1个鞘磷脂。

图2 正离子模式下模型组和正常对照组OPLS-DA二维得分图及S-plot载荷图Fig.2 Two-dimensional score map and S-plot load map of OPLS-DA in model group and normal control group in positive ion mode
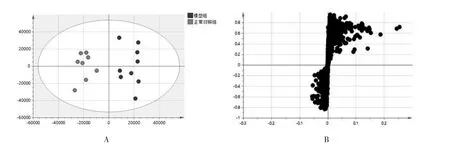
图3 负离子模式下模型组和正常对照组OPLS-DA二维得分图及S-plot载荷图Fig.3 Two-dimensional score map and S-plot load map of OPLS-DA in model group and normal control group in negtive ion mode
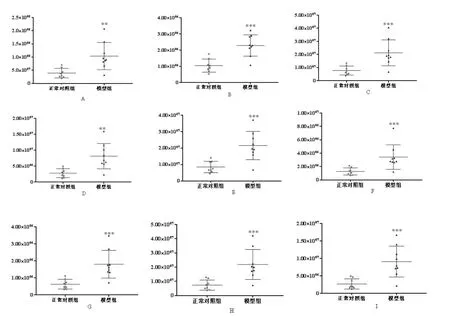
图4-1 模型组和正常对照组PC含量比较Fig.4-1 Comparison of PC content in model group and normal control group
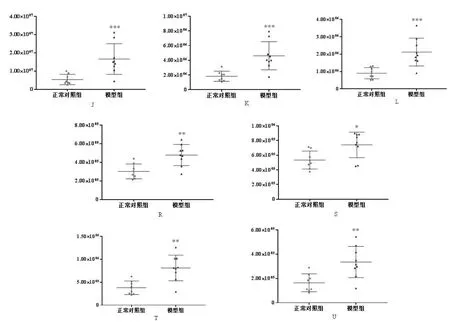
图4-2 模型组和正常对照组PC含量比较Fig.4-2 Comparison of PC content in model group and normal control group

图5-1 模型组和正常对照组其他脂类代谢差异物含量比较Fig.5-1 Comparison of other lipid metabolism discrepancy content in model group and normal control group
3 讨论
脂质代谢与炎症的关系早已引起广泛关注,二者密切相关,炎症可导致脂质代谢紊乱,脂质代谢失衡也可诱发炎症反应。鉴于脂质成分与疾病的关系,探索其与疾病相关的生物学功能将有望为疾病的治疗寻找到新的靶点[9-10]。有文献报道细胞炎症反应与脂质代谢之间的相互作用,脂质代谢紊乱会对引发炎症产生影响[11-12];曲枫[13]利用鞘脂组学分析技术,对乙肝及相关的慢性肝炎开展研究,结果表明,鞘脂代谢网络的紊乱与疾病的发展密切相关,发现并确认了9个鞘脂生物标志物,为慢性乙肝疾病发病机制研究提供线索;贾志鑫[14]运用所建立的皮肤角质层鞘脂组学分析方法,找到了表征患病儿童与健康对照儿童差异以及表征不同组别患儿病变处皮肤与自身健康对照皮肤之间差异的潜在生物标志物。
斑马鱼具有成年鱼个体小、易于饲养、发育快速、性成熟期短、繁殖力强、体外受精、胚胎透明且完善、易于观察、适合进行显微注射和细胞移植操作等特点[15],且基因与人类高度同源,免疫系统与人类极为相似。因此,斑马鱼可以复制多种疾病模型,从而用于药物活性、毒性的高通量筛选以及药物代谢等方面的研究[16]。本实验应用UPLC-QE-MS的脂质组学技术研究LPS诱导的炎症斑马鱼与正常斑马鱼的脂质代谢差异,通过多元统计分析,发现了部分潜在的生物标志物。结果显示,LPS诱导的内毒素炎症可能与PC、PE、SM等代谢密切相关,会引起该类脂代谢紊乱。
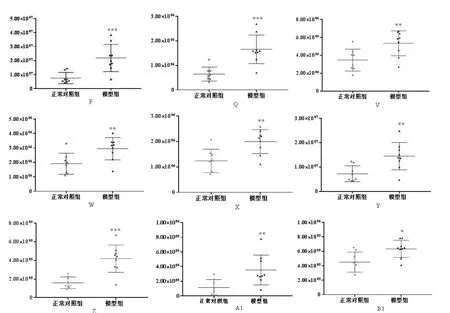
图5-2 模型组和正常对照组其他脂类代谢差异物含量比较Fig.5-2 Comparison of other lipid metabolism discrepancy content in model group and normal control group
PC是主要的外叶磷脂。在非神经元真核细胞中,胆碱主要用于合成PC。研究表明,LPS能够诱使原代骨髓巨噬细胞极化,导致胆碱摄取率和PC合成水平增加,表现出炎症状态[17]。本实验以LPS诱导炎症斑马鱼模型,模型组斑马鱼体内的PC水平显著升高,推测可能是由于胆碱的摄取增加导致PC的合成增加和炎症的发生。PE的含量在生物界所存在的磷脂中仅次于PC,二者可以相互转化。脂质过氧化产生多种脂质醛,最近研究表明PE是这些脂质醛的主要靶标,形成以醛修饰的PE(al-PE)作为炎症介质的新型家族[18],说明炎症的发生有可能与某些PE的升高有关,这与本实验中LPS诱导的炎症斑马鱼体内PE(16:0/22:2)、PE(20:5/18:0)、PE(22:4/19:0)升高结果一致。SM被称为“生物活性脂类”,是在炎症反应中合成的一类物质。SM可以通过SM合成酶从神经酰胺合成,也可以通过鞘磷脂酶水解生成神经酰胺。其在细胞内的含量会随着细胞外刺激的变化而改变,从而影响细胞生长、死亡,引发包括炎症反应在内的多个生物学过程[19]。本研究中,在LPS诱导的炎症斑马鱼模型中,SM水平显著升高,可能是由于鞘磷脂酶的水解产生神经酰胺,神经酰胺的蓄积进一步导致了炎症反应发生[20]。

表1 正负离子模式下模型组与正常对照组比较潜在生物标志物的鉴定结果Tab.1 Identification of potential biomarkers in model group compared with normal control group in positive and negative ion mode
本实验从脂质组学的角度阐明LPS诱导炎症斑马鱼模型体内脂质代谢特征,为进一步研究药物干预后斑马鱼体内脂质代谢变化提供依据,同时为LPS诱导的感染性疾病的早期诊断和预防奠定基础。
