从AMPK能量调节功能探讨红参上火机制
2018-10-29
浙江中医药大学 杭州 310053
上火是指因精神紧张、过度劳累、进食辛热药物和食物、气候变化等因素引起的、以头面部口、舌、牙龈、咽喉、鼻、眼等部位皮肤黏膜出现红肿热痛、溃疡为主,并可伴有全身症状的一种轻微且易反复的综合征。临床观察发现,不当进补红参汤或饮用红参酒后会发生上火[1],而红参引起上火的病理生理机制目前尚无系统的文献报道。课题组前期研究发现,上火的发生伴有能量代谢的紊乱。腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)是真核细胞生物中广泛存在的丝氨酸/苏氨酸蛋白激酶,被称为“细胞能量检测器”,能感知细胞能量代谢状态的改变[2]。研究发现,红参及其有效成分人参皂苷具有活化AMPK的作用,在代谢相关性疾病中发挥作用[3-4]。因此,本实验以AMPK能量调节功能为核心,通过检测红参上火模型大鼠的能量代谢变化,探索红参上火的相关机制。
1 材料和方法
1.1 实验动物 清洁级雌性Wistar大鼠40只,6周龄,体质量(160±20)g。购买于上海西普尔-必凯实验动物有限公司 [实验动物生产许可证号:SCXK(沪)2013-0016],饲养于浙江中医药大学动物实验中心[实验动物使用许可证号:SYXK(浙)2018-0012]。所有大鼠受试前笼养7d适应环境。全封闭清洁级状态下隔离饲养,室温20℃,相对湿度40%~60%,光照12h/d,自由摄食和饮水。
1.2 主要药物和试剂 正官庄牌高丽红参饮片450g(产地:韩国,批号:JY20150235),采购自浙江英特医药药材有限公司,并由该公司出具上海市食品药品检验所提供的检验报告书,检验结果符合进口药材质量标准及2015年中国药典标准。BCA蛋白浓度测定试剂盒购于上海碧云天生物技术有限公司(批号:P0012);抗AMPK抗体、抗增殖物受体γ共激活因子-1α(peroxisome proliferators-activated receptor-γ coactivator-1α,PGC-1α) 抗体、抗核呼吸因子 1(nuclear respiratory factor 1,NRF1)抗体购于英国Abcam公司(批号:ab32047、ab4481、ab175932);大鼠血清促甲状腺素(thyroid stimulating hormone,TSH)、17-羟皮质类固醇(17-hydroxycorticosteroid,17-OHCS)ELISA检测试剂盒购于上海源叶生物科技有限公司(批号:YY02114B、YY02077B);RNAiso Plus为日本 Takara公司产品(批号:9108);超微量Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶检测试剂盒、琥珀酸脱氢酶(succinate dehydrogenase,SDH)检测试剂盒购于南京建成生物工程研究所(批号:A016-2、A022)。
1.3 仪器 冷冻混合球磨仪购于弗尔德(上海)仪器设备有限公司;凝胶玻璃板、固定架、垂直电泳仪、转印系统、凝胶图像分析系统均为美国Bio-Rad公司产品;台式低温高速离心机、微量移液器购于德国Eppendorf公司;荧光定量PCR仪为瑞士罗氏公司产品;多功能酶标仪购于美国Thermo Fisher Scientific公司。
1.4 方法
1.4.1 红参水煎剂的制备 高丽红参饮片450g,加10倍单蒸水浸泡30min,加热煮沸,文火煎煮1.5h,趁热滤过。按同法再煎煮1次,合并2次滤液,用旋转蒸发器浓缩提取液。
1.4.2 上火动物模型制备 参照常用实验动物及人的体表面积比例乘以系数0.018,将红参临床剂量换算成大鼠的每日用量0.54g,根据大鼠每日灌胃2mL的用量计算出用药浓度。将大鼠随机分为4组,红参高剂量组(药物浓度0.54g·mL-1)、红参中剂量组(药物浓度0.27g·mL-1)、红参低剂量组(药物浓度0.135 g·mL-1)和正常对照组,每组各10只。红参高、中、低剂量组分别以相应剂量红参水煎剂2mL灌胃,1次/d,共15d,建立实热上火大鼠模型;正常对照组以0.9%氯化钠溶液2mL灌胃,1次/d,共15d。灌胃第14天所有大鼠上代谢笼,称量并计算出大鼠上代谢笼前以及下代谢笼后24h的饮食量、饮水量、粪便量及尿量。所有实验大鼠在末次灌胃2h后麻醉,开腹后腹主动脉取血,并完整剥离肝脏。
1.4.3 ELISA法检测TSH、17-OHCS的含量 用蒸馏水按1:20稀释20×洗涤缓冲液。以洗涤缓冲液洗板5次,从室温平衡20 min的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4℃;设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50μL;样本孔先加待测血浆样本10μL,再加样本稀释液40μL;空白孔不加。除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的检测抗体100μL,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60min。弃去液体,以洗涤液重复洗板5次。每孔加入底物A、B各50μL,37℃避光孵育15min。每孔加入终止液50μL,15min内于450nm波长处测定各孔的OD值。绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值。
1.4.4 Western blot检测 AMPK、PGC-1α、NRF1蛋白表达水平 提取肝脏组织蛋白,并用BCA试剂盒测定蛋白浓度。取20~40μg肝脏组织蛋白在SDS聚丙烯酰胺凝胶电泳,在冰水浴中转膜2h。转膜后将PVDF膜置于1%BSA的封闭液中,放于水平摇床上,室温封闭1.5h,4℃下一抗孵育过夜。回收一抗溶液,TBST洗膜3次,将膜放于1:10 000稀释的IRDy680或者IRDy880标记的二抗中,避光室温孵育2h。TBST洗膜3次,再将PVDF膜置于Bio-Rad凝胶成像仪中进行扫描,扫描后以Quantity One软件对图像进行光密度值分析。
1.4.5 Real-time PCR 检测 AMPK、PGC-1α、NRF1 mRNA表达水平 提取肝脏组织总RNA,用One Drop仪器测定总RNA浓度。将RNA逆转录成cDNA,逆转录条件为37℃ 15min(逆转录反应),85℃5s(逆转录酶失活反应),稳定到4℃。逆转录结束,-20℃保存。cDNA扩增反应条件如下:预变性95℃30s;PCR 反应 95℃ 5s,50℃ 30s,72℃ 45s,共 45 个循环;熔解曲线分析:95℃ 10s,65℃ 60s,97℃ 1s。所有引物都由上海生工生物工程公司合成,具体序列见表1。采用2-△△Ct方法计算mRNA相对表达量。

表1 引物序列Tab.1 primer sequence
1.4.6 比色法检测Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶、SDH活力
1.4.6.1 比色法检测Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力 称量大鼠肝脏组织50mg,按质量:体积(g:mL)=1:9的比例,在1.5mL离心管中加入0.9%氯化钠溶液450μL,放入冷冻混合离心仪中充分研磨。研磨充分后,2 500r/min离心10min,取上清液,制成10%上清液匀浆,再用0.9%氯化钠溶液稀释成1%。用BCA蛋白测定试剂盒测定蛋白浓度。配置基质液,定磷,充分混匀,室温静置5min,在636nm处,1cm光径,双蒸水调零,测定各管吸光度。计算公式如下:

1.4.6.2 比色法检测SDH活动 按照试剂一:试剂二:试剂三:试剂四:试剂五:试剂六=2:0.1:0.1:0.2:0.1:0.1的比例配置工作液,配好后避光保存,并37℃预温5 min以上。在96孔板中加入10μL待测大鼠血浆样本,快速加入260μL工作液。在酶标仪中5s读取一次吸光度(A1值),1分5s再次读取一次吸光度(A2值),求出2次吸光度差值(△A=A1-A2)。计算公式如下:
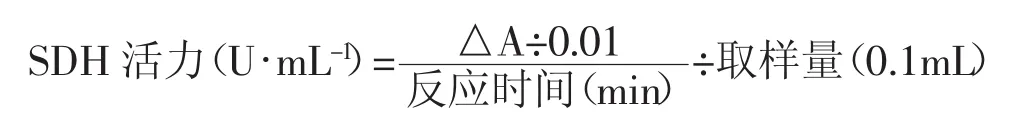
1.5 统计学分析 采用SPSS 18.0统计软件进行统计学分析。计量资料以±s表示,多组间比较满足方差齐性时采用方差分析,组间两两比较采用LSD-t法;多组间比较方差不齐时采用Kruskal-Wallis H检验。计数资料采用率或构成比表示,组间比较采用χ2检验。
2 结果
2.1 各组大鼠一般情况比较 造模15d后,红参高、中、低剂量组大鼠均出现不同程度毛发蓬松,烦躁多动的表现,体质量增长缓慢,肛温升高,饮食饮水量增多,大便偏干,小便黄赤、量多。正常对照组活动正常,体质量增长平稳,肛温无明显升高,饮食、饮水量无明显增多。
2.2 各组大鼠体质量比较 造模第1天,各组大鼠体质量差异无统计学意义(P>0.05)。造模后第15天,与正常对照组比较,红参各剂量组大鼠体质量增长缓慢,其中红参高、中剂量组大鼠体质量的差异有统计学意义(P<0.05);低剂量组体质量的差异无统计学意义(P>0.05)。见表 2。
表2 各组大鼠体质量比较(±s,g)Tab.2 Comparison of weight of each group(±s,g)

表2 各组大鼠体质量比较(±s,g)Tab.2 Comparison of weight of each group(±s,g)
注:与正常对照组相同时点比较,*P<0.05。Note:Compared with normal control group at the same time,*P<0.05.
?
2.3 各组大鼠肛温比较 造模第1天,各组大鼠肛温差异无统计学意义(P>0.05)。造模第15天,与正常对照组比较,红参高、中、低剂量组大鼠的肛温均升高,其中高剂量组的肛温差异有统计学意义(P<0.05);中、低剂量组的肛温差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠体温比较(±s,℃)Tab.3 Comparison of temperature of each group(±s,℃)
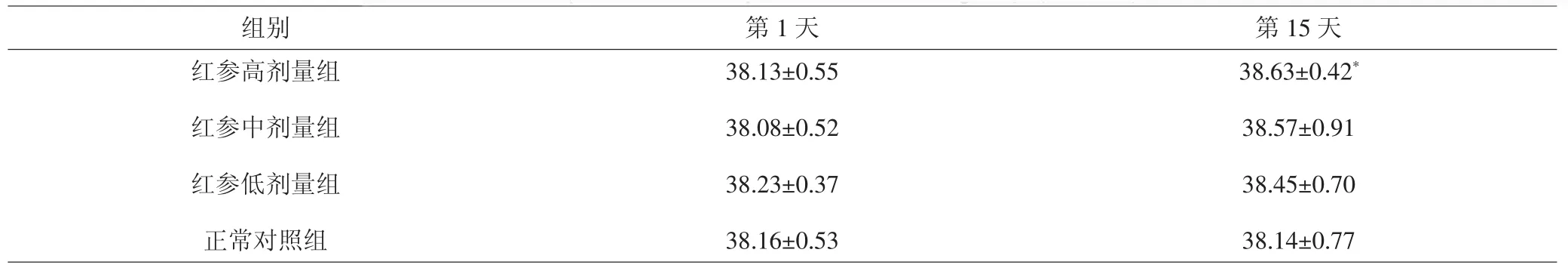
表3 各组大鼠体温比较(±s,℃)Tab.3 Comparison of temperature of each group(±s,℃)
注:与正常对照组相同时点比较,*P<0.05。Note:Compared with normal control group at the same time,*P<0.05.
组别 第1天 第15天红参高剂量组红参中剂量组红参低剂量组正常对照组38.13±0.55 38.08±0.52 38.23±0.37 38.16±0.53 38.63±0.42*38.57±0.91 38.45±0.70 38.14±0.77
2.4 各组大鼠进食、饮水、粪便、尿量比较 造模第15天,与正常对照组比较,红参高、中、低剂量组大鼠的进食、饮水量均有增加,差异有统计学意义(P<0.05)。红参高、中剂量组粪便量增多,低剂量组粪便量减少。其中中剂量组的粪便量增多,差异有统计学意义(P<0.05);高、低剂量组大鼠的粪便量差异无统计学意义(P>0.05)。红参高、中、低剂量组大鼠的尿量均增加。其中中剂量组的尿量增多,差异有统计学意义(P<0.05);高、低剂量组大鼠的尿量差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠进食、饮水、粪便、尿量比较(±s)Tab.4 Comparison of diet,drinking,feces and urine of each group(±s)
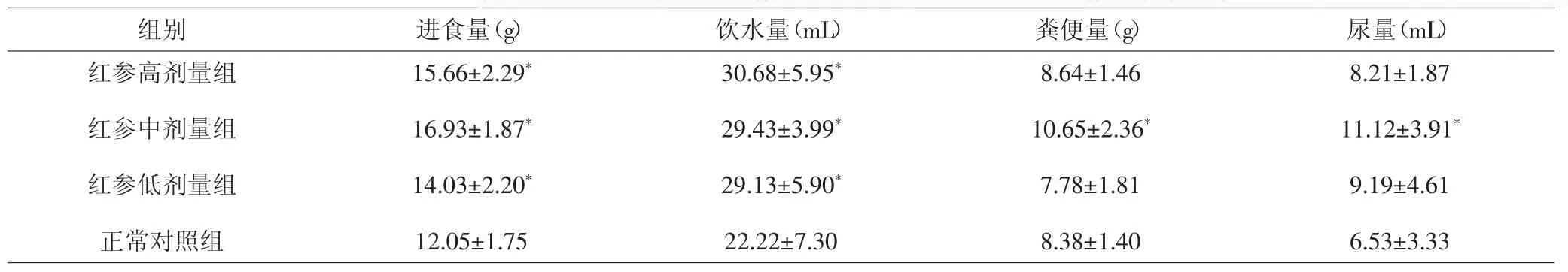
表4 各组大鼠进食、饮水、粪便、尿量比较(±s)Tab.4 Comparison of diet,drinking,feces and urine of each group(±s)
注:与正常对照组比较,*P<0.05。Note:Compared with normal control group,*P<0.05.
?
2.5 各组大鼠TSH、17-OHCS表达比较 造模第15天,与正常对照组比较,红参高、中、低剂量组大鼠TSH以及17-OHCS含量均显著升高,差异均有统计学意义(P<0.001)。见表 5。
表5 各组大鼠TSH、17-OHCS表达比较(±s)Tab.5 Comparison of TSH,17-OHCS of each group(±s)

表5 各组大鼠TSH、17-OHCS表达比较(±s)Tab.5 Comparison of TSH,17-OHCS of each group(±s)
注:与正常对照组比较,***P<0.001。Note:Compared with normal control group,***P<0.001.
组别 TSH(mU·L-1) 17-OHCS(μmol·L-1)红参高剂量组红参中剂量组红参低剂量组正常对照组12.92±0.94***11.03±0.91***9.39±0.93***7.16±1.12 40.33±1.11***34.18±2.86***29.26±2.79***22.27±3.54
2.6 各组大鼠AMPK及下游PGC-1α、NRF1的表达比较
2.6.1 各组大鼠AMPK、PGC-1α、NRF1蛋白表达比较 造模第15天,与正常对照组比较,红参高、中、低剂量组AMPK、NRF1的蛋白表达上调,差异有统计学意义(P<0.05)。低剂量组PGC-1α蛋白表达上调,但差异无统计学意义(P>0.05)。红参高、中剂量组PGC-1α蛋白表达均上调,差异有统计学意义(P<0.05)。见图 1。
2.6.2 各组大鼠AMPK、PGC-1α、NRF1 mRNA表达比较 与正常对照组比较,红参高、低剂量组的AMPK、PGC-1α、NRF1 mRNA 表达量均上调,差异均有统计学意义(P<0.05);中剂量组的 AMPK、PGC-1α、NRF1 mRNA表达量亦上调,但差异无统计学意义(P>0.05)。见图 2。

图1 各组大鼠的AMPK、PGC-1α、NRF1蛋白比较Fig.1 Comparison of protein expression of AMPK,PGC-1α,NRF1 of each group
2.7 各组大鼠SDH、Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力比较 造模第15天,与正常对照组比较,红参各剂量组大鼠SDH、Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力均升高。其中红参高、中剂量组SDH活力高于正常对照组,差异有统计学意义(P<0.05),低剂量组差异无统计学意义(P>0.05)。红参高、中剂量组Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力高于正常对照组,差异有统计学意义(P<0.01,P<0.001),低剂量组差异无统计学意义(P>0.05)。见表6。
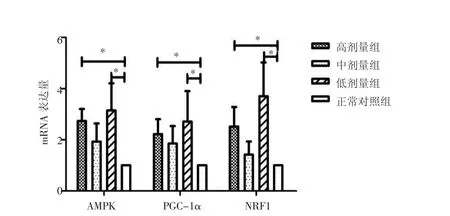
图2 各组大鼠AMPK、PGC-1α、NRF1 mRNA表达比较Fig.2 Comparison of mRNA of AMPK,PGC-1α,NRF1 of each group
表6 各组大鼠SDH、Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力比较(±s)Tab.6 Comparison of activity of SDH,Na+-K+-ATP enzyme,Ca2+-Mg2+-ATP enzyme of each group(±s)

表6 各组大鼠SDH、Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力比较(±s)Tab.6 Comparison of activity of SDH,Na+-K+-ATP enzyme,Ca2+-Mg2+-ATP enzyme of each group(±s)
注:与正常对照组比较,*P<0.05,**P<0.01,***P<0.001。Note:Compared with normal control group,*P<0.05,**P<0.01,***P<0.001.
2.64±0.18***2.44±0.30***2.01±0.25 1.83±0.14组别 SDH(U·mL-1) Na+-K+-ATP 酶(U·mgprot-1) Ca2+-Mg2+-ATP 酶(U·mgprot-1)红参高剂量组红参中剂量组红参低剂量组正常对照组49.30±3.77*51.54±2.96*48.53±3.41 44.57±3.70 3.04±0.27***2.69±0.29**2.51±0.28 2.23±0.12
3 讨论
红参是五加科植物人参的栽培品经蒸制后的干燥根及根茎,其味甘,微苦,性温,香味浓厚。归脾、肺、心、肾经,具有大补元气、复脉固脱、益气摄血的功效[5]。高丽红参是指朝鲜半岛出产的人参,完全成熟的高丽红参通常选用生长了6年的人参炮制而成,是稀有的珍品。因此,高丽红参是老百姓热衷的补品之一。《素问·阴阳应象大论》曰:“气厚者为阳,薄为阳之阴……气薄则发泄,厚则发热。”红参性温,当属气厚者,气厚者有助阳发热的作用。过服或久服会影响阴阳偏颇,造成人体阳气的病理性亢盛,出现一派实热上火的症状。因此,红参的温性与上火的发生密切相关。现代研究运用微量量热法测定红参的生物热效应,证实其性偏热。温热药作用于机体一般表现为功能的亢奋,机体功能亢奋则需要消耗较多的能量,就会产生较多的热量[6],故推断其引起的热量蓄积可能是造成上火的机制之一。
目前尚无关于上火动物模型的文献报道。从中医八纲辨证而言,实热上火属于实热证的范畴。因此,本实验借鉴了实热证的造模方法,用高丽红参煎液灌胃大鼠15d,建立实热上火的动物模型。大鼠出现体重增长缓慢,肛温升高明显,进食、饮水量均增加,大便偏干,小便黄赤、量多等表现,与中医上火的临床表现相近。
血中TSH是由腺垂体分泌的一种糖蛋白,是直接调节甲状腺功能的关键激素[7]385,396。TSH是反映下丘脑-垂体-甲状腺轴功能的敏感指标,甲状腺功能改变时,TSH的波动较T3、T4更迅速而显著[8]45。因此,TSH可反映下丘脑-垂体-甲状腺轴的功能。17-OHCS主要是指肾上腺皮质分泌的皮质醇、皮质素和它们的代谢产物,由肾脏排出,所以测定血中17-OHCS可以反映交感神经-肾上腺皮质功能[7]408。当肾上腺皮质功能亢进时,外周17-OHCS的排出量增加。文献报道,温热药有提高交感神经-肾上腺系统活性的作用,包括下丘脑-垂体-肾上腺皮质、下丘脑-垂体-甲状腺等[8]43。本实验用ELISA法检测红参上火大鼠模型的血清TSH、17-OHCS后发现,各组别TSH、17-OHCS含量相比正常对照组均明显升高。该结果体现了红参的温热性质,也说明了红参上火模型存在交感神经-肾上腺功能的增强。结合大鼠精神烦躁多动、体重增长缓慢、肛温升高、饮食饮水量增多、大便偏干、小便黄赤等体征,提示实热上火动物模型的建立。此外,大鼠肛温、体质量、饮食、饮水量等实热上火表现以及TSH、17-OHCS的表达量升高与红参给药量呈正相关关系,说明了过量进补红参,会引起上火。
课题组前期研究发现,上火存在能量代谢的紊乱。AMPK能感知细胞能量代谢状态的改变,活化的AMPK可以增强分解代谢,抑制合成代谢,参与细胞糖、脂肪、蛋白质代谢等能量代谢过程,增加细胞能量储备,应对能量缺乏。活化的AMPK可以通过调节过下游PGC-1α和NRF1提高线粒体能量代谢[9-11]。PGC-1α是一个转录共激活因子,具有线粒体生物合成、肌纤维类型的转化、葡萄糖代谢、脂肪酸氧化等功能[12]。它与能量代谢关系密切,且具有组织表达的特异性,主要在能量需求较高、线粒体丰富的组织中表达[13-14]。活化的AMPK通过直接作用于下游PGC-1α的Ser538和Thr177残基,促进其转录,进而促进线粒体基因表达和线粒体生成[15]。PGC-1α能激活NRFs形成复合物,有效增强线粒体DNA的复制与转录过程,调节线粒体生物合成。研究发现,红参及人参皂苷均有活化AMPK的作用,在代谢相关性疾病的调控中发挥重要的作用[3-4,16]。本实验发现,与正常对照组比较,高、中剂量组大鼠 AMPK、PGC-1α、NRF1 的蛋白表达均上调。高、低剂量组大鼠AMPK、PGC-1α、NRF1 mRNA表达均上调。因此,笔者认为红参上火模型大鼠存在AMPK功能活化,活化的AMPK作用于下游PGC-1α及NRF1等因子,促进线粒体生物合成和ATP的产生,增强机体的能量代谢。提示了红参引起的上火存在能量代谢的增强,其机制可能与红参活化AMPK有关。
SDH是葡萄糖糖代谢三羧酸循环途径中一种重要的酶,也是线粒体内膜氧化呼吸链复合体的组成酶之一[17],具有催化琥珀酸脱氢生成延胡索酸的作用[18-19]。它的活力反映了三羧酸循环、组织氧化代谢水平及机体的能量生成情况[20]。研究发现,AMPK能调节SDH的活力[21-22]。实验发现,实热上火模型SDH活力升高,说明了三羧酸循环的加快以及线粒体中ATP合成增加,提示了能量代谢处于旺盛的状态,其机制可能与AMPK活化后上调SDH活力有关。
Na+-K+-ATP酶又称为钠-钾泵,简称钠泵。它对维持细胞的正常生理功能起着极其重要的作用,可将细胞内的ATP水解为二磷酸腺苷(adenosine diphos-phate,ADP),并利用高能磷酸键贮存的能量完成Na+、K+的跨膜转运[7]15。与ATP的分解和利用有关,故Na+-K+-ATP酶活力是反映机体能量代谢水平和生理功能状态的重要指标[23]。Ca2+-Mg2+-ATP酶又称为钙泵,机制与钠泵相似[7]16。二者是衡量线粒体功能和能量代谢水平的重要指标[23]。研究发现,AMPK对钠泵、钙泵具有促进作用[24-25]。因此,本实验进一步检测了Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶含量的变化来反映能量代谢的变化。本研究发现,红参高、中剂量组Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶含量均高于正常对照组,且差异具有统计学意义。说明了线粒体中ATP分解代谢增强,提示了机体能量代谢处于旺盛的状态,其机制可能与AMPK上调了钠泵、钙泵活力有关。
综上所述,红参引起的实热上火大鼠模型存在能量代谢增强,其机制与红参引起AMPK活化,进一步导致其下游能量代谢相关因子PGC-1α、NRF1表达上调,能量代谢相关的琥珀酸脱氢酶、钠泵、钙泵活力升高有关。该结果提示了上火与能量代谢增强的相关性,但其与葡萄糖代谢、脂肪酸代谢等能量代谢过程的具体关联还有待进一步研究。
