FOLFIRI联合艾迪注射液治疗晚期结直肠癌的疗效及对免疫功能的影响
2018-10-26李小妹顾艳杨柳
李小妹,顾艳,杨柳
淮南市东方医院集团总医院肿瘤内科,安徽 淮南 232001
结直肠癌的生物学行为较为理想,结直肠与腹腔内的重要器官无密切接触,这为整体切除结直肠提供了良好的条件。行结直肠癌根治术后,患者的术后并发症相对较少[1]。近年来,结直肠癌切除手术的成功率明显增加,手术失败率明显下降,甚至对于伴有血行转移的晚期结肠癌患者,与原发癌病灶同期切除,患者可以获得显著的疗效,充分说明了根治性切除手术的可行性。然而,部分行根治性治疗的晚期结直肠癌患者的疗效不佳,仍有待提高,而且中国行结直肠癌根治术主要采用开腹手术,患者的术后生存率仍较低,治疗失败的主要原因是开腹手术后患者的应激反应较重,血清相关因子水平升高[2]。为了提高晚期结直肠癌患者根治性治疗疗效,本研究采用伊立替康+5-氟尿嘧啶+亚叶酸钙(FOLFIRI)联合艾迪注射液治疗晚期结直肠癌,取得了明显的治疗效果,调节了患者的免疫防御系统,提高了患者的生活质量,延长了患者的生命,现报道如下。
1 对象与方法
1.1 研究对象
选取2014年2月至2017年2月淮南市东方医院集团总医院收治的60例晚期结直肠癌患者作为研究对象。纳入标准:①所有患者均经病理学确诊;②均为无法手术切除、仅行姑息手术转移的晚期患者;③卡氏功能状态评分(Karnofsky performance score,KPS)≥60分;④4周内未接受过任何抗肿瘤治疗。排除标准:①入院时肝肾功能、心电图、电解质和血常规异常者;②合并自身免疫缺陷性疾病、血液疾病及精神疾病者;③对本研究药物过敏者。采用随机数字表法将患者分为对照组(n=30)和观察组(n=30)。对照组中,男19例,女11例;年龄为40~69岁,平均年龄为(58.98±11.54)岁;结肠癌23例,直肠癌7例;腺癌24例(高分化腺癌6例,中分化腺癌13例,低分化腺癌5例),黏液腺癌3例,印戒细胞癌3例;肝脏转移18例,肺转移5例,淋巴结转移3例,软组织转移2例,腹膜转移1例,附件转移0例,骨转移1例。观察组中,男17例,女13例;年龄为40~69岁,平均年龄为(59.02±11.62)岁;结肠癌20例,直肠癌10例;腺癌24例(高分化腺癌4例,中分化腺癌14例,低分化腺癌6例),黏液腺癌4例,印戒细胞癌2例;肝脏转移15例,肺转移8例,淋巴结转移2例,软组织转移2例,腹膜转移2例,附件转移1例,骨转移0例。两组患者的年龄、病理类型、转移情况等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。患者及家属均对本研究知情同意,并获得医院医学伦理委员会的批准通过。
1.2 方法
1.2.1 治疗方法 两组患者入院后均立即完善相关检查,并根据需要予以卧床休息、吸氧、镇静、监护病房(intensive care unit,ICU)监护等常规治疗。在常规治疗的基础上,对照组患者采用FOLFIRI方案(每两周重复1次)进行化疗,观察组患者在FOLFIRI化疗方案基础上联合艾迪注射液进行治疗,给予患者400~450 ml的0.9%氯化钠注射液+艾迪注射液静脉滴注,每日1次,30天为1个疗程,连续治疗3个疗程。
1.2.2 检测方法 分别于治疗前后抽取患者的清晨空腹静脉血4 ml,离心速度为30 000 r/min,离心30 min;分离血清,置于-80℃冰箱保存待测。采用聚合酶链式反应(polymerase chain reaction,PCR)技术检测血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、癌胚抗原(carcinoembryonic antigen,CEA)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;采用流式细胞仪检测外周血T淋巴细胞亚群(CD3+、CD4+、CD4+/CD8+)水平。
1.3 评价指标
观察并比较两组患者治疗前后的临床疗效、免疫相关指标水平、血清肿瘤标志物水平和生活质量评分情况。参照2000年实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)[3]对患者的临床疗效进行评价。完全缓解(CR):基线病灶完全消失,无新病灶出现,维持≥4周;部分缓解(PR):基线病灶最长径之和缩小≥30%,维持≥4周;疾病稳定(SD):基线病灶最长径之和缩小<30%或增大<20%;疾病进展(PD):基线病灶最长径之和增大≥20%,或有新病灶出现。疾病控制率=(CR+PR+SD)例数/总例数×100%。依据万崇华等[4]制定的癌症患者生命质量测定量表对两组患者的生活质量进行评估,评价内容包括躯体功能、心理功能、症状/不良反应、社会功能4个领域,总生活质量为4个领域评分之和,共22个条目;分值越高,表示患者的功能状态越好,生活质量越高。
1.4 统计学方法
采用SPSS 19.0软件对-数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验或配对t检验;计数资料以率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
治疗后,观察组患者的疾病控制率为80.0%(24/30),对照组患者的疾病控制率为76.7%(23/30),两组患者的疾病控制率比较,差异无统计学意义(χ2=0.098,P=0.754)。(表1)

表1 两组患者的临床疗效[n(%)]
2.2 免疫指标的比较
治疗后,两组患者的CD3+和CD4+水平均较本组治疗前有所升高(P<0.05);观察组患者的CD4+/CD8+水平高于本组治疗前,差异有统计学意义(P<0.05),但对照组患者的CD4+/CD8+水平与本组治疗前比较,差异无统计学意义(P>0.05)。治疗前,两组患者的CD3+、CD4+、CD4+/CD8+水平比较,差异均无统计学意义(P>0.05);治疗后,观察组患者的CD3+、CD4+、CD4+/CD8+水平均高于对照组患者,差异均有统计学意义(P<0.05)。(表2)
2.3 血清VEGF、CEA及TNF-α水平的比较
治疗前,两组患者血清中VEGF、CEA和TNF-α水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者血清中VEGF、CEA和TNF-α水平均较本组治疗前有所下降(P<0.05)。治疗后,观察组患者血清中VEGF、CEA及TNF-α水平均明显低于对照组患者,差异均有统计学意义(P<0.01)。(表3)
2.4 生活质量的比较
治疗前,两组患者的各项生活质量评分比较,差异均无统计学意义(P>0.05)。治疗后,对照组患者躯体功能、心理功能、症状/不良反应、社会功能和总生活质量的评分与本组治疗前比较,差异均无统计学意义(P>0.05)。治疗后,观察组患者的躯体功能、症状/不良反应评分均高于本组治疗前,差异均有统计学意义(P<0.05),但心理功能、社会功能和总生活质量评分与本组治疗前比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的各项生活质量评分比较,差异均无统计学意义(P>0.05)。(表4)
表2 两组患者治疗前后免疫指标的比较(±s)

表2 两组患者治疗前后免疫指标的比较(±s)
注:*与本组治疗前比较,P<0.05
组别对照组(n=30)观察组(n=30)t值P值CD3+(%)治疗前60.15±3.89 60.21±3.85 0.060 0.952治疗后61.81±3.74*64.55±3.87*2.789 0.007 CD4+(%)治疗前31.15±2.61 31.17±2.58 0.030 0.976治疗后32.64±2.77*35.71±2.84*4.239 0.000 CD4+/CD8+治疗前1.33±0.25 1.35±0.23 0.322 0.748治疗后1.38±0.20 1.48±0.16*2.138 0.037
表3 两组患者治疗前后VEGF、CEA、TNF-α水平的比较(±s)
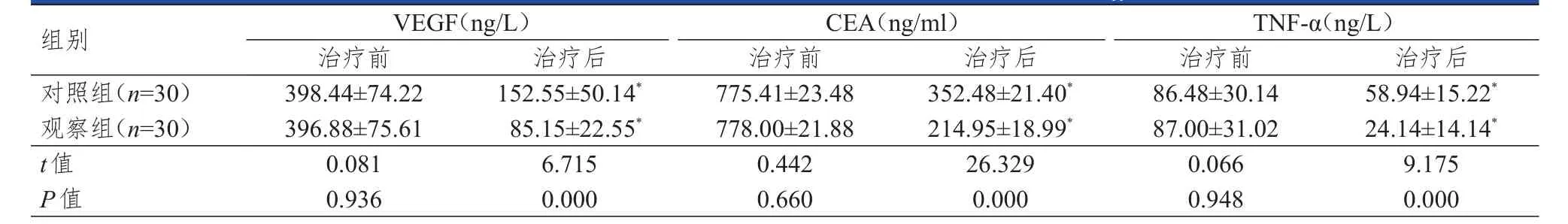
表3 两组患者治疗前后VEGF、CEA、TNF-α水平的比较(±s)
注:*与本组治疗前比较,P<0.05
组别对照组(n=30)观察组(n=30)t值P值VEGF(ng/L)治疗前398.44±74.22 396.88±75.61 0.081 0.936治疗后152.55±50.14*85.15±22.55*6.715 0.000 CEA(ng/ml)治疗前775.41±23.48 778.00±21.88 0.442 0.660治疗后352.48±21.40*214.95±18.99*26.329 0.000 TNF-α(ng/L)治疗前86.48±30.14 87.00±31.02 0.066 0.948治疗后58.94±15.22*24.14±14.14*9.175 0.000
表4 两组患者治疗前后生活质量评分的比较(±s)

表4 两组患者治疗前后生活质量评分的比较(±s)
注:*与本组治疗前比较,P<0.05
观察组(n=30)35.7±5.338.4±5.7*36.8±6.237.4±6.333.5±7.237.2±6.9*社会功能治疗前29.5±8.1 29.5±8.1治疗后30.0±8.2 30.0±8.0总生活质量治疗前136.6±25.0 136.6±26.1治疗后134.6±25.1 138.5±26.6
3 讨论
目前,临床上手术切除仍为治疗结直肠癌的主要方法,但约30%的术后患者,其复发转移率仍可达50%,超过50%的患者死于侵袭转移,术后复发和转移是治疗失败的主要原因[5]。简单的辅助放化疗联合开腹手术等治疗方法并不能够有效降低结直肠癌复发的风险。另外,肿瘤免疫逃逸是抗肿瘤治疗失败的另一个重要原因,是与免疫环境变化而引起的细胞因子水平变化相关的免疫逃逸,肿瘤细胞可在某些情况下通过多种机制逃避机体免疫系统的免疫监视,使人体的免疫系统受到抑制,因此,增强患者的免疫功能是治疗的关键[6]。
经手术治疗后的结直肠癌患者采用FOLFIRI方案治疗能够获得一定的化疗效果,但是存在较多不良反应,如恶心、呕吐、腹泻、骨髓抑制等,部分患者的不良反应较严重,难以将治疗顺利地进行下去,且可对患者的免疫功能造成不良影响。本研究观察组患者在采用FOLFIRI化疗方案的基础上联合艾迪注射液治疗,对肿瘤有较强的抑制作用。艾迪注射液的主要成分是中草药,其主要药理作用:①对结直肠癌细胞的增殖具有明显的抑制作用;②在对患者进行放化疗后,能够维持白细胞和血小板等血液中重要细胞的正常活性[7];③艾迪注射液能够增强机体免疫系统反应,提高机体的免疫应激能力。本研究结果显示,治疗后,两组患者的近期临床疗效均较好,说明FOLFIRI方案和FOLFIRI方案联合艾迪注射液治疗均能够在短期内抑制结直肠癌的进展。
淋巴细胞是人体免疫系统中最重要的免疫细胞,而T淋巴细胞是淋巴细胞中数量最多、功能最复杂的一类细胞,其中,CD4+、CD3+T淋巴细胞所占比例较多,与体内正常细胞群维持互动的联系,保护正常细胞免受攻击,以维持人体正常的免疫功能[8-9]。当结直肠癌细胞攻击人体时,机体发生免疫逃逸,随着病情的发展,CD4+T淋巴细胞数量降低,CD8+T淋巴细胞数量升高,两者的比值较正常下降,打破了机体的免疫平衡[10]。因此,CD4+、CD3+T淋巴细胞数量的减少被认为是引起免疫逃逸而导致结直肠癌发生的重要因素[11]。本研究中还发现,治疗后,观察组患者的CD3+、CD4+、CD4+/CD8+水平均高于对照组患者,差异均有统计学意义(P<0.05),说明采用FOLFIRI方案联合艾迪注射液治疗结直肠癌患者时,能够对患者的免疫防御系统起到较好的恢复作用,增强患者自身的免疫功能,及时识别和清除肿瘤细胞,增强抑制肿瘤细胞增殖的能力。
血清中TNF-α的水平主要通过参与炎性反应和诱导结直肠癌患者病变相关基因的表达,来促进环氧化酶2、磷脂酶A2、NO合酶、干扰素γ和黏附蛋白等效应蛋白的表达,是一种血管抑制因子,在发生结直肠癌时,在免疫调节及炎性反应进程中扮演着重要的角色[12],与结直肠癌引起的应激性急性炎性反应程度有关。VEGF是血管通透因子,是结直肠癌发生、发展过程中重要的调控因子[13]。VEGF能够特异性作用于结直肠内膜细胞的糖基化细胞分裂素,在增强结直肠内膜血管的渗透性、促进肿瘤细胞加速分化增殖等方面发挥作用[14]。CEA是存在于恶性肿瘤细胞中的物质,在结直肠癌患者的血清中表达水平较高,可作为检测肿瘤的标志物[15-16]。本研究显示,治疗后,观察组患者血清中VEGF、CEA及TNF-α水平均明显低于对照组患者(P<0.01),说明采用FOLFIRI方案联合艾迪注射液治疗结直肠癌患者,能够明显抑制肿瘤细胞的分化、增殖,从而减少血清中肿瘤标志物水平。治疗后,观察组患者的CD3+、CD4+、CD4+/CD8+水平均高于对照组患者(P<0.05),说明患者的耐受性较好,治疗过程可顺利进行。综上所述,本研究的创新之处在于,采用联合用药方案治疗结直肠癌患者较单纯采用FOLFIRI方案能够明显降低患者的血清肿瘤标志物水平,增强机体的免疫功能,及时识别并清除非正常细胞,用药安全性较高。FOLFIRI联合艾迪注射液方案治疗晚期结直肠癌可降低患者的血清VEGF、CEA及TNF-α水平,调节患者的免疫功能,提高患者的生活质量。
