应用微滴式数字聚合酶链式反应定量检测牛肉制品中的猪源性成分
2018-10-25刘立兵石蕊寒项佳林孙晓霞王金凤王素华郭春海王建昌
刘立兵,石蕊寒,项佳林,孙晓霞,付 琦,王金凤,周 巍,王素华,郭春海,王建昌,*
(1.石家庄海关,河北 石家庄 050051;2.河北省检验检疫科学技术研究院,河北 石家庄 050051;3.河北省食品检验研究院,河北 石家庄 050200;4.温州海关,浙江 温州 325000)
肉及肉制品掺假事件已是屡见不鲜,也是国内外关注的食品安全热点问题之一。肉类掺假严重干扰肉类的市场流通,侵害消费者权益、健康甚至宗教信仰[1-3]。欧盟定量成分声明(Quantitative Ingredient Declaration,QUID)、美国食品药品监督管理局(Food and Drug Administration,FDA)以及我国食品安全法中关于肉制品成分标识相关内容均有明确规定[4-6],然而在巨大经济利益的驱使下,不少不法分子仍然铤而走险,制假售假[7]。
目前,关于肉源性成分的检验方法包括近红外光谱检测法、色谱分析法、酶联免疫分析法和聚合酶链式反应(polymerase chain reaction,PCR)检测方法,其中PCR检测法由于具有操作简便快捷、准确度高、技术成熟且成本相对低廉等优点在国内外得到了广泛应用[6,8-9]。肉源性成分PCR检测法主要分为长度多态性DNA分析(PCR-restriction fragment length polymorphism,PCRRFLP)、随机扩增多态性DNA分析(PCR-random amplified polymorphic DNA,PCR-RAPD)、DNA测序及实时荧光PCR等[10-12]。我国已将实时荧光PCR检测法作为肉源性成分鉴定的标准方法,关于牛、羊、猪、兔、马、驴、鹿等动物肉类检测的国家标准相继出台,出入境检验检疫系统也出台了一系列关于禽类、畜类以及鱼类动物的PCR行业检测标准,但是相关标准中的方法均是对于DNA的定性检测[13-14]。
实时荧光PCR技术可以实现对于掺假肉成分的定量分析,但需要建立标准曲线,根据样本扩增的循环阈(cyclic threshold,Ct)值粗略计算DNA含量,操作程序较为复杂,并且实时检测采集荧光信号在很大程度上会受到PCR扩增效率的影响,从而导致检测值与真实值存在较大差别,因此在检测灵敏度和准确度方面均有所欠缺。相对于实时荧光PCR,近年来兴起的微滴式数字PCR(droplet digital PCR,ddPCR)方法通过将PCR体系微滴化,对于每一个微滴进行有无荧光信号的终点检测,受PCR扩增效率影响较小[15]。此外,ddPCR不需要建立标准曲线,根据泊松分布能够精确得出目的基因的起始拷贝数,实现DNA的绝对定量分析。ddPCR被应用于微生物[16]、转基因[17]、物种鉴定[18]和医学[19]等各个领域,在肉类掺假检测中也被广泛应用。王珊[20]、Ren Junan[21]等的研究表明,在肉种成分真伪鉴定上,ddPCR相较于实时荧光PCR更加科学、准确。目前,应用ddPCR对肉源性成分进行定量检测主要有2 种方法,一种是建立标准曲线法,另一种是确定固定比值法。蔡一村[14]、苗丽[22-23]等采用建立标准曲线法,通过进行肉制品质量与核酸含量以及核酸含量与基因拷贝数两步转换,将样本基因拷贝数换算为肉制品质量,有良好的准确性。任君安等[24]通过计算单位质量羊肉和猪肉中RPA1基因拷贝数之比这一固定值,无需两步转换即可通过样本基因拷贝数之比计算相对质量占比,操作简化、快捷,并且具有更好的定量准确性。面对如今越来越多的对于掺假肉或肉制品中各种肉类真实含量的检测需求,ddPCR的实际应用价值备受关注。
相对于猪肉,牛肉的蛋白质含量较高,脂肪含量较低,其氨基酸组成相较于其他常见食用肉类更接近人体需求,由于市场供需的影响,其价格也远高于鸡肉、鸭肉、猪肉及其他畜禽肉,因此牛肉中掺杂鸡肉[25]、鸭肉[26]、猪肉[27-28]及其他畜禽肉[29]的现象尤为常见。本研究参照GB/T 25165—2010《明胶中牛、羊、猪源性成分的定性检测方法 实时荧光PCR法》[30]合成猪单拷贝核基因PRNP以及牛单拷贝核基因GH引物探针,通过ddPCR方法检测单位质量2 种肉样的基因拷贝数,并验证二者比值为一固定值,通过该固定比值来确定2 种肉样的掺杂质量之比,实现牛肉中掺杂猪肉成分的准确定量检测,为相关部门的监测管理提供技术支持。
1 材料与方法
1.1 材料与试剂
牛肉、猪肉、山羊肉、绵羊肉、鸡肉、鸭肉、鹅肉、马肉、兔肉及狗肉样品均保存于实验室,牛肉肠、牛肉卷、牛肉干和牛肉粒样品均购于超市。
DNA提取试剂盒(Wizard Magnetic DNA Purification System for Food) 美国Promega公司;引物和探针生工生物工程(上海)股份有限公司;扩增预混液(ddPCRTMSupermix for Probes(no dUTP))、微滴生成油、微滴生成卡、胶盖及热封膜 美国Bio-Rad公司;96 孔PCR反应板 德国Eppendorf公司。
1.2 仪器与设备
MM400混合型球磨仪 德国莱驰公司;NanoDrop 2000C超微量分光光度计 美国Thermo Scientif i c公司;T-Gradient梯度PCR仪 德国Biometra公司;Bio-Rad QX200 ddPCR微滴生成仪、Droplet Reader和PX1热封仪美国Bio-Rad公司;SQ2119N料理机 慈溪市西贝乐电器有限公司。
1.3 方法
1.3.1 样品处理
将肉样于料理机中制成肉泥,在65 ℃烘箱中放置16 h烘干,然后置于球磨仪中研磨成粉末,过60 目筛后于4 ℃密封保存,操作过程避免污染。
以精确度为0.1 mg的电子天平称量猪肉粉和牛肉粉样本,制备猪肉质量分数分别为1%、5%、10%、20%、40%、50%、60%、80%、90%、95%和99%的混合肉样,每份样本总质量为50 mg。另分别称取50 mg牛肉、猪肉、山羊肉、绵羊肉、鸡肉、鸭肉、鹅肉、马肉、兔肉、狗肉粉末样品以及市售牛肉卷、牛肉干、牛肉肠和牛肉粒粉末样品。
1.3.2 DNA提取和浓度测定
参照Wizard Magnetic DNA Purification System for Food试剂盒操作说明,进行肉粉样品的DNA提取,提取的DNA样本用超微量分光光度计测定DNA质量浓度,将各个样品稀释至DNA质量浓度10~100 ng/µL,备用。
1.3.3 引物及探针合成
参照GB/T 25165—2010[30],合成针对猪PRNP基因及牛GH基因的特异性引物和探针。引物及探针序列如表1所示。
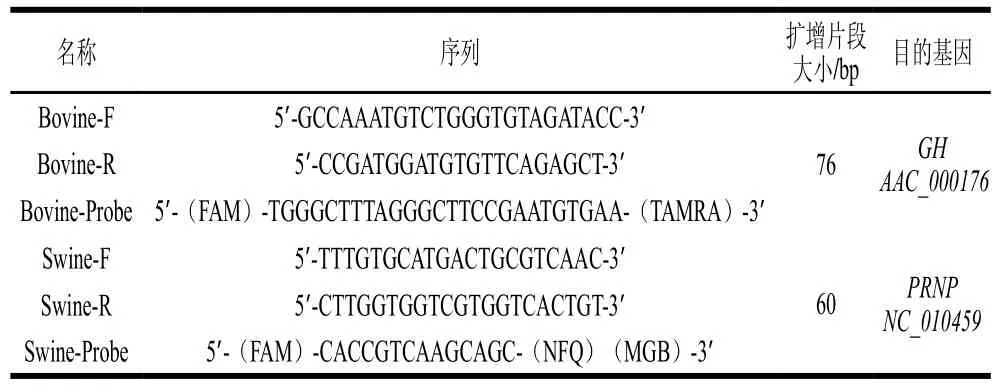
表 1 猪PRNP及牛GH基因PCR检测用引物和探针Table 1 Primer and probe sequences targeting swine PRNP and bovine GH genes
1.3.4 ddPCR检测体系的建立
ddPCR反应体系如表2所示。20 µL反应体系充分混匀后短暂离心,加入到DG8 Cartridge的8 个样品孔内;在每个油孔中加入70 µL微滴生成油,然后盖上胶垫置于微滴生成仪中生成油包水微滴;将生成的微滴全部转移至96 孔PCR反应板中,封膜后进行扩增,反应条件为:95 ℃、 8 min,94 ℃、30 s,60 ℃、1 min,40 个循环;98 ℃、10 min;4 ℃保存,最后通过微滴读取仪进行读数。

表 2 ddPCR扩增体系Table 2 Amplif i cation system for ddPCR
1.3.5 引物、探针特异性及灵敏性检测
采用ddPCR方法,分别用牛GH基因和猪PRNP基因引物探针对牛肉、猪肉、山羊肉等10 种常见食用肉类的DNA进行扩增,检测2 种引物探针的特异性。
将提取的猪和牛的DNA做2 倍或10 倍梯度稀释,使其质量浓度在50~0.625 ng/µL范围内,通过ddPCR方法分别对各质量浓度牛源和猪源DNA样本中牛GH基因和猪PRNP基因的拷贝数进行检测,确定2 种引物探针的检测灵敏性。
1.3.6 Kp/Kb的计算
牛G H基因及猪P R N P基因均为单拷贝核基因,因此,理论上单位质量猪肉PRNP基因拷贝数(Kp,Kp=,Qp为猪PRNP基因拷贝数,Mp为猪肉质量)和单位质量牛肉GH基因拷贝数(Kb,Kb=,Qb为牛GH基因拷贝数,Mb为牛肉质量)应为一个常数[23],二者比值(Kp/Kb,)应为一个固定值。根据这一固定值,可以将通过ddPCR测得的2 种基因拷贝数Qp和Qb转化为2 种肉类的相对质量分数()。为计算并确定这一固定值,将猪肉质量分数分别为5%、10%、20%、40%、60%、80%、90%的混合肉样以磁珠法提取DNA,通过ddPCR方法分别检测猪PRNP基因和牛GH基因拷贝数,并计算Kp/Kb。
1.3.7 Kp/Kb的准确性、重复性及检测限确定
称取5 份猪肉质量分数为50%的猪肉、牛肉混合肉样,提取DNA,通过ddPCR方法检测猪PRNP基因和牛GH基因的拷贝数,并根据1.3.6节中确定的Kp/Kb比值计算混合肉样中猪肉的质量分数,对于猪肉质量分数的实际值和检测值进行比较分析。
另取3~6 份猪肉质量分数分别为1%、5%、10%、20%、50%、60%、80%、90%、95%、99%的猪肉、牛肉混合样品,根据1.3.6节中确定的Kp/Kb比值计算猪肉的质量分数,并计算各样品的绝对误差、相对误差、变异系数(coeff i cient of variation,CV)及回收率[24],对方法的检测限进行确定。
1.3.8 市售牛肉制品中猪成分的检测
通过本方法对市售牛肉卷、牛肉干、牛肉肠和牛肉粒等20 份牛肉制品中猪源及牛源性成分进行定量检测,并计算其中猪源性成分的比例。将市售的3 份牛肉卷、3 份牛肉干、8 份牛肉肠和6 份牛肉粒分别按购买时间进行数字编号。
2 结果与分析
2.1 牛GH基因及猪PRNP基因引物探针特异性
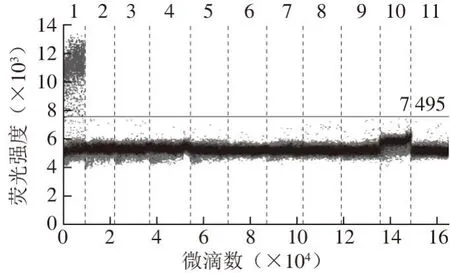
图 1 ddPCR方法验证牛GH基因引物探针的特异性Fig. 1 Specif i city of primers and probe targeting bovine GH gene by ddPCR
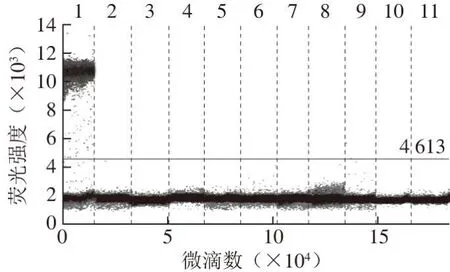
图 2 ddPCR方法验证猪PRNP基因引物探针的特异性Fig. 2 Specif i city of primers and probe targeting swine PRNP gene by ddPCR
由图1~2可知:牛GH基因引物探针对于牛肉样本显示出特异性扩增,对于猪肉、鸭肉、鸡肉及山羊肉等其他9 种肉样均没有扩增;猪PRNP基因引物探针对于猪肉样本有特异性扩增,对于包括牛肉在内的其他9 种肉类样本均没有扩增,表明2 种引物探针的特异性良好。
2.2 牛GH基因及猪PRNP基因引物探针灵敏性

图 3 ddPCR方法检测牛GH基因引物探针的灵敏性Fig. 3 Sensitivity of primers and probe targeting bovine GH gene by ddPCR
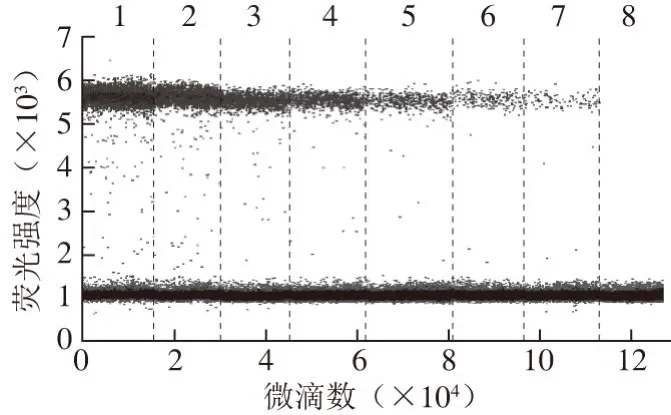
图 4 ddPCR方法检测猪PRNP基因引物探针的灵敏性Fig. 4 Sensitivity of primers and probe targeting swine PRNP gene by ddPCR
由图3~4可知,ddPCR方法对牛和猪DNA的检出限为0.625 ng/μL,阳性拷贝数分别为(8.4±1.1) copies/µL和(6.7±0.7) copies/µL,CV分别为10.43%和11.36%,均小于25%,表明以该方法检测牛GH基因及猪PRNP基因具有良好的灵敏性。
2.3 Kp/Kb的计算及验证
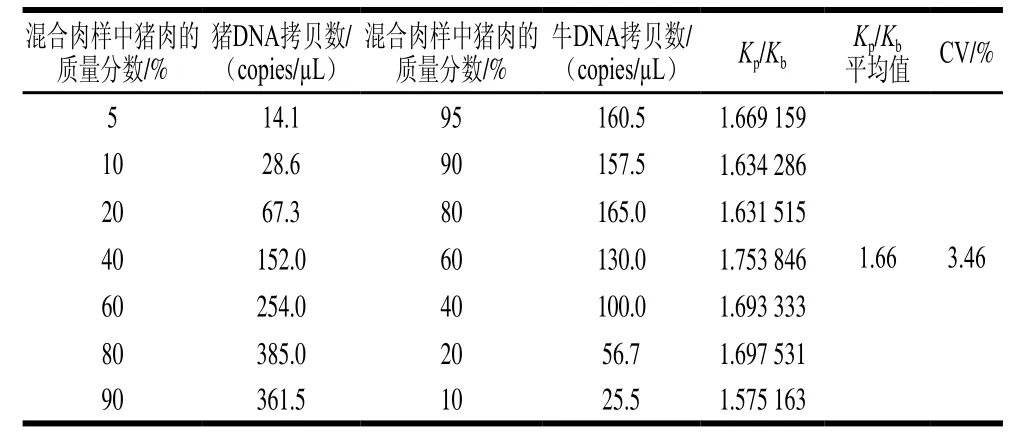
表 3 不同混合肉样的Kp/Kb测定结果Table 3 Kp/Kb values of different mixed meat samples
对猪肉质量分数分别为5%、10%、20%、40%、60%、80%、90%的猪肉、牛肉混合样品中猪PRNP基因拷贝数(Qp)及牛GH基因拷贝数(Qb)进行测定,并计算Kp/Kb。由表3可知,混合肉样中Kp/Kb平均值为1.66,检测的CV为3.46%。
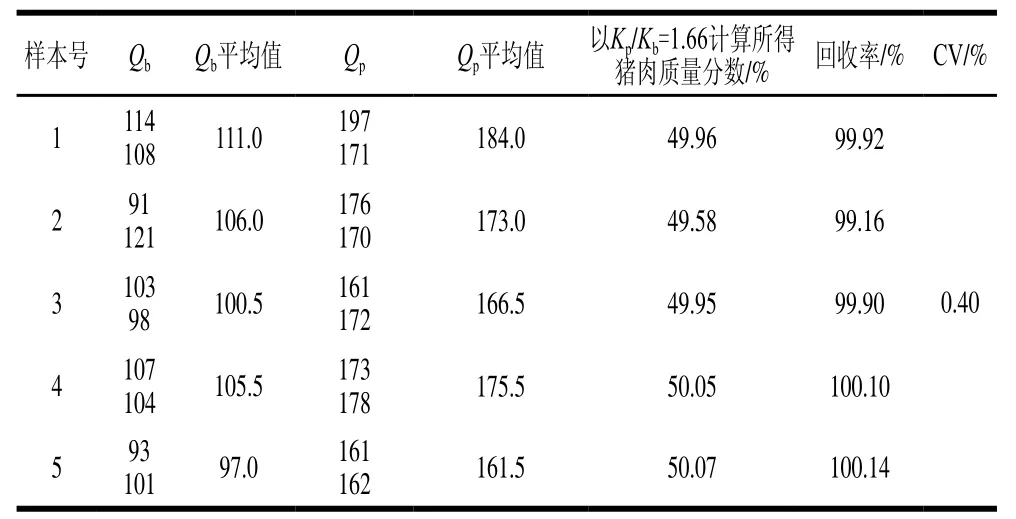
表 4 猪肉质量分数为50%的混合肉样准确度和精密度测定结果Table 4 Accuracy and precision in detection of mixed meat samples with 50% pork
制备5 份猪肉质量分数为50%的猪肉、牛肉混合肉样,采用ddPCR方法分别检测Qp和Qb,以Kp/Kb=1.66作为固定值计算混合肉样中猪肉质量分数。由表4可知,5 份混合肉样中猪肉的回收率在99.16%~100.14%之间,猪肉质量分数在49.58%~50.07%之间,平均值为49.92%,CV为0.40%。上述结果表明,应用计算所得Kp/Kb测定猪肉质量分数相同的混合肉样具有很好的准确度和精密度,可以应用该比值进行猪肉、牛肉混合肉样中猪肉质量分数的计算。
2.4 ddPCR方法的检测限

表 5 以Kp/Kb=1.66计算不同混合肉样中猪肉的质量分数Table 5 Calculation of pork proportion in blended meat samples by Kp/Kb ratio (1.66)
提取猪肉质量分数分别为1%、5%、10%、20%、50%、60%、80%、90%、95%及99%的猪肉、牛肉混合肉样的DNA,分别测定Qp和Qb,以Kp/Kb=1.66计算猪肉质量分数。由表5可知,当猪肉质量分数在5%~99%范围内时,根据本研究确定的Kp/Kb(1.66)计算混合肉样中猪肉质量分数的绝对误差≤1.28%,相对误差≤2.84%,CV<6.50%,回收率在99.09%~102.80%之间,测量值接近于实际值。因此,该方法检测牛肉中掺杂猪肉的最低检测限为5%,最高检测限达99%。
2.5 市售牛肉制品的检测
以本研究建立的检测方法对20 份市售牛肉肠、牛肉卷、牛肉干和牛肉粒中的猪肉成分进行定量检测。结果表明,所有样品中均检出牛源性成分,牛肉卷和牛肉干样品中未检出猪源性成分,牛肉肠和牛肉粒中检出猪源性成分。
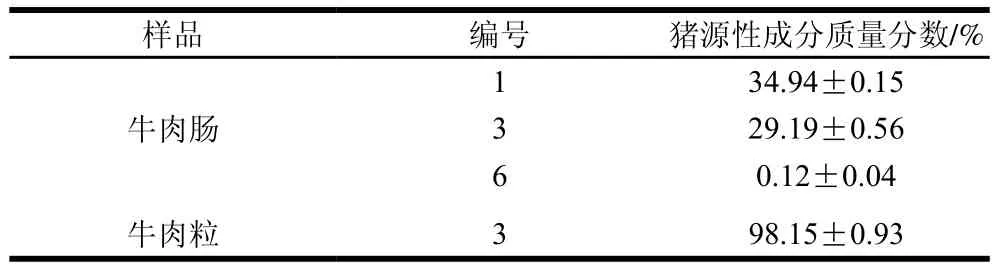
表 6 市售牛肉制品中猪源性成分的含量检测结果Table 6 Quantitative detection of pork in commercial beef products by ddPCR
由表6可知,牛肉肠和牛肉粒中检出的猪源性成分含量在29.19%~98.15%之间,其中6号牛肉肠中猪源性成分的相对含量低于本方法最低检测限5%。
3 讨 论
随着食品工业的发展,肉类制假掺假层出不穷。各国已有相关法规来约束生产者和经营者的行为,然而要对肉源性成分是故意添加或无意沾染进行准确判断以及对肉制品标签中相应成分的含量进行鉴定核查,必须要建立科学、快捷的检测方法,来满足这些精准定量检测需求,并保障相关法规的有效执行。
灵敏度的检测是衡量检测方法的重要指标之一。本研究采用ddPCR技术对GB/T 25165—2010[30]中检测牛源性成分的GH基因和猪源性成分的PRNP基因进行检测,将模板进行不同程度稀释后检测基因拷贝数,分析标准差和CV。结果表明,在模板质量浓度低至0.625 ng/µL时,该方法依然具有良好的检测灵敏度及准确性。并且,不同于线粒体多拷贝基因,GH基因与PRNP基因均为核基因,其拷贝数与肌细胞数量成一定比例,可以很好地反映样本质量,确保了本研究中将基因拷贝数之比转化为肉源性成分相对质量分数的可行性。
回收率和CV是检测准确度和精密度的重要评价指标,参照国际食品法典委员会标准CAC/GL 74—2010《检测、鉴定和量化食品中特定基因序列和蛋白质的执行标准和方法确认准则》[31],回收率应在70%~120%之间,CV应不大于25%。本研究采用固定比值法,确定了单位质量牛肉中GH基因和猪肉中PRNP基因拷贝数之比这一固定值,通过该值计算牛肉和猪肉的相对质量分数,当猪肉质量分数在5%~99%范围内时,回收率在99.09%~102.80%之间,CV均不大于6.50%,表明本方法具有良好的检测准确度和精密度,可以较好地应用于实际检测中。对市售样品进行检测时,在配料成分标明含有猪肉的牛肉肠类商品中检出猪源性成分。其中,6号牛肉肠样品中猪肉的相对质量分数为0.12%,低于本方法的检测下限5%,推断可能是无意沾染导致,或者该商品中添加了微量猪源性调味品。在市售牛肉卷和牛肉干中均未检出猪源性成分。根据GB/T 20712—2006《火腿肠》[32],用单一肉类原料,如牛肉,制成的产品应命名为“牛肉肠”。本研究中,检出含有一定量猪肉成分的牛肉肠类商品,其标签为“牛肉风味肠”或“牛肉早餐肠”,其中掺入的猪肉相对含量在30%左右,均符合国家有关标准规定。但是,3号牛肉粒样品中检出的猪肉相对质量分数达98.15%,表明生产中可能存在使用猪肉制作牛肉粒的情况。
采用固定比值法检测肉源性成分的质量分数操作简便且定量分析准确性高,在对2 种肉类混合样本进行相对含量检测时具有一定优势,并且市售商品中掺假肉及肉制品多为2 种肉类的掺杂混合,因此固定比值法具有重要的实际应用意义。然而,该方法仅适用于2 种肉类混合的样本,并且只能确定样本中2 种肉源性成分的相对含量。一些市售肉制品中常含有3 种肉类成分,要检测掺有3 种及3 种以上肉类样本中各种肉源性成分的绝对含量,采用建立肉类制品质量与核酸含量以及核酸含量与基因拷贝数2 个标准曲线的方法来进行进一步测算则更为实用。但是由于DNA提取效率在一定程度上会受到环境的影响,并且对操作要求较高,因此采用标准曲线法来确定肉品质量与核酸含量之间的线性关系的重复性和再现性欠佳。探索一种更为科学、快捷、精准且实用的多重数字PCR分析方法,实现对掺假肉及肉制品中多种常见肉源性成分的定量检测,可能是未来研究的主要方向之一。
4 结 论
本研究以单位质量牛肉的生长激素基因和猪肉朊蛋白基因拷贝数之比为一固定值,建立牛肉中猪源性成分检测的ddPCR方法,该方法具有良好的准确性和重复性,检测限可达0.625 ng/µL,牛肉中掺杂猪肉的质量分数在5%~99%范围内时,检测结果的绝对误差小于1.28%,CV小于6.5%,猪肉成分的回收率在99.09%~102.80%之间。本研究所建立的ddPCR方法可以较好地应用于牛肉制品中掺杂猪肉成分的定量检测,为有关部门打击掺假等违规行为提供技术支撑,促进动物源性食品行业的健康发展。
