金丝桃苷对NK细胞杀伤人胰腺癌PANC1细胞的增强效应
2018-10-25薛成俊周燏徐涛吕小婷郑璐周忠海
薛成俊 周燏 徐涛 吕小婷 郑璐 周忠海
金丝桃苷又称槲皮素3-D-半乳糖苷,属于黄酮醇类中药单体化合物,是槲皮素天然的衍生物,可由金丝桃科、杜鹃花科、卫矛科等多种科属植物中萃取获得。金丝桃苷具有抗氧化、抗炎、抗肿瘤、利尿、降低胆固醇、心肌缺血保护及免疫调节等药理作用[1-2]。NK细胞作为机体的固有免疫细胞,占外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)的5%~15%,是机体抗肿瘤的第一道防线,杀伤细胞迅速,无需抗原致敏即可直接杀伤敏感的肿瘤细胞,在抗新生瘤、已形成肿瘤及转移瘤中均发挥重要作用[3]。既往研究报道多种方法可增强NK细胞的肿瘤杀伤活性[4-5]。近年开发中药单体成分对人免疫细胞增强效应的研究逐渐增多[6-8]。本研究观察金丝桃苷对人NK细胞增殖及杀伤胰腺癌细胞的效应,并初步探讨其机制。
材料与方法
一、人NK细胞的培养和鉴定
取健康志愿者外周血100 ml,经Ficoll淋巴细胞分离液分离获得PBMCs,生理盐水洗涤后调整细胞密度为1.5×107/ml,取100 μl细胞悬液接种于6孔培养板。每孔加含IL-2(厦门特宝生物工程股份有限公司)及5%血清的NK细胞培养液3 ml(CellGenixTM GMP SCGM)诱导PBMCs,同时添加0.3、1.6、8、40、200 μg/ml DMSO溶解的金丝桃苷溶液作为金丝桃苷组,每组设3个复孔,以单纯加DMSO作为对照组,常规培养12 d。观察细胞形态并收集细胞,调整细胞密度为1×107/ml,取100 μl细胞悬液加入FITC标记的抗人CD56(6 μg/ml)和PerCP-cy5.5标记的抗人CD3(3 μg/ml)各20 μl,室温避光孵育20 min,PBS洗涤2遍后以400 μl PBS重悬,上流式细胞仪(BD FACSCalibur)鉴定NK细胞表型。
二、NK细胞增殖能力检测
采用以上细胞分组,培养前行PBMCs计数,分两部分,一部分培养12 d后收集细胞,采用台盼蓝拒染法计数存活细胞数,另一部分在培养前及培养12 d后采用上述方法上流式细胞仪检测CD3-CD56+NK细胞百分含量,计算各组NK细胞增殖倍数。增殖倍数=金丝桃苷诱导后活细胞数×培养后NK细胞含量(%)/PBMCs 数×培养前NK细胞含量(%)。
三、NK细胞穿孔素及颗粒酶B表达检测
取上述金丝桃苷各浓度组和对照组标记的1×107/ml NK细胞20 μl,加入100 μl Fix&Perm破膜剂A避光孵育15 min,PBS洗涤后加入破膜剂B,同时加入5 μl PE标记的穿孔素抗体(12 μg/ml)或5 μl PE标记的颗粒酶B抗体(25 μg/ml),室温避光继续孵育20 min,PBS洗涤后以400 μl PBS重悬细胞,上流式细胞仪检测穿孔素或颗粒酶B水平,分别以PE标记的anti-IgG2bκ或PE标记的anti-IgG1作为同型对照。
四、NK细胞杀伤胰腺癌PANC1细胞活性检测
取上述金丝桃苷各浓度组和对照组NK细胞作为效应细胞,调整细胞密度为2×108/L。取对数生长期的PANC1癌细胞株作为靶细胞,调整细胞密度为1×107/L,以效靶比为20∶1混合,同时设效应细胞自然释放管、靶细胞自然释放管及靶细胞最大释放管,每组设3个复管。常规培养6 h,1 500 r/min离心10 min,收集上清液置Encore自动生化分析仪,应用乳酸脱氢酶(lactate dehydrogenase, LDH)释放法测定各管340 nm波长处吸光值(A340值),计算杀伤活性。杀伤活性(%)=(实验组A340值-效应细胞自然释放组A340值)/(靶细胞最大释放组A340值-靶细胞自然释放组A340值)×100%。
五、统计学处理
结 果
一、人NK细胞鉴定
PBMCs培养12 d后在倒置显微镜下可见大小不一的细胞集落黏附在细胞培养板底部。金丝桃苷各浓度诱导组和对照组NK细胞含量均达到79.65%,NK细胞表型为CD3-CD56+(图1),表明NK细胞扩增成功。

图1 NK细胞的形态(1A, ×400)及其CD3-CD56+ 表型细胞比例(1B)
二、金丝桃苷对NK细胞增殖的影响
0.3~8 μg/ml金丝桃苷以浓度依赖性促进人NK细胞增殖,8 μg/ml时细胞增殖率最高,为(43.35±4.58)%。诱导培养12 d时,0.3、1.6、8 μg/ml金丝桃苷组增殖倍数分别为(93.76±8.77)、(106.67±12.35)、(118.50±11.51)倍,显著高于对照组的(73.70±9.43)倍,差异均有统计学意义(P值分别为0.048、0.001、0.000)。40、200 μg/ml金丝桃苷组的增殖倍数分别为(81.91±13.96)、(80.36±13.24),与对照组差异无统计学意义。
三、金丝桃苷对NK细胞穿孔素、颗粒酶B表达的影响
1.6、8、40 μg/ml金丝桃苷组NK细胞穿孔素水平显著高于对照组,1.6、8 μg/ml金丝桃苷组NK细胞颗粒酶B水平显著高于对照组,差异均有统计学意义(表1)。
四、金丝桃苷对NK细胞杀伤PANC1细胞活性的影响
1.6、8 μg/ml金丝桃苷组NK细胞杀伤PANC1细胞活性分别为(63.18±3.77)%、(65.34±4.97)%,显著高于对照组的(52.16±5.48)%,差异均有统计学意义(P值分别为0.012、0.003)。0.3、40、200 μg/ml金丝桃苷组NK细胞杀伤PANC1细胞活性分别为(53.31±4.40)%、(60.00±3.54)%、(55.51±4.81)%,与对照组差异无统计学意义。

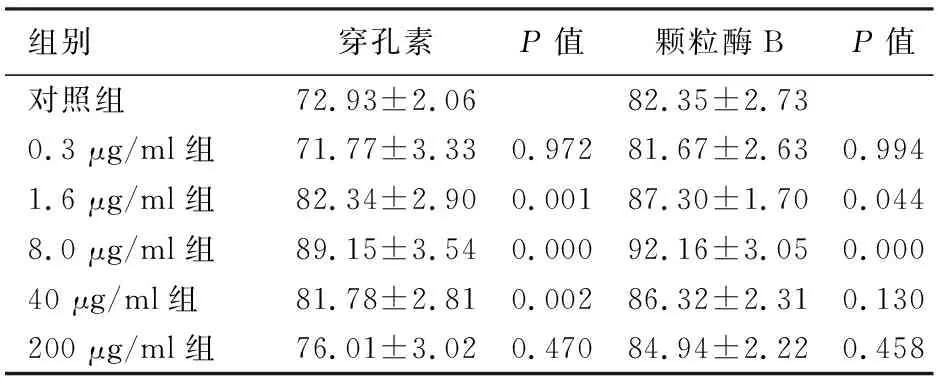
组别穿孔素P值颗粒酶BP值对照组72.93±2.0682.35±2.730.3 μg/ml组71.77±3.330.97281.67±2.630.9941.6 μg/ml组82.34±2.900.00187.30±1.700.0448.0 μg/ml组89.15±3.540.00092.16±3.050.00040 μg/ml组81.78±2.810.00286.32±2.310.130200 μg/ml组76.01±3.020.47084.94±2.220.458
讨 论
NK细胞是固有免疫细胞重要组成成分,在机体抗感染、抗肿瘤免疫防御中发挥着第一道防线的作用。NK细胞分泌IFN-γ 等肿瘤细胞抑制性细胞因子,能通过NKG2D、DNAM-1等NK细胞相关受体/配体直接杀伤肿瘤细胞,而且还能促进肿瘤特异性杀伤T细胞增殖[9]。随着研究的深入,NK细胞成为体外扩增培养用于肿瘤过继性免疫治疗的效应细胞[4]。金丝桃苷的抗肿瘤效应在多种肿瘤研究中得到了证实,可通过Bcl-2及NF-κB信号途径抑制胰腺癌细胞生长及诱导其凋亡[2],通过p53途径抑制SW620结肠癌细胞并诱导其凋亡[10],通过Akt/mTOR/p70S6K信号途径诱导肺癌细胞自噬和凋亡[11]。
颗粒酶B是一种调节炎症反应、凋亡和抗病毒免疫的丝氨酸蛋白酶,是细胞毒活性的重要标志物[12]。穿孔素作为穿孔蛋白帮助颗粒酶B进入靶细胞,二者协同作用有利于维持内环境稳定及调节炎症反应,颗粒酶-穿孔素途径是NK细胞杀伤肿瘤细胞的主要机制之一[13]。
本研究结果显示,金丝桃苷在0.3~8 μg/ml范围内可促进NK细胞体外增殖,但随着金丝桃苷浓度的继续增加,其促增殖作用减弱,明确了金丝桃苷作用的浓度范围,为今后对金丝桃苷药理作用的实验研究奠定基础。
本研究结果还显示,适当浓度的金丝桃苷诱导可增强NK细胞对PANC1细胞的杀伤活性,且增加NK细胞颗粒酶B、穿孔素的表达,提示金丝桃苷可能通过上调颗粒酶、穿孔素表达而增强NK细胞的肿瘤杀伤活性。进而拓宽了中药单体成分金丝桃苷的药理学应用范围,为其应用于肿瘤的免疫治疗提供实验依据。
