HPV检测在宫颈癌前病变筛查策略中的作用探讨
2018-10-24沈晓斌
沈晓斌,包 磊,詹 莹
(1.绍兴市中医院病理科,浙江 绍兴 312000;2.绍兴市妇幼保健院病理科,浙江 绍兴 312000)
宫颈癌是妇科常见的恶性肿瘤之一,占女性生殖系统恶性肿瘤的首位,是目前世界范围内对女性生命健康构成威胁的第二大恶性肿瘤。世界卫生组织(World Health Organization,WHO)2008年的全球癌症调查数据显示,全球约47万妇女被诊断为宫颈癌,约27.5万妇女死于宫颈癌,我国每年新发病例与死亡人数占全球的1/3[1-2]。研究预计宫颈癌的死亡人数将在近10年内上升25%,发达国家因宫颈癌筛查防治措施逐步完善,发病率已逐年减低,但大多数发展中国家的宫颈癌发病率却呈上升趋势[3]。约99%以上的宫颈癌发生与人乳头瘤病毒(human papillomavirus,HPV)感染密切相关,而持续性高危型HPV感染是发生宫颈癌的主要原因。早诊断、早治疗是提高子宫颈癌患者生存率及改善其生存质量的关键。目前HPV的检测在妇产科临床中主要应用于与细胞学联合筛查、单独筛查宫颈癌及其癌前病变,细胞学筛查异常的分流及治疗后或筛查异常的随访。本研究主要探讨HPV检测替代新柏氏液基细胞学检查(thinprep cytologic test,TCT)检查单独作为宫颈癌早期筛查一线方案的可行性,及HPV检测与TCT检查有机结合的联合宫颈癌筛查方案与单一筛查方案的优劣。
1资料与方法
1.1资料来源
收集绍兴市妇幼保健院2016年因患宫颈疾病行阴道镜下宫颈活检检查的855例患者资料,根据病理活检结果分为三组,包括低级别宫颈上皮内瘤变(CIN)患者(低级别CIN组)496例,年龄为22~64岁,平均(35.6±9.3)岁;高级别CIN患者(高级别CIN组)138例,年龄为25~62岁,平均(40.9±9.1)岁;宫颈浸润癌患者(宫颈浸润癌组)14例,年龄为32~64岁,平均(42.3±9.0)岁;宫颈活检为黏膜慢性炎患者(正常组)207例作为对照,年龄为25~68岁,平均(32.8±8.9)岁。四组患者年龄比较差异无统计学意义(F=1.317,P>0.05)。四组既往均无盆腔放疗史、急性生殖道炎症及宫颈物理治疗史。
1.2试剂及设备
妇科宫颈液基细胞学(liquid-basedcytologytest,LBP)检查:使用TCT试剂耗材进行细胞学检查,采用WHO(2014版)规范TBS(The Bethesda System)诊断标准报告进行分类。
Cervista HPV 检测:Cervista HPV HR试剂和设备由Hologic公司提供。Cervista HPV HR检测根据生产商说明书操作进行。从剩余TCT标本中提取DNA样本,然后使用Cervista HPV HR试剂进行检测。
1.3标本采集
使用新柏氏TCT检测专用刷插入患者宫颈管旋转8~10周,收集宫颈口及宫颈管脱落的上皮细胞,将刷头置入CytoRich保存液瓶中待检。
LBP涂片的制作:摇匀震荡后取标本5mL加入液基细胞制片机中,制成涂片染色,试剂耗材为新柏氏TCT试剂。
1.4统计学方法

2结果
2.1各组不同检测分布情况
低级别CIN组、高级别CIN组和宫颈浸润癌组Cervista HPV阳性率均高于正常组,且后两组Cervista HPV阳性率均高于低级别CIN组和正常组;低级别CIN组、高级别CIN组和宫颈浸润癌组Cervista HPV阳性率均高于TCT的阳性率,正常组也高于TCT的阳性率,见表1。
低级别CIN组Cervista HPV检测结果阳性率低于高级别CIN组,两组比较差异有统计学意义(χ2=6.479,P<0.05);低级别CIN组Cervista HPV检测结果阳性率低于宫颈浸润癌组,两组比较差异无统计学意义(χ2=0.018,P>0.05);正常组Cervista HPV检测结果阳性率低于低级别CIN组,两组比较差异无统计学意义(χ2=2.033,P>0.05);高级别CIN组Cervista HPV检测结果阳性率高于宫颈浸润癌组,两组比较差异无统计学意义(χ2=0.415,P>0.05);正常组Cervista HPV检测结果阳性率低于高级别CIN组,两组比较差异有统计学意义(χ2=10.732,P<0.05);正常组Cervista HPV检测结果阳性率低于宫颈浸润癌组,两组比较差异无统计学意义(χ2=0.144,P>0.05)。
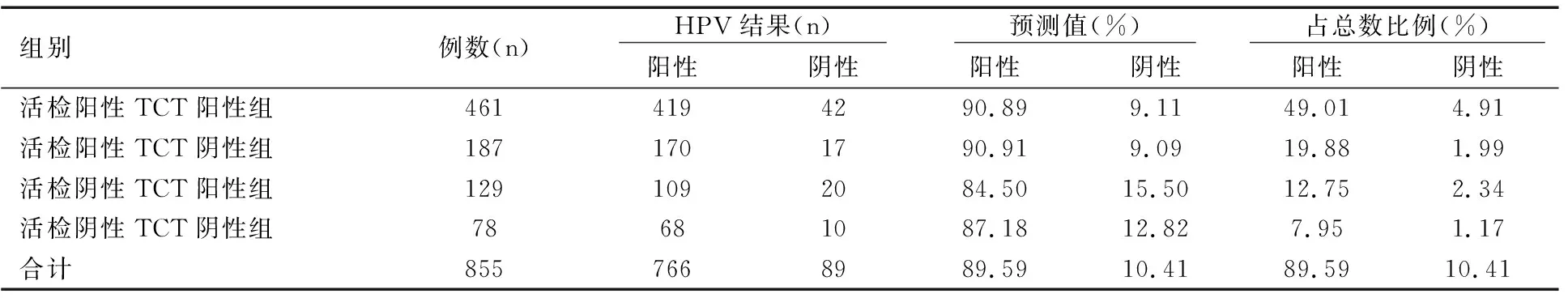
表 1 四组患者的TCT和Cervista HPV检测阳性分布结果
2.2各组Cervista HPV检测分布情况
将活检结果:低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)和宫颈浸润癌为阳性,黏膜慢性炎为阴性;新柏氏TCT结果:非典型鳞状细胞-不能明确意义(ASCUS)、LSIL、非典型鳞状细胞-不除外高度鳞状上皮内病变(ASCU-H)、HSIL、非典型腺细胞-不能明确意义(AGC-nos)、非典型腺细胞-倾向瘤变(AGC-N)为阳性,未见上皮内病变/恶性细胞(NILM)为阴性分成四组,分别为活检阳性TCT阳性组、活检阳性TCT阴性组、活检阴性TCT阳性组及活检阴性TCT阴性组。对照Cervista HPV检测结果,其中,活检阳性TCT阳性组461例中有42例为阴性,占总数4.91%(42/855);而活检阴性TCT阴性组78例中有68例为阳性,占总数7.95%(68/855),见表2。

表 2 四组患者Cervista HPV DNA检测阳性分布结果
3讨论
3.1 HPV检测有一定局限性
马莉等[4]研究显示,高危型HPV分型检测敏感度为96.11%,特异度为85.76%,阳性预测值为30.94%,阴性预测值为99.70%,因此认为高危型HPV分型检测在子宫颈癌及其癌前病变的筛查中具有指导意义,可首选HPV分型检测作为初筛手段。本研究的结果显示低级别CIN组与高级别CIN组及宫颈浸润癌组新柏氏TCT检查的阳性率相似;在高危型Cervista HPV检测中,低级别CIN组阳性率低于高级别CIN组及宫颈浸润癌组,而在正常组中HPV检测的假阳性率高于新柏氏TCT检测,分别为85.51%、62.32%,其提示HPV检测可能敏感度较高。本研究中可见单独行新柏氏TCT检查在低级别CIN组、高级别CIN组和宫颈浸润癌组中假阴性率分别为24.40%、36.68%、21.43%,而单独行HPV检测在低级别CIN组、高级别CIN组和宫颈浸润癌组中假阴性率则分别为10.69%、3.62%、7.14%,均低于新柏氏TCT检查。同时总的假阴性率也低于新柏氏TCT检查,分别为10.41%、29.71%,提示单独Cervista HPV检测可能比单独TCT检查更适合对健康人群做初筛检查。
本研究显示在活检阳性TCT阳性组461例中有42例HPV检测为阴性,假阴性率为4.91%;而活检阴性TCT阴性组78例中有68例HPV检测为阳性,假阳性率为7.95%。有文献表明,一般假阴性率指标在10%~30%之间不等,其原因一是HPV检测不论何种技术,均不同程度地存在假阴性、假阳性,同时也说明宫颈癌及癌前病变并非全部与HPV相关;研究还报道浸润性宫颈癌患者组织学诊断前几个月宫颈细胞学样本杂交捕获二代HPV检查技术(HC2 HPV)检测的阴性率为7.5%~15.5%,研究结果表明细胞学HC2 HPV检测“真阴性”(即细胞学样本HC2 HPV和癌组织学样本均为阴性)病例占54%[5],其提示这些宫颈癌的发生可能与HPV感染无关,所以即使用最敏感的HPV检测方法作为单一宫颈癌筛查手段也会遗漏这些患者,延误治疗。而两者联合检测方案则明显优于单独HPV检测或宫颈细胞学检查方案中的任何一种。
3.2 HPV检测的应用范围
众所周知,良好的检测方法需要高敏感度,分析敏感度体现的是检测方法对于病毒感染的分析能力,分析敏感度越高,就越能检测到越低病毒载量的感染;而临床敏感度体现的是检测方法对于病毒造成临床病变的检测能力。HPV检测方法与其他病原体检测方法如乙型肝炎病毒(hepatitis B virus,HBV)和人类免疫缺陷病毒(human immunodeficiency virus,HIV)等在临床应用的目的上有着本质差异。感染HIV高度提示获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS),但感染HPV并非一定有CIN Ⅱ或宫颈癌。因此对于HIV需要检测方法具有尽量高的分析敏感度,但对于HPV检测过高的分析敏感度将导致许多没有病变风险的低病毒载量感染者被检为阳性,而其通常为一过性感染[6]。一过性HPV感染检测为阳性的潜在伤害包括:患者的焦虑、额外的诊断及治疗造成的不安、治疗造成的出血,及远期妊娠并发症风险升高等[7]。因此,在宫颈癌筛查中,高危型人乳头状瘤病毒(high risk human papilloma virus,HR-HPV)检测的关键在于检测伴有或会发展为CIN Ⅱ+的HR-HPV感染,而不是检测一过性HR-HPV感染。HPV检测的目的不是筛查HPV感染,而是筛查出高度病变风险的人群[8]。
2012年美国阴道镜检查与宫颈病理学会(American Society For Colposcopy and Cervicai Pathology,ASCCP)指南严格要求HPV仅指HR-HPV,其他HPV型别与宫颈癌不相关,在宫颈癌筛查中不应使用该方法。低危型HPV的检测对于筛查宫颈癌和评估异常细胞学而言没有临床价值[9]。
3.3 HPV检测应与TCT检查联合应用
一个好的筛查方法,虽然难以要求其确诊功能,但其应该既不遗漏患者,也能较好地排除非患病人群,不给随访者带来较大的心理负担。在美国癌症协会(American Cancer Society,ACS)和ASCCP发布的宫颈癌筛查指南中,不建议对30岁以下人群采取常规HPV DNA检测,因有70%~80%的女性在一生中有可能感染HPV,90%感染者可在8~24个月内自然清除,只有少数持续性、高危型HPV感染有可能导致宫颈病变或宫颈癌[9-10]。
HR-HPV检测的特点是敏感性高,可达90.8%,但缺点是特异性低,其检出CIN Ⅱ~Ⅲ的特异度约为44.5%[11]。目前,HR-HPV的检测更多应用于高收入国家,而我国目前的HR-HPV检测相关试剂多达70余种,多数产品缺乏子宫颈癌筛查的临床数据及随访数据的支持,且缺乏严格质控,这必然影响其筛查的准确性。
由此可见,目前的HPV检测方法还不能替代TCT检测成为宫颈癌筛查的一线方案[4]。当然,HPV检测在宫颈癌前病变筛查中是相当重要的,是不可或缺的一个环节。HPV检测联合TCT检测,可有效地分流细胞学诊断中意义未明的不典型鳞状细胞(ASCUS)及低度鳞状上皮内病变(LSIL)者,可以减轻患者的心理负担,节约宝贵的医疗资源,并具有极大的社会经济学效益。
总之,HPV检测联合TCT检测,两者有机结合使用筛查宫颈癌,更有利于综合评估患者发生宫颈病变的风险。
