MIB2对HepG2肝癌细胞恶性生长的影响①
2018-10-12沈少灵偏丽丽黄晓峰修冰水
徐 哲 刘 健 沈少灵 偏丽丽 黄晓峰 林 周 修冰水
(安徽医科大学,合肥230000)
肝癌(Hepatocellular carcinoma,HCC)是比较常见的恶性肿瘤,其高发病率和高致死率一直是人类难以解决的问题之一,在中国每年有超过三十万人死于HCC,其致死率在肿瘤相关死亡病例中位于第二位,仅次于肺癌,严重危害了人类的生活质量和生命健康[1]。肝癌的发病机制复杂多样,其具体分子机制尚不清楚[2]。多项研究表明炎症和RNA病毒(如HCV)感染是肝癌发病的关键因素[3,4]。炎性细胞因子TNF-α在体内外均可直接杀伤肿瘤细胞。另有研究显示自分泌的IL-6会促进恶性肿瘤细胞生长[5-8]。现代医学主要采用手术、放疗、化疗、血管介入治疗等方法,但疗效并不理想,年生存率仅8%~10%[9,10]。因此研究其发生发展的分子机制,寻求一种新的治疗方式有着深远的意义。
Mindbomb E3 ubiquitin protein ligase 2(MIB2)是Notch配体Delta的E3泛素连接酶[11-13]。近年来越来越多证据证明,Notch 信号通路与肿瘤的发生发展关系密切[14-18]。而MIB2在肿瘤中的作用尚不清楚[19]。本研究通过建立过表达MIB2稳定株,以TNF-α和SEV作用于肝癌细胞,采用软琼脂克隆形成、免疫印迹法及ELISA等方法检测MIB2对HepG2细胞的影响,并探讨其可能机制。运用过表达MIB2稳定株及瞬时敲低MIB2探究对炎症因子IL-6所产生的影响,从而为肝癌的后期治疗提供新的抗肿瘤药物靶点,进而为临床应用提供更多的理论依据,现将结果报道如下。
1 材料与方法
1.1材料
1.1.1主要试剂 胎牛血清购自美国HyClone公司;RIPA裂解液及蛋白定量试剂盒购自北京天根生物公司;LipofectamineTM2000转染试剂盒购自美国Gibco公司;LipofectamineTMRNA iMaX Reagent敲低试剂盒和Hygromycin购自美国Invitrogen公司;Notch1抗体和MIB2抗体购自美国Proteintech公司;山羊抗鼠β-actin抗体购自美国Santa Cruz公司;辣根过氧化物酶标记的山羊抗小鼠和山羊抗兔IgG二抗购自北京中杉金桥公司;ECL发光液、人IL-6(hIL-6)/人TNF-α(hTNF-α)ELISA试剂盒购自美国Thermo公司;X光片、显影液、定影液购自美国Kodak公司;PVDF膜购自美国 Millipore 公司;Agar购自美国Sigma公司;RNA病毒Sendi virus(SEV)为北京大学蒋争凡教授惠赠;FLAG-MIB2质粒由Addgene公司提供;小鼠TNF-α(mTNF-α)购自R&D公司。
1.1.2仪器设备 CO2培养箱与低温高速冷冻离心机购自美国Thermo公司;酶标仪购自瑞士Tecan sunrise公司;紫外分光光度计购自北京普析通用仪器有限责任公司;SDS-PAGE蛋白电泳及转印购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养 肝癌细胞HepG2为本实验室保种存放。由含10%胎牛血清的DMEM培养基(含100 U/ml 青霉素钠和100 U/ml 硫酸链霉素),于37℃、5%CO2培养箱中培养,当细胞生长至80%时,0.25%胰酶消化、计数、传代。
1.2.2筛选过表达MIB2稳定株 细胞转染FLAG-MIB2质粒,转染24 h后按100、1 000、10 000个细胞/孔的比例种入96孔板,同时按40 μg/ml的浓度加入Hygromycin筛选过表达MIB2稳定株,两周后,挑选单克隆移入24孔板,长满后种入6孔板并鉴定,选择鉴定成功的MIB2稳定株传代,并冻存于液氮用于后续试验。
1.2.3软琼脂克隆形成 按照 4.5 ml∶4.5 ml∶1 ml的体积依次将2×DMEM、1.2% Agar和血清混合,制备下层凝胶。整个过程避免气泡产生,需快速充分混匀后加入6孔板中(如不快速混匀,易发生凝固现象)。每孔1.5 ml,晃动使其均匀铺展,置于4℃促凝20 min。促凝期间取对数生长期细胞,调整其密度至104ml-1待用。最终细胞数量定在103孔-1。细胞悬液制备完毕后,按照1 400 μl∶350 μl∶350 μl∶1 400 μl的体积依次将2×DMEM、血清、单细胞悬液和0.6%凝胶液混合,制备上层凝胶。整个过程同样避免气泡产生,快速充分混匀后每孔1 ml,加入6孔板下层凝胶之上,轻柔晃动使其均匀铺展,置于4℃促凝10 min。待上层凝胶充分凝固之后,每孔加入1 ml 1×完全DMEM培养基。将6孔板置于37℃、5%CO2培养箱中,14 d后将培养基弃掉,每孔加入1 ml MTT,4 h后观察集落形成情况。
1.2.4Western blot法检测蛋白表达水平 使用(mTNF-α)和SEV处理6孔板内生长良好的MIB2过表达HepG2细胞和阴性对照4 h,设置未处理组、TNF-α组、SEV组,每组设置2个复孔。用预冷的生理盐水洗涤后,每孔加入120 μl RIPA裂解液,刮取细胞收集于1.5 ml EP管内,冰上裂解15 min,4℃离心机13 000 r/min离心15 min,利用紫外分光光度计调整蛋白浓度,沸水煮10 min使蛋白充分变性。SDS-PAGE电泳,60 V恒压转印3 h到PVDF膜上,5%脱脂牛奶室温封闭1 h,孵育一抗(β-actin、FLAG、MIB2、Notch1)4℃过夜,次日TBST洗3遍,每次10 min,HRP山羊抗小鼠和山羊抗兔IgG二抗室温孵育1 h,TBST洗3遍,每次10 min,涂ECL后于暗室曝光显影。
1.2.5ELISA法检测细胞因子 将生长良好的MIB2过表达HepG2细胞和阴性对照用0.25%胰酶消化计数后,以每孔 2×105细胞接种于24孔板内,置于37℃、5%CO2培养箱中待贴壁完成后,分别设置未处理组、TNF-α组、SEV组,每组设置2个复孔。4 h之后将细胞上清收取冻存于-80℃冰箱,用于ELISA检测。按照ELISA试剂盒说明操作,在酶标仪450 nm及570 nm波长处读取吸光度,并测定其ODA450nm及ODA570nm值,使用Prism软件分析计算。
1.2.6小干扰RNA(siRNA)敲低MIB2 以每孔2×105细胞接种于24孔板内,待贴壁培养20 h后,按照说明书,利用LipofectamineTMRNA iMaX Reagent转染siRNAs。MIB2 siRNAs序列为:siRNA-1#GGAGGTGCCAAACATCGAT与siRNA-2#GCTAGCTGTGA-GAAAGATT,以非靶点对照siRNA(NC siRNA)为对照。48 h 后用于ELISA检测或Western blot分析。
2 结果
2.1筛选过表达MIB2稳定株及Western blot鉴定 在HepG2细胞中转染FLAG-MIB2质粒并筛选,抗性克隆出现后,利用Western blot方法进行鉴定。综合内参、MIB2 以及标签FLAG的蛋白表达量来看,我们认为第1个为成功的过表达MIB2稳定株;3,5,6号克隆外源MIB2表达量较低,未能被敏感度偏低的FLAG标签抗体识别;而4号克隆可视为阴性对照。结果见图1。选择1号过表达MIB2稳定株用于后续实验。
2.2过表达MIB2对HepG2细胞软琼脂克隆形成的影响 阴性对照与过表达MIB2稳定株在种入Agar琼脂14 d后用MTT染色4 h可以观察到,6孔板中皆有集落形成,其肉眼克隆个数见图2。统计分析后,可以很明显的看到过表达MIB2稳定株的集落形成数量明显低于阴性对照(P<0.01)。
2.3过表达MIB2对HepG2细胞Notch1蛋白水平的影响 在阴性对照与过表达MIB2稳定株中分别加入小鼠TNF-α,RNA病毒SEV处理4 h,设未处理组。Western blot检测MIB2及FLAG标签,以确定细胞为过表达MIB2稳定株,检测Notch1的表达水平,图3显示Notch1的表达水平变化不显著。
2.4过表达MIB2对HepG2细胞分泌IL-6的影响 分别在对照克隆与过表达MIB2稳定株中加入小鼠TNF-α,SEV处理4 h,设未处理组。取上清ELISA检测发现,无论是否经过处理,过表达MIB2稳定株相对于对照克隆而言,人IL-6的分泌均显著下降,结果见图4。在上述各条件下均未检测到人TNF-α的分泌。

图1 过表达MIB2稳定株的鉴定Fig.1 Identification of stable clones over-express-ing MIB2
2.5小干扰RNA敲低MIB2对HepG2细胞分泌IL-6的影响 为了反向验证这一效应,在HepG2细胞中使用小干扰RNA(siRNA) 转染进行敲低实验,首先通过Western blot验证MIB2已被敲低,结果见图5。收集其细胞上清经ELISA检测,显示敲低MIB2后,无论是否经过处理,IL-6的表达均显著增高,见图6。因此我们认为MIB2对IL-6的分泌有一定的抑制作用。

图2 过表达MIB2对HepG2细胞软琼脂克隆形成的影响Fig.2 Effect of MIB2 over-expression on anchorage-independent growth of HepG2 cellsNote:

图3 过表达MIB2对HepG2细胞Notch1蛋白水平的影响Fig.3 Effect of MIB2 over-expression on protein level of Notch1 in HepG2 cellsNote: Lanes 1-3.Mock:Control,TNF-α,SEV,respectively.Lanes 4-6.FLAG-MIB2:Control,TNF-α,SEV,respectively.
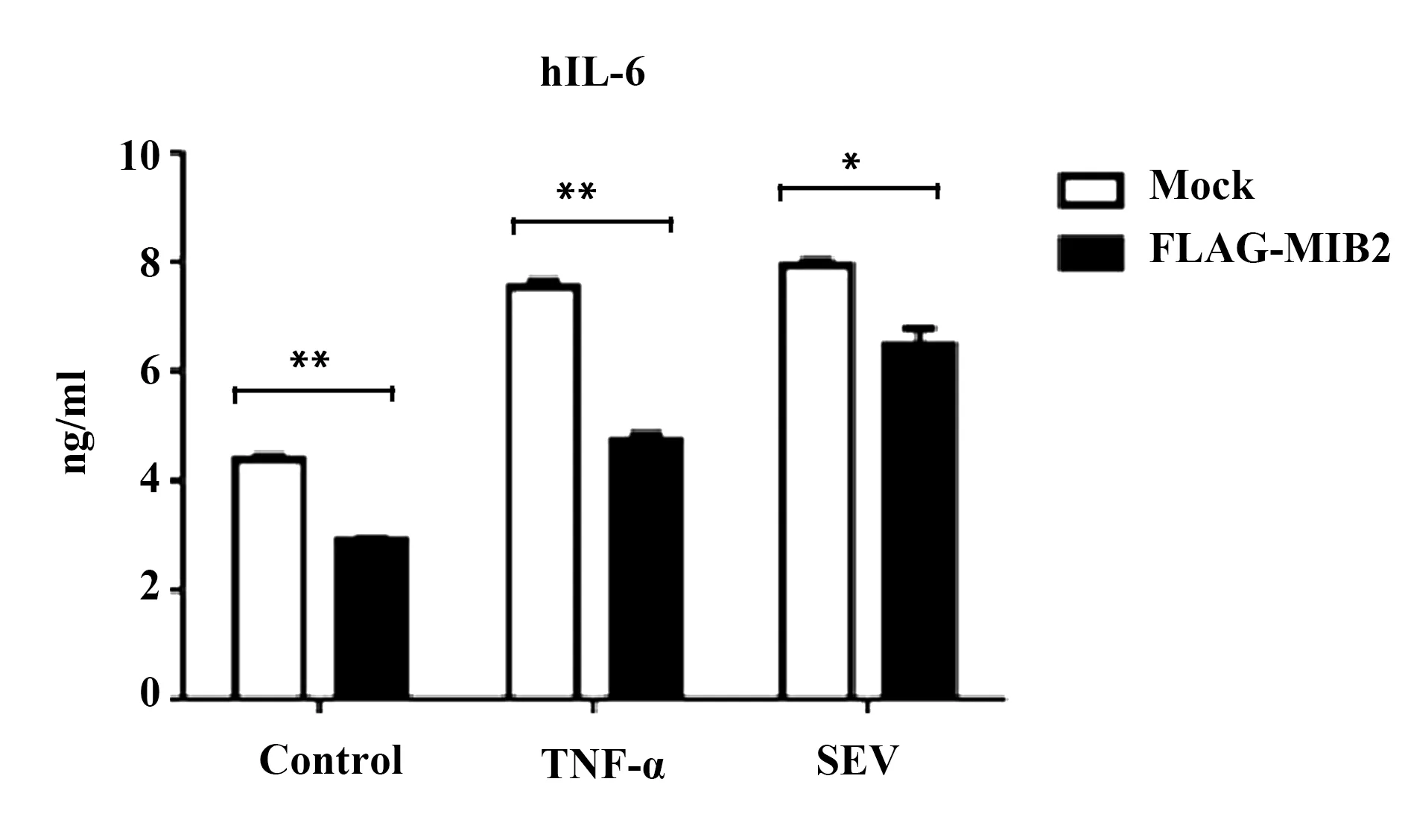
图4 过表达MIB2对HepG2细胞分泌IL-6的影响Fig.4 Effect of MIB2 over-expression on secretion of IL-6 in HepG2 cellsNote:
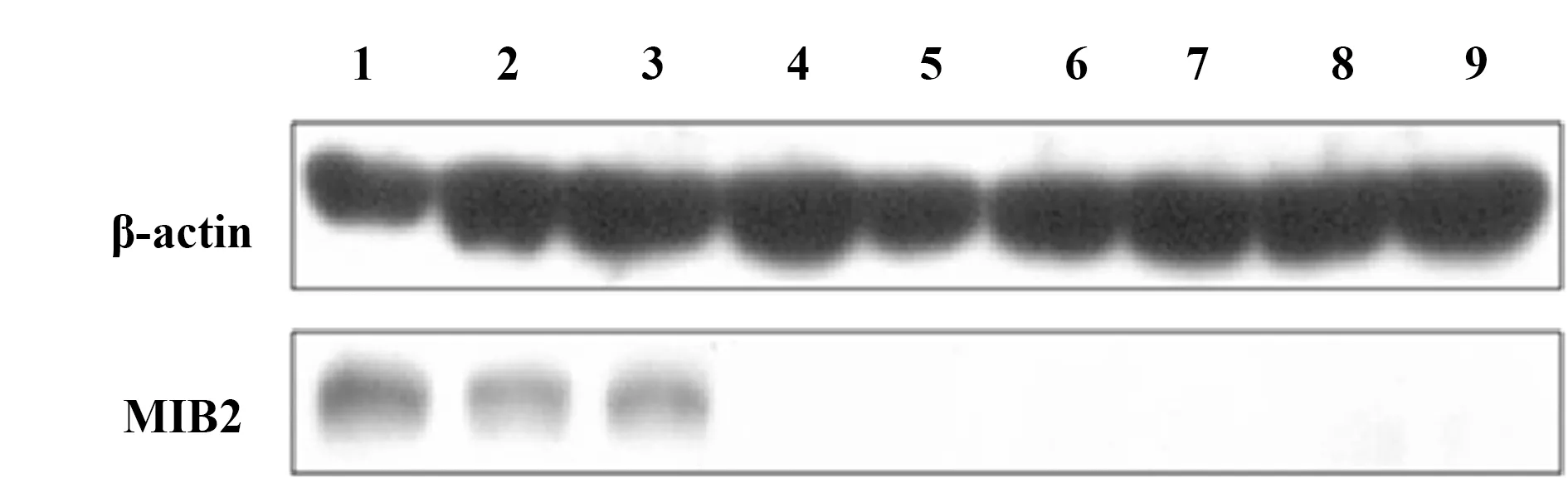
图5 HepG2肝癌细胞敲低MIB2的鉴定Fig.5 Identification of MIB2 knockdown in HepG2 cellsNote: Lanes 1-3.NC siRNA:Control,TNF-α,SEV,respectively;Lanes 4-6.MIB2 siRNA-1#,Control,TNF-α,SEV,respectively;Lanes 7-9.MIB2 siRNA-2#.Control,TNF-α,SEV,respectively.

图6 敲低MIB2对HepG2肝癌细胞分泌IL-6的影响Fig.6 Effect of MIB2 knockdown on secretion of IL-6 in HepG2 cellsNote:
3 讨论
肝癌是一种常见的、预后差、具有高度致死性的恶性肿瘤,且发病率在逐年攀升,严重威胁着人类的生活与健康[20]。已知MIB2为Notch通路的重要调节因子,但其在肿瘤中的作用还不清楚[21,22]。通过探讨MIB2对HepG2肝癌细胞恶性生长的影响,希望为肝癌的防治提供一种新的理论依据。
在HepG2肝癌细胞中筛选过表达MIB2稳定株,为后续实验提供更好的研究对象,经软琼脂克隆实验观察集落形成情况,发现过表达MIB2稳定株与阴性对照相比,克隆形成能力明显降低(P<0.01),表明了MIB2在HepG2肝癌细胞中有一定的抑制作用。与预期不一致的是,MIB2过表达并没有影响Notch1的表达水平,所以MIB2不是通过调控Notch通路活性影响HepG2细胞的恶性生长。有文献报道HepG2自分泌IL-6,而自分泌的IL-6会促进恶性肿瘤细胞生长[5-8]。为了探讨可能的机制,本研究分析了MIB2对IL-6表达分泌的影响。发现过表达MIB2导致HepG2细胞IL-6本底水平的分泌和TNF-α及SEV诱导的分泌均下降,而MIB2敲低后,HepG2细胞IL-6本底水平的分泌和TNF-α及SEV诱导的分泌均增强,反向验证上述效应。
本研究提示MIB2参与了肝癌恶性生长的调控。然而,MIB2在肝癌的发生和转移中扮演着怎样的角色,还需后期的大量实验研究去揭示。如果使用 MIB2 激动剂,可能会抑制IL-6的自分泌,进而抑制肝癌细胞的恶性生长,但目前市场上尚无成品 MIB2 激动剂出售[23]。随着科学技术的发展和不断进步,将来可能会有MIB2 激动剂出现,可能用于临床肝癌的治疗。